
- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
Амінокислотний склад білків
Білки різного походження відрізняються один від одного кількістю у них амінокислот. В даний час вивчений амінокислотний склад багатьох сотень білків мікроорганізмів, рослин і тварин.
Кількісний амінокислотний аналіз застосовується для характеристики будь-якого білкового препарату. Кожен білок має цілком визначений амінокислотний склад.
У ряді білків цілком відсутні деякі амінокислоти (наприклад, зеїн кукурудзи не містить лізину, треоніну і гліцину). Отже, білки можуть бути повноцінними і неповноцінними за амінокислотним складом. Так, казеїн молока і яєчний альбумін є повноцінними білками: в них містяться всі протеїногенні амінокислоти, у тому числі і незамінні. Навпроти, колаген і зеїн кукурудзи - неповноцінні білки, оскільки в них відсутній ряд амінокислот, включаючи і незамінні.
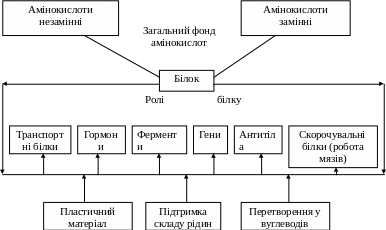
2.3. Біологічна роль окремих амінокислот
Гліцин або глікокол. Гліцин є попередником пуринового кільця гема крові і утворює так звані парні сполуки з жовчними кислотами, наприклад, холевою кислотою, він утворює глікохолієву кислоту, з бензойною кислотою - гіппурову кислоту.
Глікохолієва кислота бере участь у процесі засвоєння ліпідів, а у формі гіппурової кислоти з організму виводиться токсична бензойна кислота.
Як бічний ланцюжок він входить до складу циклічних амінокислот (фенілаланін, тирозин, гістидин, триптофан). Біологічна роль визначається також наявністю його похідних: серин, цистеїн, цистін, треонін, метіонін.
Цистеїн. У тканинах організму легко здійснюється ферментативна окиснювально-відновна реакція, обумовлена наявністю в цистеїні реакційно здатної SH-групи. При цьому утворюється цистін.
Властивість даної амінокислоти окиснюватися додає їй захисні і радіопротекторні властивості. У присутності цистеїну знижується інтенсивність окисних процесів у ліпідах і білках, підвищується стійкість організму до іонізуючого випромінювання і стабілізується якість прийнятих лікарських препаратів. При участі двох залишків цистеїну в поліпептидних ланцюгах утворюються дисульфідні зв'язки, що обумовлюють біологічну активність або функціональні властивості білків у складі їжі. Особливо важливу роль дисульфідні зв'язки грають у білках пшениці, тому що вони додають клейковині пружні властивості.
Три амінокислоти - аргінін, гліцин і метіонін - беруть участь у синтезі креатину - сполуки, за допомогою якого в м'язовій тканині відбувається безперервний ресинтез макроерга АТФ (аденозинтрифосфорної кислоти).
При участі креатину в організмі людини і тварин утворюється креатин- фосфат, що у міру необхідності віддає свою фосфатну групу молекулам АДФ, перетворюючись в креатинін:
![]()
Креатин і циклічний креатинін входять до складу м'ясного екстракту, їхнє співвідношення залежить від рН середовища і температури. Так, при нагріванні м'яса в кислому середовищі в екстракті переважає креатинін.
Амінокислоти цитруллін і орнітин беруть участь разом з аргініном у циклі утворення сечовини в людини і тварин.
Фундаментальну роль в обміні речовин живих організмів грають глутамінова і аспарагінова кислоти. Вони беруть участь у процесах розщеплення, синтезу і переносу активних груп, часто у формі амідів.
Глутамін, наприклад, є основною формою переносу аміаку в крові людини і разом з аспарагіновою кислотою служить попередником пиримідинового кільця нуклеотидів.
Реакції декарбоксилювання глутамінової кислоти з утворенням -аміномасляної кислоти, що відноситься до групи медіаторів центральної нервової системи, приділяється важлива роль в обміні речовин у мозку і нервовій тканині.
З обміном глутамінової кислоти тісно зв'язаний обмін проліну, що синтезується з неї в результаті відновлення проліндегідрогеназою. Пролін відіграє важливу роль у формуванні структури колагену і білків пшеничної клейковини, викликаючи вигини в поліпептидних ланцюгах.
У колагені, поряд із проліном, зустрічаються 4-оксипролін і 5-оксилізин, що утворюються за рахунок окиснювання відповідних амінокислот вже після включення в білок. Присутність оксипроліну в м'ясних і ковбасних виробах впливає на їхню якість і враховується при її оцінці.
Основна фізіологічна роль іншої сірковмісної амінокислоти - метіоніну зв'язана з наявністю лабільної метильної групи. Віддаючи групу -СН3 метіонін бере участь у синтезі гліцерофосфоліпідів. Фізіологічна роль амінокислоти серин полягає в тому, що у великій кількості входить до складу складних білків - фосфопротеїдів (казеїну молока і вітелліну яйця).
Серин, у свою чергу, синтезується з гліцину під дією ферменту, що містить тетрагідрофолієву кислоту (ТГФК).
Незамінна амінокислота триптофан служить попередником нікотинової кислоти, серотоніну і індолілоцтової кислоти - гормону росту рослин. Серотонін, володіючи судинозвужувальною дією, синтезується в клітинах кишечнику і нервової тканини.
Тирозин є відповідальним за пігментацію волосся, шкіри, очей, за темний колір харчових продуктів (наприклад, житнього хліба), тому що з його участю синтезуються темнозабарвлені пігменти - меланіни. Механізм реакції до кінця не вивчений, але відомі перші етапи їхнього синтезу. Під дією мідьвмісного ферменту тирозин перетворюється в диоксифенілаланін (ДОФА), що далі окиснюється, циклізується, утворюється індолхінон. Полімеризація останнього приводить до синтезу меланинів.
Утворення меланинів підсилюється під впливом ультрафіолетових променів (при засмазі) і може бути причиною злоякісних новоутворень. При спадкоємному захворюванні - альбінізмі, що характеризується відсутністю ферменту тирозинази, навпаки, не спостерігається пігментація шкіри, волосся. Тирозин утворюється з фенілаланіну.
З тирозину і триптофану, що містяться в їжі, при участі мікробних ферментів у кишечнику утворюються отрутні продукти - крезол, фенол, скатол, індол, знешкодження яких відбувається в печінці шляхом зв'язування із сірчаною або глюкуроновою кислотою з утворенням нетоксичних (парних) кислот, наприклад, фенол-сірчаної кислоти.
У результаті декарбоксилювання амінокислот в організмі утворюються деякі важливі біогенні аміни. Декарбоксилювання аспарагінової кислоти забезпечує синтез аланіну, що є складовою частиною біологічно активних сполук – КоА й АПБ, а декарбоксилювання лізину й орнітину під впливом ферментів кишкової мікрофлори призводить до утворення отрутних діамінів - кадаверину і путресцину. У здоровому організмі обидва аміни цілком знешкоджуються в слизуватій оболонці кишечнику.
Частина амінокислот виконує роль медіаторів - речовин, що беруть участь у передачі нервових імпульсів від однієї нервової клітини до іншої. При роздратуванні нервових волокон медіатори реагують зі специфічним рецептором і забезпечують відповідну фізіологічну функцію: регуляцію сну, пильнування, серцево-судинну діяльність, терморегуляцію тіла. До медіаторів відносяться ацетилхолін, глютамінова і аспарагінова кислоти, гліцин, гістамін, серотонін, норадреналін та інші.
Таким чином, наведені відомості показують, яку велику роль грають амінокислоти в синтезі найважливіших фізіологічно активних сполук в організмі і забезпеченні деяких властивостей харчової сировини і продуктів.
Майже усі -амінокислоти, що надходять із травного тракту людини в кров'яне русло організму, перетерплюють ряд загальних перетворень, призначення яких полягає в забезпеченні пластичним матеріалом процесів синтезу білків і пептидів.
