
14 Билет
А) Термолабильность ферментов. Скоростьхимическихреакцийзависитот
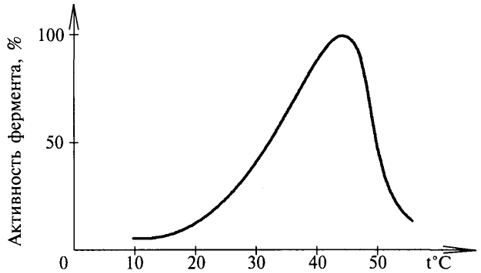
температуры, поэтомукатализируемые ферментами реакции также чувствительны к изменениям температуры. При температуре 100°С почти все ферменты утрачивают свою активность (исключение фермент мышечной ткани – миокиназа). Оптимальной для действия большинства ферментов теплокровных животных является температура 40°С; При низких температурах (0°С и ниже) ферменты не разрушаются, хотя активность их падает почти до нуля.Биохимические реакции повышаются в 2 раза при повышении температуры на 10°С и, наоборот - температурный коэффициент. Но из-за белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции.На термолабильность ферментов определенное влияние оказывает концентрация субстрата, рН среды и другие факторы.
.
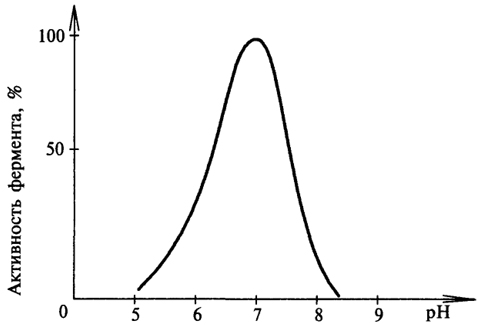
Б)Зависимость активности фермента от рН-среды. Большинство ферментов проявляет максимальную активность при значениях рН, близких к нейтральным. Лишь некоторые ферменты активны в сильно кислой или сильно щелочной среде. Например, активность пепсина - максимальна при рН 1,5 - 2,5. В щелочной среде активны ферменты, локализованные в кишечнике. Изменение оптимального для данного фермента значения рН-среды может привести к изменению третичной стурктуры фермента, что скажется на его активности. С другой стороны, при изменении рН может измениться
ионизация субстрата, что повлияет на образование фермент-субстратного комплекса.Имеет значение, кроме того, состояние ионизации субстратов и кофакторов.
В) Специфичность действия ферментов - одно из главных их свойств. Специфичность - это избирательность фермента по отношению к субстрату (или субстратам).Различают несколько видов специфичности.
Стереохимическая субстратная специфичность - фермент катализирует превращение только одного стереоизомера субстрата. Например, фумаратгидратаза катализирует присоединение молекулы воды к кратной связи фумаровой кислоты, но не к ее стереоизомеру - малеиновой кислоте.
Абсолютная субстратная специфичность - фермент катализирует превращение только одного субстрата. Например, уреаза катализирует гидролиз только мочевины.
Групповая субстратная специфичность - фермент катализирует превращение группы субстратов сходной химической структуры. Например, алкогольдегидрогеназа катализирует превращение этанола и других алифатических спиртов, но с разной скоростью.
Г)Влияние на активность ферментов активаторов и ингибиторов.К числу факторов, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg2+, Zn2+, K+ и Со2+, а из анионов - Сl-.Ингибиторы тормозят действие ферментов. Ингибиторами могут быть как эндогенные, так и экзогенные вещества.
Изоферменты, или изоэнзимы,– это множественныеформыфермента, ка-
тализирующиеодну и тужереакцию, ноотличающиесядруготдругапо
физическим и химическимсвойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции и регуляторным свойствам.
Изучение появления изоферментов ферментов в сыворотке крови может представлять интерес в диагностике органических и функциональных поражений органов и тканей. По изменению содержания изоферментов в сыворотке крови можно судить как о топографии патологического процесса, так и о степени поражения органа или ткани.
По строению ферменты делятся напростые (однокомпонентные) и сложные(двухкомпонентные). Простой фермент состоит только из белковой части; в состав сложного фермента входит белковая и небелковая составляющие. Иначе сложный фермент называют холоферментом. Белковую часть в его составе называют апоферментом, а небелковую - коферментом.Особенностью сложных ферментов является то, что отдельно апофермент и кофермент не обладают каталитической активностью.
Каталитический центр простого фермента представляет собой сочетание нескольких аминокислотных остатков, расположенных на разных участках полипептидной цепи. Образование каталитического центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в состав каталитического центра простого фермента входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспарагиновой и глутаминовой кислот.В сложных ферментах роль каталитического центра выполняет кофермент, который связывается с апоферментом в определенном участке - кофермент связывающем домене.
Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому какого-то низкомолекулярного вещества изменяется третичная структура белковой молекулы фермента, что влечет за собой изменение его активности. Аллостерический центр является регуляторным центром фермента.
Адсорбционный центр- участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра). Эта сорбция происходит только за счет слабых типов связей и потому является обратимой.
Различают три основных этапа ферментативного катализа.
1 этап.
Ориентировочная сорбция субстрата на активном центре фермента с образованием обратимого фермент-субстратного комплекса. На этом этапе происходит взаимодействие адсорбционного центра фермента с молекулой субстрата. При этом и субстрат подвергается конформационной перестройке. Кинетическая характеристика 1-го этапа ферментативного катализа - константа Михаэлиса (Км).
2 этап.
Химические превращения молекулы субстрата в составе фермент-субстратного комплекса с образованием комплекса фермента с химически преобразованным субстратом. На этом этапе разрываются одни ковалентные связи и возникают новые. Поэтому этот этап протекает значительно медленнее, чем 1-й и 3-й этапы. Именно скорость второго этапа определяет скорость всей ферментативной реакции в целом. Кинетическая характеристика 2-го этапа - максимальная скорость (Vmax).
3 этап.
Десорбция готового продукта из его комплекса с ферментом. Этот этап протекает легче, чем 2-й. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции.
Фермент сахараза относится к классу гидролаз.Фермент сахараза катализирует реакцию гидролитического расщепления дисахарида сахарозы с образованием глюкозы ифруктозы. Наличие конечного продукта реакции – глюкозы определяют спомощью реакции Троммера.
Ход работы. В 2 пробирки наливают по 1 мл раствора сахаразы (вытяжки из дрожжей). В 1-й пробирке раствор кипятят в течение 2-х минут, во2-й - оставляют без кипячения. Затем в обе пробирки добавляют по 2 мл сахарозы, перемешивают, оставляют при 37ºС. Через 10 минут с содержимымпробирки проводят качественную реакцию на глюкозу – реакцию Троммера.Под действием сахаразы в растворе появится глюкоза и фруктоза. Полученные результаты объясняют и делают вывод о зависимости активности фермента от температуры.
(ниже)
БИЛЕТ 15
В основу принятой классификации положен принцип – тип катализируемой реакции , который является специфичным для действия любого фермента. Этот принцип логично использовать в качестве основы для классификации и номенклатуры ферментов.Таким образом, тип катализируемой химической реакции в сочетании с названием субстрата (субстратов) служит основой для систематического наименования ферментов.
По этому принципу все ферменты делят на 6 классов.
1. Оксидоредуктазы — ускоряют реакции окисления — восстановления. Окисление протекает как процесс отнятия атомов Н (электронов) от субстрата, а восстановление — как присоединение атомов Н (электронов) к акцептору. Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы (ЛДГ). 2. Трансферазы — ускоряют реакции переноса функциональных групп и молекулярных остатков. Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-трансферазы, фосфотрансферазы и др. 3. Гидролазы — ускоряют реакции гидролитического распада. К ним относятся: зстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; ами-дазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др. 4. Лиазы — ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи). Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др. 5. Изомеразы — ускоряют пространственные или структурные перестройки в пределах одной молекулы. К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.
6. Лигазы — ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей. В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-за»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин.
2.Особую группу ферментов составляют надмолекулярные (или мульти-молекулярные) ферментные комплексы, в состав которых входят не субъединицы (в каталитическом отношении однотипные протомеры), а разные ферменты, катализирующие последовательные ступени превращения какого-либо субстрата. Отличительными особенностями подобных муль-тиферментных комплексов являются прочность ассоциации ферментов и определенная последовательность прохождения промежуточных стадий во времени, обусловленная порядком расположения каталитически активных (различных) белков в пространстве («путь» превращения в пространстве и времени). Типичными примерами подобных мультиферментных комплексов являются пируватдегидрогеназа и α-кетоглутаратдегидрогеназа, катализирующие соответственно окислительное декарбоксилирование пиро-виноградной и α-кетоглутаровой кислот в животных тканях (см. главу 10), и синтетаза высших жирных кислот (см. главу 11). Молекулярные массы этих комплексов в зависимости от источника их происхождения варьируют от 2,3•106 до 10•106. Ассоциация отдельных ферментов в единый недиссо-циирующий комплекс имеет определенный биологический смысл и ряд преимуществ. В частности, при этом резко сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться при действии изолированных ферментов. Ряд таких мультиферментных комплексов, иногда называемых ферментными ансамблями, структурно связан с какой-либо органеллой (рибосомы, митохондрии) или с биомембраной и составляет высокоорганизованные надмолекулярные системы, обеспечивающие жизненно важные функции, например тканевое дыхание (перенос электронов от субстратов к кислороду через систему дыхательных ферментов).
3. САХАРАЗА (инвертин), секретируемый железами тонкого кишечника фермент, который катализирует гидролиз сахарозы на составные части (глюкозу и фруктозу),относится к группе гидролаз. Чрезвычайно распространена в различных видах дрожжей и в других тайнобрачных и высших растениях; в животном организме находится в слизистой оболочке тонких кишок, а также вероятно в кишечном соке и в лейкоцитах;
Наличие конечного продукта реакции – глюкозы определяют с помощью реакции Троммера.
Ход работы. В 2 пробирки наливают по 1 мл раствора сахаразы (вытяжки из дрожжей). В 1-й пробирке раствор кипятят в течение 2-х минут, во2-й - оставляют без кипячения. Затем в обе пробирки добавляют по 2 мл сахарозы, перемешивают, оставляют при 37ºС. Через 10 минут с содержимым пробирки проводят качественную реакцию на глюкозу – реакцию Троммера Полученные результаты объясняют и делают вывод о зависимости активности фермента от температуры.
.4 К этой группе принадлежат ферменты, катализирующие окислительно-восстановительные реакции, происходящие при дыхании и брожении. К дегидразам относятся ферменты, катализирующие реакцию дегидрирования, т. е. отнятие водорода от какого-либо вещества.
В зависимости от природы акцептора водорода, которому восстановленные дегидразы способны передавать водород, они делятся на анаэробные и аэробные дегидразы.
Анаэробные дегидразы не могут отдавать водород, отнятый ими от окисляемого вещества, кислороду воздуха, а передают его другим акцепторам (флавиновым ферментам, цитохромной системе и др.). Иногда их называют первичными дегидразами.
По химической природе анаэробные дегидразы являются двухкомпонентными ферментами, состоят из белка и активной группы — кофермента, который раньше часто называли козимазой или кодегидразой I. Более правильно называть этот ко-фермент в соответствии с его химической структурой никотинамид-аденин-динуклеотид (сокращенно НАД). В состав кофермента входит витамин РР—амид никотиновой кислоты. Этот кофермент — исключительно реакционноспособная окислительно-восстановительная система, играющая важную роль в процессе спиртового и молочнокислого брожения.
Коферментом других анаэробных дегидраз является кодегидраза II (НАДФ—никотинамид-аденин-динуклеотид-фосфат). Анаэробные дегидразы окисляют (дегидрируют) самые разнообразные субстраты: молочную, яблочную и глютаминовую кислоты, глюкозу, различные углеводы и спирты. Специфичность их действия зависит от особенностей белка, с которым связан данный кофермент.
К группе аэробных дегидраз принадлежат ферменты, в состав активной группы которых входит витамин В2. Эти ферменты представляют собой соединение витамина с белком. Способность таких флавиновых ферментов отнимать водород от окисляемого вещества и передавать его другим соединениям или непосредственно кислороду связана с тем, что их активная группа легко подвергается обратимому окислению и восстановлению.
5.
. Согласно этой теории, свободная энергия
транспорта электронов в дыхательной
цепи затрачивается на перенос из
митохондрий через митохондриальную
мембрану на ее наружную сторону ионов
Н+.
В результате на мембране возникает
разность электрич. потенциалов
![]() и
разность хим. активностей ионов
Н+
и
разность хим. активностей ионов
Н+
![]() (внутри
митохондрий рН выше, чем снаружи). В
сумме эти компоненты дают трансмембранную
разность электрохимических потенциалов
ионов
водорода
(внутри
митохондрий рН выше, чем снаружи). В
сумме эти компоненты дают трансмембранную
разность электрохимических потенциалов
ионов
водорода
![]() между
матриксом митохондрий и внешней водной
фазой, разделенными мембраной:
между
матриксом митохондрий и внешней водной
фазой, разделенными мембраной:
![]()
|
Райкин
где
R-универсальная
газовая постоянная, T-абсолютная
температура, F-
число
Фарадея. Величина
![]() обычно
составляет около 0,25 В, причем основная
часть (0,15-0,20 В) представлена электрической
составляющей
обычно
составляет около 0,25 В, причем основная
часть (0,15-0,20 В) представлена электрической
составляющей
![]() .
Энергия
.
Энергия
![]() ,
выделяющаяся при движении протонов
внутрь митохондрий по электрическому
полю в сторону меньшей их концентрации
(рис. 2, процесс 2), используется
АТФ-синтетазой для синтеза АТФ. Т. обр.,
схему окислительное фосфорилирование,
согласно этой концепции, можно представить
в следующем виде:
,
выделяющаяся при движении протонов
внутрь митохондрий по электрическому
полю в сторону меньшей их концентрации
(рис. 2, процесс 2), используется
АТФ-синтетазой для синтеза АТФ. Т. обр.,
схему окислительное фосфорилирование,
согласно этой концепции, можно представить
в следующем виде:
Перенос
электронов (дыхание)
![]() АТФ
АТФ
