
- •5. Теплоемкость. Уравнение состояния. Замена независимых переменных
- •6. Применение первого закона термодинамики к простым системам. Идеальный газ, изопроцессы
- •9. Свободная энергия и потенциал Гиббса. Количество вещества и химический потенциал
- •10. Третий закон термодинамики. Теорема Нернста
- •11. Фаза. Равновесие между фазами чистого вещества
- •12. Кривая равновесия фаз. Уравнение Клапейрона-Клаузиуса
- •13. Тройная точка. Фазовые переходы 1-го и 2-го рода
- •14. Критическое состояние вещества. Закон соответственных состояний
5. Теплоемкость. Уравнение состояния. Замена независимых переменных
Теплоемкость C системы равна количеству теплоты, которое надо подвести при заданных условиях к системе, чтобы повысить ее температуру на единицу (обычно на 1 К):
![]() .
(5.1)
.
(5.1)
Вводят также удельную (массовую) теплоемкость c = C/m и молярную C = C/m теплоемкости, где m – масса тела, – молярная масса вещества.
Так как теплота – функция процесса, теплоемкость зависит от конкретного вида процесса. Наибольший практический интерес вызывают теплоемкость при постоянном объеме
![]() (5.2)
(5.2)
и при постоянном давлении
![]() .
(5.3)
.
(5.3)
Обычно в эксперименте измеряют CP, тогда как теоретически удобнее рассчитывать CV. Поэтому важно установить между ними связь. Если внутренняя энергия задана как функция U(V,T), то эта связь устанавливается соотношением
![]() ,
(5.4)
,
(5.4)
доказать которое рекомендуется в
качестве упражнения. Для идеального
газа
![]() ,
,
![]() ,
и из уравнения (4) получаем известное
соотношение Майера:
,
и из уравнения (4) получаем известное
соотношение Майера:
![]() .
.
Величины в правой части формулы (4) могут
быть связаны с экспериментально
определяемыми величинами: коэффициентом
теплового расширения
![]() и изотермической сжимаемостью вещества
и изотермической сжимаемостью вещества
![]() .
.
Эта связь имеет вид
![]() .
(5.5)
.
(5.5)
Уравнение состояния. Равновесные
состояния термодинамической системы
полностью характеризуются некоторым
относительно небольшим набором
независимых термодинамических параметров,
например, давлением p,
объемом V, температурой
T, намагниченностью
![]() ,
поляризацией вещества
,
поляризацией вещества
![]() и т.п. Существующая между термодинамическими
параметрами конкретной системы связь
устанавливается уравнением состояния.
К таким уравнениям относятся, например:
и т.п. Существующая между термодинамическими
параметрами конкретной системы связь
устанавливается уравнением состояния.
К таким уравнениям относятся, например:
pV = constT – уравнение состояния идеального газа;
(p + a/v2)(v – b) = constT – уравнение Ван дер Ваальса,
где a, b – постоянные, v – удельный объем.
Для каждой конкретной системы уравнения состояния определяются эмпирически или методами статистической механики, так что в рамках термодинамики они считаются заданными при определении системы.
Замена независимых переменных.
Иногда в термодинамике в качестве
независимых переменных рассматриваются
p и V,
а иногда T и V.
Поэтому в записи частных производных
необходимы индексы, указывающие на то,
какие переменные сохраняются постоянными,
например
![]() или
или
![]() .
.
Для замены независимых переменных удобно пользоваться тождеством
![]() (5.6)
(5.6)
или
![]() .
(5.7)
.
(5.7)
Эти соотношения легко получить из равенства
![]() .
(5.8)
.
(5.8)
Если z = const,
то dz = 0
и отношение dx/dy = ![]() должно иметь вид (7).
должно иметь вид (7).
6. Применение первого закона термодинамики к простым системам. Идеальный газ, изопроцессы
Идеальный газ – модель реального газа, которая удовлетворяет следующим требованиям:
расстояние между молекулами гораздо больше их размеров (молекулы можно считать материальными точками);
силами взаимодействия, кроме моментов соударения, можно пренебречь (потенциальная энергия взаимодействия молекул по сравнению с кинетической энергией хаотического движения пренебрежимо мала);
столкновение молекул друг с другом и со стенками абсолютно упругое;
движение каждой молекулы подчиняется классическим законам динамики.
реальный разреженный газ приблизительно ведет себя как идеальный газ.
Изопроцессы – равновесные процессы, в которых один из основных параметров сохраняется.
Изобарный процесс (![]() )
Для изобарного процесса в идеальном
газе справедлив закон Гей-Люссака: при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
)
Для изобарного процесса в идеальном
газе справедлив закон Гей-Люссака: при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
![]() или
или
![]() .
.
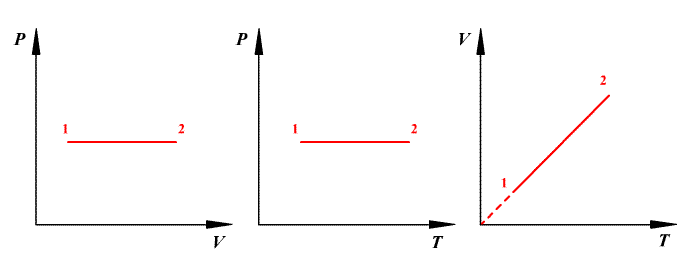
Работа газа при изобарном расширении:
![]() .
.
Изменение внутренней энергии:
![]()
Количество полученного тепла:
![]() .
.
Молярная теплоемкость при изобарном процессе:
![]() .
.
Изохорный процесс (![]() )
Изохорный процесс в идеальном газе
описывается законом Шарля: при постоянном
объеме давление данной массы газа прямо
пропорционально его термодинамической
температуре:
)
Изохорный процесс в идеальном газе
описывается законом Шарля: при постоянном
объеме давление данной массы газа прямо
пропорционально его термодинамической
температуре:
![]() или
или
![]() .
.
Работа газа при изохорном процессе
равна нулю:
![]() .
.
Все полученное тепло идет на изменение внутренней энергии согласно первому закону термодинамики:
![]() .
.
Молярная теплоемкость при изохорном процессе:
![]() .
.
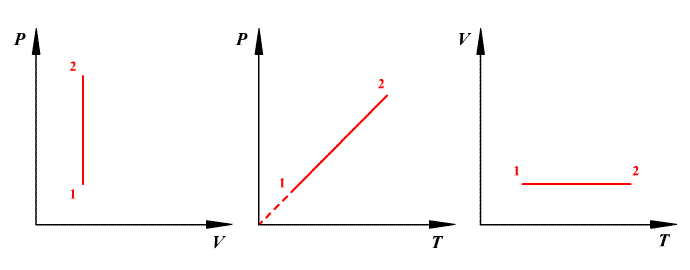
Изотермический процесс (![]() )
Изотермический процесс в идеальном
газе подчиняется закону Бойля - Мариотта:
для данной массы газа при неизменной
температуре произведение значений
давления и объема есть величина
постоянная:
)
Изотермический процесс в идеальном
газе подчиняется закону Бойля - Мариотта:
для данной массы газа при неизменной
температуре произведение значений
давления и объема есть величина
постоянная:
![]() или
или
![]() .
.
Работа газа при изотермическом расширении:
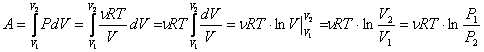 .
.
Изменение внутренней энергии при изотермическом процессе равно нулю:
![]() .
.
Все полученное тепло идет на совершение работы в соответствии с первым началом термодинамики:
![]() .
.
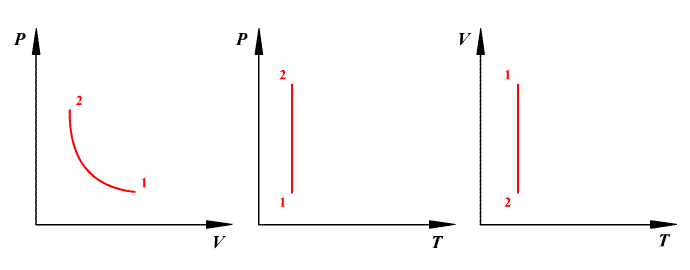
Адиабатный процесс – процесс, при котором отсутствует теплообмен между системой и окружающей средой.
Из первого начала термодинамики следует, что работа газа при адиабатном процессе совершается за счет его внутренней энергии:
![]() (6.1)
(6.1)
С другой стороны, из уравнения Клапейрона-Менделеева следует:
![]() (6.2).
(6.2).
Разделим уравнение (2) на уравнение (1):
![]() ,
,
где показатель адиабаты: ![]() .
.
Проинтегрируем полученное уравнение:
![]() .
.
Таким образом, при адиабатном процессе
![]() или
или
![]() – уравнение Пуассона. С учетом уравнения
Клапейрона-Менделеева (
– уравнение Пуассона. С учетом уравнения
Клапейрона-Менделеева (![]() ,
,![]() )
уравнение Пуассона может быть представлено
в виде:
)
уравнение Пуассона может быть представлено
в виде:
![]() или
или
![]() ;
;
![]() или
или
![]() .
.
График адиабатного процесса — более
крутая кривая, чем гипербола при
изотермическом процессе. Это следует
из выражения производной
![]() ,
полученной из уравнения Пуассона.
,
полученной из уравнения Пуассона.
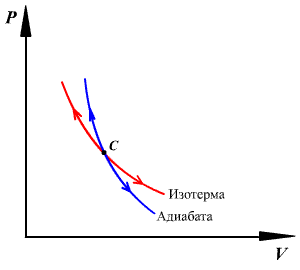
Работа газа при адиабатном процессе равна убыли внутренней энергии:
![]() .
.
Политропный процесс.
Рассмотренные изобарный, изохорный, изотермический и адиабатический процессы имеют общую особенность – они происходят при постоянной теплоемкости.
В первых двух процессах теплоемкости соответственно равны СV и Сp, в изотермическом процессе (dT = 0) теплоемкость равна ±∞, в адиабатическом (δQ = 0) теплоемкость равна нулю.
Процесс, в котором теплоемкость остается неизменной, называется политропным.
Исходя из первого начала термодинамики при условии постоянства теплоемкости (C = const) можно вывести уравнение политропы:
![]() (6.3)
(6.3)
где n = (С – Сp)/(С – СV) – показатель политропы.
При С = 0, n = γ, из (3) получается уравнение адиабаты; при С = 0, n = 1 – уравнение изотермы; при С = Сp, n = 0 – уравнение изобары, при С = СV, n = ±∞ – уравнение изохоры. Таким образом, все рассмотренные процессы являются частными случаями политропного процесса.
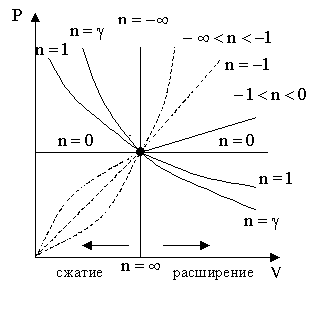
Теплота в политропном процессе: ![]() ,
,
где С – теплоемкость политропного процесса.
Процессы расширения
1.![]() :
:
![]() (тепло
подводится),
(тепло
подводится),
![]() .
.
2.
![]() :
,
:
,
![]() .
.
3.
![]() :
:
![]() (тепло
отводится),
.
(тепло
отводится),
.
Процессы сжатия
1. : , .
2. : , .
3. : , .
