
- •1. Введение
- •1.1. Принципы экспериментального исследования
- •1.2. Цели и задачи экспериментального исследования применительно к минерально-сырьевому комплексу
- •1.3. Нормирование научноисследовательской работы
- •1.4. Контрольные вопросы
- •2. Физическое моделирование как метод научного эксперимента
- •2.1. Методы научных исследований
- •2. Индукция и дедукция.
- •3.Анализ и синтез
- •4. Научные идеи и гипотезы.
- •5. Абстракция и обобщение.
- •6. Моделирование.
- •2.2. Физические системы и их характеристики
- •2.3. Основные понятия и Методлология экспериентального исследования
- •2.4. Контрольные вопросы
- •3. Экспериментальные иСследования с использованием математического моделирования на основе базовых законов естествознания
- •3.1. Принципы математического моделирования
- •3.2. Информационная основа и этапы математического моделирвания
- •3.3. Обобщенная структурная модель металлургического процесса
- •3.4. Моделирование равновесий в физико-химических системах
- •3.5. Моделирование физико-химических процессов
- •3.5.1. Основные закономерности химической кинетики
- •3.6. Контрольные вопросы
- •4. Экспериментально-статистические методы исследования
- •4.1. Статистические методы получения математических моделей. Корреляционный анализ
- •4.2. Планирование эксперимента
- •Две полуреплики 23-1от пфэ 23
- •Распределение f-критерия Фишера при 5-процентном уровне значимости
- •4.3. Контрольные вопросы
- •5. Решение задачи оптимизации технологических параметров
- •5.1. Метод покоординатной оптимизации
- •5.2. Метод крутого восхождения
- •5.3. Симплексный метод планирования
- •5.4. Контрольные вопросы
- •6. Техника экспериментальных измерений. Масштаб научного эксперимента
- •6.1. Основы измерения физических величин и приборной базы
- •6.2. Место и значение Опытно-технологической стадии в жизненном цикле продукции
- •4) Этап «Проведение приемочных (государственных испытаний)»
- •6.3. Контрольные вопросы
- •7. Основные понятия в области Научно-исследовательской и опытно-конструкторской работы (ниокр)
- •8. Заключение
- •9. Библиографический список
- •Содержание
3.4. Моделирование равновесий в физико-химических системах
Термодинамический анализ выполняется с целью выбора оптимального технологического режима по данным о достижении равновесия для химического взаимодействия или процесса. Вероятность подхода к равновесию для системы, находящейся в стандартном состоянии, оценивается по величине стандартного изменения энергии Гиббса ΔG0T. При ΔG0T 0 возможно самопроизвольное протекание процесса, а при ΔG0T 0 процесс невозможен.
Знание условий равновесия позволяет определить главную характеристику реакции – константу химического равновесия, рассчитать теоретический выход любого продукта, степень использования реактивов, оценить оптимальные условия проведения процесса. Константа равновесия может быть определена по экспериментальным данным о равновесии в системе или по величине стандартного измерения энергии Гиббса:
![]() ,
(3.9)
,
(3.9)
где: Кр – константа равновесия;
R – универсальная газовая постоянная;
Т – температура процесса, К.
Расчет стандартного изобарного потенциала реакции обычно проводится на основе уравнения
![]() ,
(3.10)
,
(3.10)
с использованием приводимых в справочной литературе величин стандартных энтальпий образования ΔH0f,298, стандартных энтропий S0f,298, энтальпий фазовых превращений ΔHФП и теплоемкостей Ср веществ.
Если в интервале температур 298 ÷ Т реагирующие вещества претерпевают k фазовых превращений, то в общем случае выражения для расчетов ΔH0f,T и S0f,T имеют вид:
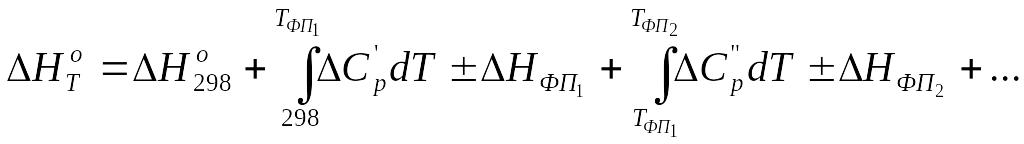
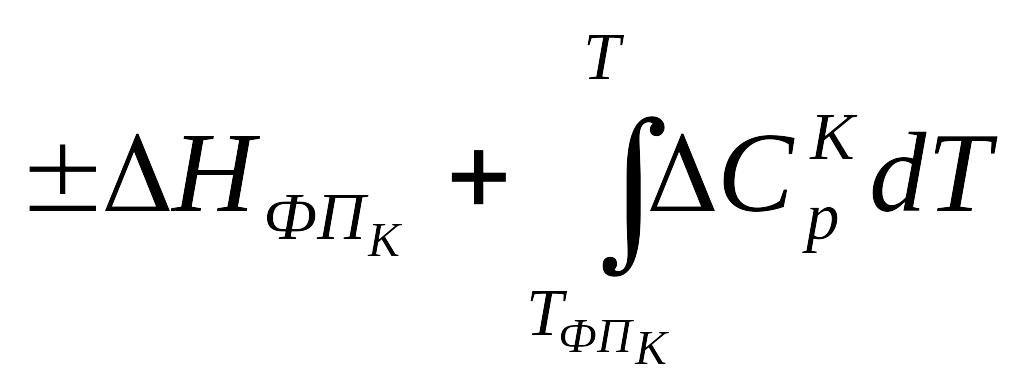 ,
(3.11)
,
(3.11)
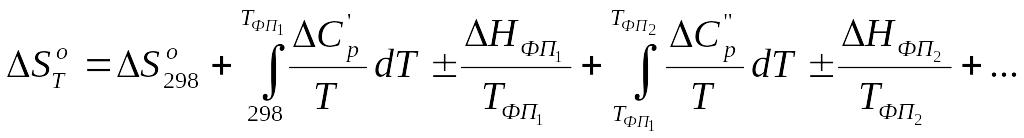
 ,
(3.12)
,
(3.12)
В приведенных уравнениях
![]() (3.13)
(3.13)
![]() (3.14)
(3.14)
![]() (3.15)
(3.15)
Энтальпии фазовых превращений для продуктов реакции берутся со знаком, приводимым в справочной литературе; для исходных веществ принимается противоположный знак.
Теплоемкости веществ обычно приводятся в виде интерполяционных уравнений типа
Ср = а + bТ + сТ -2, (3.16)
что позволяет, проведя интегрирование в общем виде, получить расчетные формулы для стандартного изменения энергии Гиббса ΔG0T.
Рассчитанные значения изменения изобарных потенциалов, участвующих в реакции веществ, табулируются, после чего удобно провести их суммирование согласно формулам (3.13, 3.14,) с учетом стехиометрических коэффициентов и принадлежности веществ к исходным или конечным. По полученным значениям ΔG0T.согласно уравнению (3.9) рассчитываются значения Кр. При постоянной температуре величина константы равновесия является численным выражением закона действующих масс и для реакции
![]() (3.17)
(3.17)
имеет вид:
![]() (3.18)
(3.18)
Последнее уравнение позволяет производить анализ равновесных соотношений компонентов при изменении активности одного из них, а также, дополняя уравнение (3.18) уравнениями материальных балансов элементов и уравнением электрического баланса, определить равновесные значения активностей индивидуальных участников химического взаимодействия. При решении вопроса о равновесном составе нескольких сопряженных реакций эту систему уравнений необходимо дополнить уравнениями частных равновесий.
Определение возможности или направления протекания процесса при данных исходных условиях основано на использовании уравнения изотермы химической реакции (изотермы Bант-Гоффа)
![]() при Т,
Р = const,
(3.19)
при Т,
Р = const,
(3.19)
где Кр' – величина, выражающая степень неравновесности произвольно взятой системы и рассчитываемая по уравнению (3.18) для начального значения активностей конденсированных фаз и парциальных давлений газов.
Концентрационная константа равновесия имеет самостоятельное значение для расчетов расхода реагента при извлечении металла в раствор. Например, при растворении оксидов металлов кислотами процесс описывается в общем виде следующими уравнениями:
а) для двухосновной кислоты и двухвалентного металла:
МеО(т) + Н2А(р) = МеА(р) + Н2О, (3.20)
где А – анион кислоты.
Константа равновесия этой реакции:
![]() . (3.21)
. (3.21)
После достижения равновесия, когда металл практически растворится, в растворе должен остаться избыток растворителя (кислоты):
![]() (3.22)
(3.22)
или
![]() (3.23)
(3.23)
где ni – число молей вещества.
Кроме этого, для растворения оксида металла в соответствии с уравнением реакции (13) необходим 1 моль кислоты на 1 моль оксида. Таким образом, для полного растворения оксида металла необходимо взять кислоты в количестве на менее, чем
![]() ,
,
![]() . (3.24)
. (3.24)
Минимальная исходная концентрация кислоты в растворе составит:
![]() , (3.25)
, (3.25)
где V – объем раствора.
б) для одноосновной кислоты и двухвалентного металла уравнение реакции имеет вид:
МеО(т) + 2НА(р) = МеА2(р) + Н2О, (3.26)
Константа равновесия этой реакции:
![]() . (3.27)
. (3.27)
Избыточное количество кислоты в конце реакции:
![]() (3.28)
(3.28)
или
![]() (3.29)
(3.29)
Кроме того, для растворения оксида металла в соответствии с уравнением реакции (3.26) необходимо иметь 2 моля кислоты на 1 моль оксида. Таким образом, для полного растворения оксида необходимо использовать кислоту в количестве не менее, чем
![]() ,
, ![]() . (3.30)
. (3.30)
Исходная концентрация кислоты в растворе должна быть не менее, чем:
![]() (3.31)
(3.31)
Для экспериментального определения Кс нужно взять некоторое количество исходных веществ (оксида и кислоты) и фиксировать изменение во времени концентрации исходных веществ и продуктов реакции вплоть до установления равновесия при постоянной температуре.
Величину Кс
определяют графической экстраполяцией
(рис. 3.5) при
![]() отношений
отношений
 или
или
 .
.
