
- •1. Общие сведения о крахмале и крахмалопродуктах
- •2. Технология производства картофельного крахмала
- •3. Модифицированные крахмалы
- •4. Производство кукурузного крахмала
- •5. Производство тапиокового крахмала
- •1 Введение. Виды белковых препаратов. Краткая характеристика. Области применения
- •2 Характеристика препаратов, производимых на основе глутаминовой кислоты и области применения.
- •3 Характеристика продуцентов глутаминовой кислоты.
- •4 Сырье, используемое при производстве глутаминовой кислоты.
- •5 Технологическая схема производства глутаминовой кислоты с описанием процессов, осуществляемых на производственных стадиях.
- •6 Аппаратурное оформление технологической схемы.
- •7 Заключение
- •1. Сырье, используемое при производстве макаронных изделий
- •2. Ассортимент вырабатываемых изделий
- •3. Основные стадии производства макаронных изделий
- •4. Основные технологические схемы производства макаронных изделий
- •5. Основные агрегаты макаронного производства – прессующее устройство и матрицы
- •6. Экологические показатели производства
- •Технология получения патоки
- •15.6.2.10. Производство крахмальной патоки
- •Состав (масс. %) сахаров крахмальной патоки [8]
- •Свойства крахмальной патоки [8]
- •Состав мальтозной патоки (масс. %) [118]
- •Технологическая схема сушки и вяления
4 Сырье, используемое при производстве глутаминовой кислоты.
При промышленном культивировании в качестве источника углерода используют легкоассимилируемые углеводы (сахарозу и глюкозу), содержащиеся в свекловичной мелассе, гидроле, гидролизатах крахмала. Источником азота являются мочевина, реже хлорид и сульфат аммония, кукурузный экстракт, причем последний применяют только на стадиях получений инокулята и посевного материала, в основном по причине большого содержания в нем биотина. Повышенное содержание биотина в мелассе также может ограничить использование ее как основного источника сырья для биосинтеза.
Все продуценты глутаминовой кислоты биотинзависимые, а некоторые из них и тиаминзависимые, однако содержание биотина регламентировано и не должно превышать 2—5 мкг на 1 л среды. Более высокая концентрация этого витамина излишке стимулирует рост клеток продуцента, способствует повышенному образованию, алаиина, молочной, янтарной, аспарагниовой кислот, а выход глутаминовои кислоты при этом значительно снижается.
Ингибирующее влияние биотина удается снизить при включении в состав питательных сред различных добавок в виде некоторых спиртов, ПАВ, антибиотиков (пеннициллинов, тетрациклинов). Добавки в среду ПАВ в количестве 0,01—-0,2% или калиевой соли бензилпенициллина (4—6 тыс. ед. на I л среды) повышают биосинтетическую способность продуцента на 15 - 45% и выход глутаминовой кислоты достигает 50 г/л. Действие антибиотиков, по-видимому, связано с ингибированием синтеза липопротеинового комплекса клеточной оболочки продуцента, что приводит к увеличению проницаемости клеточных мембран для глутаминовой кислоты.
В
зависимости от особенностей используемого
штамма количество
азота в виде мочевины, включаемого в
питательные среды
для осуществления процесса
биосинтеза, составляет
1,0
-
2,0%.
Для  создания
оптимальных условий биосинтеза и
увеличения
количества производимой глутаминовой
кислоты в
единице
объема культуральной жидкости процесс
по завершению накопления основной массы
клеток проводят с подпиткой раствором
мочевины. Содержание ее в культуральной
жидкости не должно
превышать 0,8%, а рН раствора должно быть
в пределах 6,8—7,8.
Недостаток азота в среде снижает выход
глутаминовой кислоты,
способствуй накоплению повышенных
количеств а-кетоглутаровой
кислоты.
создания
оптимальных условий биосинтеза и
увеличения
количества производимой глутаминовой
кислоты в
единице
объема культуральной жидкости процесс
по завершению накопления основной массы
клеток проводят с подпиткой раствором
мочевины. Содержание ее в культуральной
жидкости не должно
превышать 0,8%, а рН раствора должно быть
в пределах 6,8—7,8.
Недостаток азота в среде снижает выход
глутаминовой кислоты,
способствуй накоплению повышенных
количеств а-кетоглутаровой
кислоты.
5 Технологическая схема производства глутаминовой кислоты с описанием процессов, осуществляемых на производственных стадиях.
При биосинтезе глутаминовой кислоты непосредственным метаболическим предшественником служит 2-кетоглутаровая кислота, которая образуется обычно благодаря функционированию в клетках цикла трикарбоновых кислот (ЦТК) или его части. Синтез глутаминовой кислоты происходит в результате ферментативного восстановительного аминирования 2-кетоглутаровой кислоты за счет НАД- или НАДФ-зависимой глутаматдегидрогеназы:
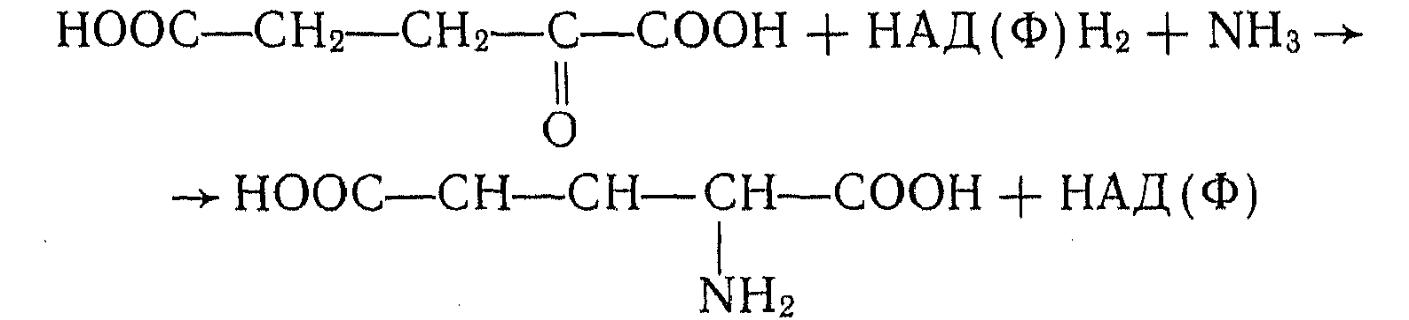
2-Кетоглутаровая кислота способна также вступать в реакцию переаминирования с аминокислотами, осуществляемую тран-саминазами. Коферментом в реакции переаминирования служит пиридоксаль-5-фосфат:
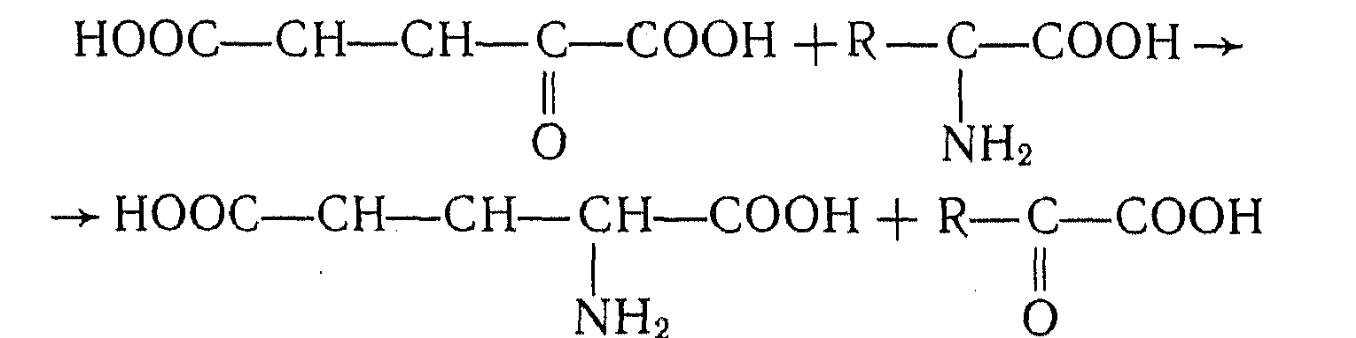
В ЦТК 2-кетоглутаровая кислота образуется из изолимонной кислоты под действием изоцитратдегидрогеназы. Необходимый для синтеза глутаминовой кислоты НАД(Ф)Н постоянно регенерируется при окислении изолимонной кислоты в 2-кетоглутаровую.
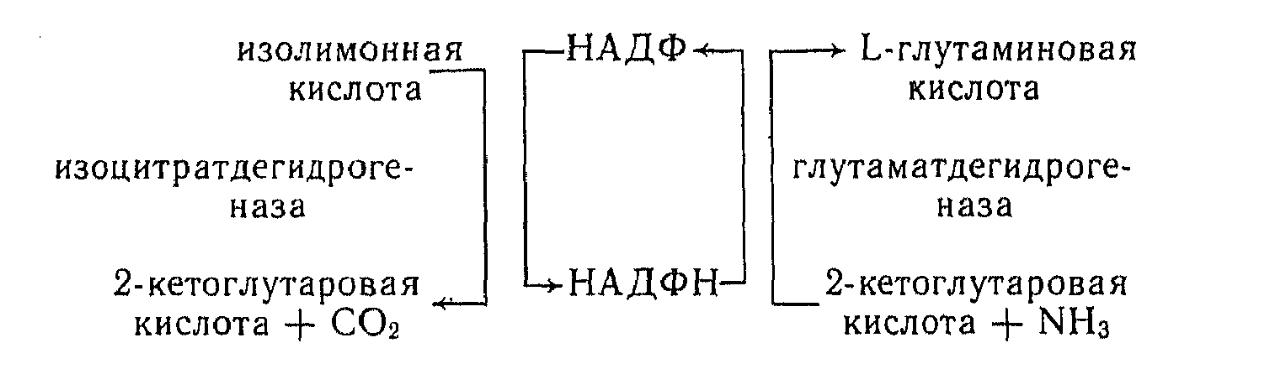
 Анализ
ферментных систем ЦТК у продуцирующего
глутаминовую
кислоту штамма Mlcrococcus
glutamicus
(по
современной классификации Corynebacterium
glutarnicurn
показал,
что у него имеются
все ферменты, кроме 2-кетоглутаратдегидрогеназы,
превращающей
2-кетоглутаровую кислоту в сукцинил-КоА
(рис.
2).
Анализ
ферментных систем ЦТК у продуцирующего
глутаминовую
кислоту штамма Mlcrococcus
glutamicus
(по
современной классификации Corynebacterium
glutarnicurn
показал,
что у него имеются
все ферменты, кроме 2-кетоглутаратдегидрогеназы,
превращающей
2-кетоглутаровую кислоту в сукцинил-КоА
(рис.
2).

Рис. 2
![]()
 Не
менее важный фактор — слабая активность
оксидазной системы,
окисляющей глутаминовую кислоту, что
позволяет сохранить
синтезированный продукт количественно.
Не
менее важный фактор — слабая активность
оксидазной системы,
окисляющей глутаминовую кислоту, что
позволяет сохранить
синтезированный продукт количественно.
Слабокислая реакция, наличие невысоких концентраций биотина и относительно высокая концентрация аммония, а также присутствие ионов Zn2+ способствует превращению глутаминовой кислоты в глутамин по ходу ферментации.
В промышленности глутаминовую кислоту и на ее основе глутамат натрия получают несколькими способами: многостадийным химическим синтезом из акрилонитрила, микробиологическим синтезом по одноступенчатой и двухступенчатой технологии, выделением из свекловичной мелассы или из белковых гидролизатов. Наибольшее распространение поручили способы выделения глутаминовой кислоты из свекловичной мелассы и одноступенчатого микробиологического синтеза. Последний считается самым перспективным.
В промышленном биосинтезе L-глутаминовой кислоты используются те же микроорганизмы, что и в микробиологическом производстве L-лизина, т. е. Coryn. gluiamicum и Brev. ftavum.. Кроме них, промышленными продуцентами могут быть некоторые штаммы бактерии Mictococcus и Microbacterlum.
Для осуществления процесса биосинтеза глутаминовой кислоты с высоким выходом используют мутанты с нарушенной ферментативной системой превращения а-кетоглутаровой кислоты в янтарную. При этом, если культура обладает недостаточностью по биосинтезу аланиндегидрогеназм и лактатдегадрогенезы, то выход глутаминовой кислоты будет увеличиваться за счет отсутствия расхода углеводов среды на биосинтез аланина и молочной кислоты.
Одноступенчатый способ получения.
 Принципиальная
технологическая схема культивирования
продуцента и
биосинтеза
глутаминовой
кислоты практически полностью повторяет
схему микробиологического производства
L-лизина.
Поэтому будут рассмотрены
только некоторые отличия, наблюдаемые
на стадиях культивирования
продуцента и проведения биосинтеза.
Принципиальная
технологическая схема культивирования
продуцента и
биосинтеза
глутаминовой
кислоты практически полностью повторяет
схему микробиологического производства
L-лизина.
Поэтому будут рассмотрены
только некоторые отличия, наблюдаемые
на стадиях культивирования
продуцента и проведения биосинтеза.
Посевной материал на каждой из стадии его получения (от пробирок до посевного аппарата) выращивают в строго асептических условиях по 24 ч. Состав питательных сред незначительно меняется при переходе от одного штамма к другому и практически остается постоянным на каждой из промежуточных стадий получения посевного материала. Только при выращивании продуцента в посевном аппарате в питательную среду вносят до 0,1% стерильного синтетического пеногасителя.
Для промышленных штаммов Coryn. gtutamicum питательные среды при производстве посевного материала, как правило, содержат следующие компоненты (в %):

Питательные среды на стадии биосинтеза содержат те же компоненты и в том же количестве, только вместо кукурузного экстракта и сульфата аммония присутствует до 2% мочевины, содержание мелассы увеличивают до 20%, дополнительно вводят мел до 1% и 0,1% синтетического пеногасителя.
Накопление биомассы до 6—8 г АСВ на 1 л среды производят в аэробных условиях сначала в инокуляторах объемом 2 м3, потом в посевных аппаратах объемом 5 м3. Полученный посевной материал в количестве 5—6% (от объема среды производственных аппаратов) стерильно передают в основные ферментаторы.
Процесс
биосинтеза осуществляют в строго
асептических условиях
в ферментаторах объемом 50 м3
с коэффициентом заполнения
аппарата 0,7 в  течение
48—52 ч и интенсивной аэрации [80—85
мг О2/(л-мин)], что соответствует расходу
1 объема воздуха
на I
объем среды в 1 мин.
Температуру
культивирования на
всех стадиях поддерживают постоянной
на уровне 28—30°С. В
конце процесса биосинтеза готовая
культуральная жидкость содержит
до 45 г/л глутаминовой кислоты. Выход
глутаминовой кислоты
по отношению к потребленным сахарам
составляет 45— 50%.
течение
48—52 ч и интенсивной аэрации [80—85
мг О2/(л-мин)], что соответствует расходу
1 объема воздуха
на I
объем среды в 1 мин.
Температуру
культивирования на
всех стадиях поддерживают постоянной
на уровне 28—30°С. В
конце процесса биосинтеза готовая
культуральная жидкость содержит
до 45 г/л глутаминовой кислоты. Выход
глутаминовой кислоты
по отношению к потребленным сахарам
составляет 45— 50%.
Поскольку производство глутаминовой кислоты направлено на получение высокоочищенных препаратов, последующая технологическая схема предусматривает производство продуктов, подготовленных непосредственно к применению в качестве пищевых добавок и в виде лекарственных форм.
Выделение глутаминовой кислоты из культуральной жидкости и последующая очистка ее в соответствии с требованиями фармакопеи предполагает такую последовательность проведения технологических операций.
Предварительная обработка культуральной жидкости. Осуществляется в результате добавлений к ней определенного количества негашеной извести (или известкового молока) с последующим осаждением избытка ионов кальция фосфорной кислотой. Образующийся при этом осадок способствует лучшему отделению клеток продуцента и других балластных примесей.
Отделение осадка. Проводят центрифугированием или фильтрованием под давлением.

Рис. 3: Рамный фильтр-пресс: 1 – лобовина, 2 – рама, 3 – плита, 4 – брус, 5 – подвижная лобовина, 6 – гидравлическое устройство, 7 – прилив, 8 – кран.
 Осветление
фильтрата. Состоит
в очистке его от пигментных примесей,
окрашивающих нативный раствор в темный
цвет. Для
этого обрабатывают фильтрат активированным
углем или подвергают
его ионообменной сорбции на анионите
ИА-1.
Осветление
фильтрата. Состоит
в очистке его от пигментных примесей,
окрашивающих нативный раствор в темный
цвет. Для
этого обрабатывают фильтрат активированным
углем или подвергают
его ионообменной сорбции на анионите
ИА-1.
Концентрирование осветленного раствора глутаминовой кислоты. Проводят путем его вакуум-выпаривания при температуре 40—60°С, при этом из исходного раствора глутаминовой кислоты отгоняют от 50 до 80% воды.
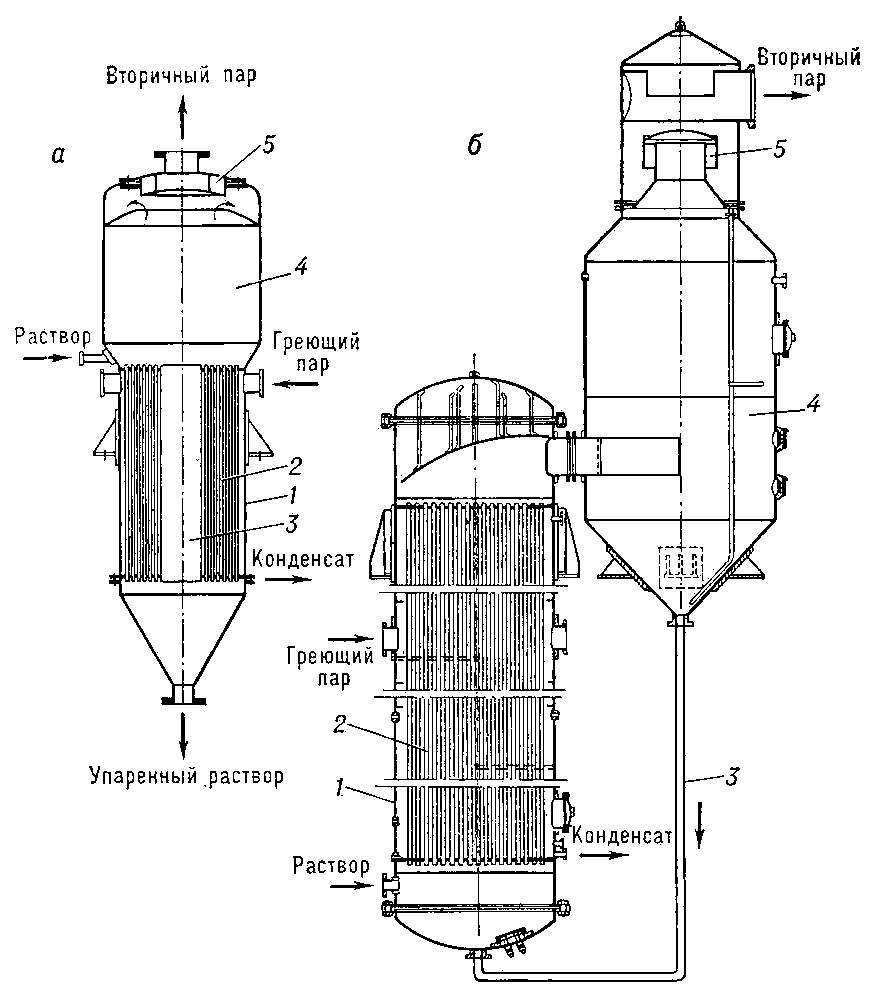
Рис.4 : Выпарные аппараты: а – с центральной циркуляционной трубой, б – с выносной нагревательной камерой, 1 – корпус, 2 – нагревательные трубки, 3 – циркуляционная труба, 4 – сепаратор, 5 – отбойник.
Осаждение
кристаллов глутаминовой кислоты в
изоэлектрической
точке. Эта
стадия осуществляется путем подкисления
полученного
на предыдущем этапе концентрата соляной
кислотой до рН 3,2 (изоэлектрическая
точка глутаминовой кислоты) и
охлаждения
раствора до 4—15°С. Однократное проведение
операции
обеспечивает кристаллизацию 77%
глутаминовой кислоты;
при
повторном ее  проведении
выход возрастает до 87%. Чистота получаемый
кристаллов достигает 88%.
проведении
выход возрастает до 87%. Чистота получаемый
кристаллов достигает 88%.
В результате последующей перекристаллизации чистоту получаемых кристаллов можно увеличить до 99,6%, что удовлетворяет требованиям фармакопеи.
Отделение кристаллов гдутаминовой кислоты от маточника. Это достигается центрифугированием с последующей декантацией и возвратом маточника на стадию вакуум-выпаривания. Полученные кристаллы промывают обессоленной водой и направляют на сушку.
Сушка кристаллов глутаминовой кислоты. Проводится в вакууме или в токе нагретого воздуха при 60—70°С.
Получение глутмата натрия HOOCCH2CH2CH(NH2)COONa*Н2О). Процесс осуществляется обработкой влажных кристаллов перекристаллизованной глутаминовой кислоты гидроксидом натрия. Для этого влажные кристаллы растворяют в определенном количестве воды и нейтрализуют 45—50%-ным раствором едкого натра, рН раствора доводят до 6,8 после чего его фильтруют. Осветленный раствор глутамата натрия упаривают под вакуумом до содержанки сухих веществ около 60% и передают на кристаллизацию. Ее проводят в течение трех суток при постепенном снижении температуры. Кристаллы глутамата натрия отделяют от маточного раствора центрифугированием и сушат в токе горячего воздуха,
В соответствии с требованиями МРТУ 18/210—68 глутамат натрия пищевой должен иметь следующий состав (в %):
Основное вещество, не менее … 94 Влага, ее более …………………1
Хлорид натрия, не более ………… 5 Общей азот, не менее……….. 7,02
 Двухступенчатый
способ
получения.
Двухступенчатый
способ
получения.
Его возможно осуществить из а-кетоглутаровой кислоты с помощью ферментов трансамилазы или глутаматдегидрогеназы в результате следующих превращений:

В каждом из этих процессов а-кетоглутаровая кислота играет роль предшественника.
Для осуществления любого из этих превращений необходимы источники а-кетоглутаровой кислоты и соответствующей ферментной системы. Первую из этих задач решают с помощью подбора микроорганизмов, способных продуцировать значительное количество а-кетоглутаровой кислоты из доступных источников сырья. Продуцентами а-кетоглутаровой кислоты могут быть Pseudomonas и Escherickia, а при культивировании продуцента KluyvBrd citrophila а-кетоглутаровай кислота была получена с 57%-ным выходом. Дрожжи рода Candida при выращивании на n-парвфинах продуцируют а-кетоглутаровую кислоту совместно с пировиноградной в соотношении 6:1. Экономический коэффициент процесса биосинтеза достигает 90% от количества потребленных углеводородов.
В роли продуцента фермента трансамидазы могут выступать различные микроорганизмы например Е. coli. Донором аминогрупп может быть аспарагиновая кислота или аланин.
Восстановительное эминированме возможно осуществить с помощью Pseudomonas (прм использовании Ps. ovalis выход L-глутаминовой кислоты составляет 60%) или Aeromonas, причем некоторые штаммы этих микроорганизмов в качестве субстрата могут использовать D, L-а- оксиглутаровую кислоту, производимую химическим синтезом.
