
Комплексные соединения
3.
Лигандами являются либо нейтральные молекулы (NH3, H2O, CO, CH2 = CH2, C2H5NH2 и др.), либо отрицательно заряженные ионы – анионы (F-, Cl-, J-, NO2-, CN-, NCS-, O2-, OH-, S2O32-, CO32-, SO42- и др.). Общее у лиганд, то что они обладают одной или несколькими неподеленными электронными парами, т.е. при образовании связи с комплексообразователем по донорно-акцепторному механизму являются донорами электронов.
Если в состав лиганда входит один донорный атом, то такой лиганд называют моно-дентатным, если больше – полидентатным (би-, три-, тетра-, пентадентатными и т.д.).
К монодентатным лигандам относят анионы одноосновных кислот (ацидолиганды) – F-, Cl-, Br-, I-, CN-, SCN-, NO2- и др., гидроксильный ион ОН-, нейтральные молекулы, имеющие только один донорный атом – аммиак NH3 и органические амины (алифатиче-ские – RNH2, R2NH, R3N, гетероциклические – пиридин С5Н5N и т.п.), Н2О, Н2S и органи-ческие сульфиды, РН3, P(C6H5)3 и др. Эти лиганды образуют обычно только одну коорди-национную связь (за исключением случаев образования мостиковых связей между двумя атомами металла).
Бидентатные лиганды имеют в своѐм составе два донорных атома, способных к об-разованию координационной связи. Примерами бидентатных лигандов являются:
NH2 – CH2 – CH2 – NH2 - этилендиамин En (два донорных атомов азота).
NH2 – CH2 – COOH - аминоуксусная кислота (глицин) GlyH (один донорный атом азота аминогруппы и один донорный атом кислорода карбоксильной группы).
Ряд нейтральных молекул и многовалентных кислотных остатков (например: {CO32-}, {C2O42-}, {SO42-} и др.) связываются с центральным атомом посредством двух атомов (т.е. занимают около него два места и имеют, соответственно, координационную емкость, равную двум).
Для тридентатных лигандов характерно наличие в их составе трех донорных атомов:
NH2 – CH2 – CH2 – NH – CH2 – CH2 – NH2 - диэтилентриамин dien (три атома азота)
Среди множества полидентатных лигандов большое значение для аналитической химии имеет гексадентатный лиганд – этилендиаминтетрауксусная кислота (ЭДТУК, ЭДТА, EDTA), который способен координироваться через два атома азота и четыре атома кислорода каждой из карбоксильных групп:
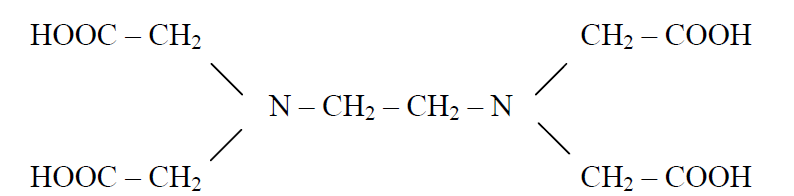
Этот лиганд, дигидрат динатриевой соли которого известен под названием торговой марки «Трилон Б», образует очень прочные комплексы с катионами многих металлов, что позволяет его использовать для количественного определения металлов методом комплек-сонометрического титрования.
Однако, полидентатные лиганды не всегда реализуют свою максимальную дентатность при образовании комплексного соединения и при этом образуют меньшее число связей, чем это возможно. Например, потенциально бидентатная аминоуксусная ки-слота (глицин, GlyH) в комплексе [CoEn2(GlyH)Cl]Cl2 образует только одну координаци-онную связь с кобальтом через атом азота аминогруппы, проявляя себя как монодентат-ный лиганд. Также ион SO42- обычно монодентатен, но иногда бывает и би-дентатным.
а) Формулы всех комплексных соединений, в состав которых могут входить следующие ионы: NH4+, [BeF4]2–, [Fe(CN)6]3–, [Cr(H2O)5CN]2+, [Cu(NH3)4]2+:
(NH4)2[BeF4]; (NH4)3[Fe(CN)6]; [Cr(H2O)5CN][BeF4]; [Cr(H2O)5CN]3[Fe(CN)6]2;
[Cu(NH3)4][BeF4]; [Cu(NH3)4]3[Fe(CN)6]2.
[Co(H2O)4(CO3)]2SO4 сульфат дикарбонаттетрааквакобальта (III).
Комплексообразователь Со3+, координационное число равно 5. Лиганды H2O являются монодентатными, CO32- - бидентантным.
Уравнение первичной диссоциации комплексной соли:
[Co(H2O)4(CO3)]2SO4 → [Co(H2O)4(CO3)]2+ + SO42-
Уравнения вторичной диссоциации комплексного иона:
[Co(H2O)4(CO3)]2+
![]() [Co(H2O)4]23+
+ CO32-
[Co(H2O)4]23+
+ CO32-
[Co(H2O)4]3+ [Co(H2O)3]3+ + H2O
[Co(H2O)3]3+ [Co(H2O)2]3+ + H2O
[Co(H2O)2]3+ [Co(H2O)]3+ + H2O
[Co(H2O)]3+ Co3+ + H2O
Суммарное уравнение вторичной диссоциации комплексного иона:
[Co(H2O)4(CO3)] + Со3++ 4H2O + CO32-
Выражеие общей константы нестойкости комплексного иона:
С(Со3+)∙ С4(H2O)∙С(CO32-)
К н
=
н
=
С([Co(H2O)4CO3]+)
[Pt(NH3)2Cl2] – дихлордиамминплатина (II).
Комплексообразователь Pt2+, координационное число равно 4. Лиганды NH3, BСl- - монодентатные.
Уравнения вторичной диссоциации комплексного иона:
[Pt(NH3)2Cl2] [Pt(NH3)2Cl]+ + Сl -
[Pt(NH3)2Cl]+ [Pt(NH3)2]2+ + Сl -
[Pt(NH3)2]2+ [Pt(NH3)]2+ + Сl -
[Pt(NH3)]2+ Pt2+ + NH3
Суммарное уравнение вторичной диссоциации комплексного иона:
[Pt(NH3)2Cl2] Pt2++4NH3 + 2Сl -
-
Выражеие общей константы нестойкости комплексного иона:
С(Pt2+)∙С4(NH3)∙С2(Cl-)
Кн =
С([Pt(NH3)4Cl2])
Na[Cr(NH3)2(SO4)2] – дисульфатодиамминохромат (III) натрия. Комплексообразователь – Сr3+, координационное число равно 4. Лиганд NH3 – монодентатный, SO42- - бидентатный.
Уравнение первичной диссоциации:
Na[Cr(NH3)2(SO4)2] → Na+ + [Cr(NH3)2(SO4)2]-
Уравнения вторичной диссоциации комплексной соли:
[Cr(NH3)2(SO4)2]- [Cr(NH3)2(SO4)]++ SO42-
[Cr(NH3)2(SO4)]+ [Cr(NH3)2]3+ + SO42-
[Cr(NH3)2]3+ [Cr(NH3)]3++ NH3
[Cr(NH3)]3+ Cr3++ NH3
Суммарное уравнение вторичной диссоциации комплексного иона:
[Cr(NH3)2(SO4)2]- Cr3+ +2NH3 + 2 SO42-
Выражеие общей константы нестойкости комплексного иона:
С(Cr3+)∙С2(NH3)∙С(SO42-)
Кн =
С([Cr(NH3)2(SO4)2]-)
б)
2Na[Ag(CN)2] + 4Na2S2O3 ↔ 2Na3[Ag(S2O3)2] + 4NaCN
2 [Ag(CN)2]- + 4S2O32- ↔ 2[Ag(S2O3)2]3- + 4CN-
Равновесие реакции будет смещено в сторону образования более устойчивого комплексного иона. Устойчивость комплексных ионов характеризуется константой нестойкости, чем меньше констант нестойкости, тем более устойчивый комплексный ион.
Суммарное уравнение вторичной диссоциации иона [Ag(СN)2]- :
[Ag(CN)2]- Ag+ + 2СN-
Выражение общей константы нестойкости:
[Ag+] [CN-]2
Kнест = ---------------------- = 8 · 10–22
[Ag(CN)2]-
Суммарное уравнение вторичной диссоциации иона [Ag(S2O3)2]3- :
[Ag(S2O3)2]3- Ag+ + 2 S2O32-
Выражение общей константы нестойкости:
[Ag+] [S2O32-]2
Kнест = ---------------------- = 2,5 · 10–14
[Ag(S2O3)2]3-
Так как константа нестойкости иона [Ag(CN)2]- значительно меньше, чем константа нестойкости иона [Ag(S2O3)2]3-, то ион [Ag(CN)2]- будет более устойчивым.
Следовательно, равновесие реакции 2Na[Ag(CN)2] + 4Na2S2O3 ↔ 2Na3[Ag(S2O3)2] + 4NaCN
будет смещено влево.
Литература
Шиманович И. Е., Красицкий В. А., Хвалюк В. Н. и др. «Общая и неорганическая химия. Учебное руководство». Мн.: РИВШ, 2010.
Глинка Н. Л. Общая химия. Л.: Химия, 1983 –1989.
Ахметов Н. С. Общая и неорганическая химия. М.: Высшая школа, 1981 – 1988.
Шиманович И. Е., Павлович М. Л., Тикавый В. Ф., Малашко П. М. Общая химия в формулах, определениях, схемах. Мн.: Университетское, 1987, 1996.
Глинка Н. Л. Задачи и упражнения по общей химии. Л.: Химия, 1980 – 1989, 2002.
