
Металлы групп «а» (главных подгрупп)
3. Какие степени окисления характерны для атомов элементов IIА-группы? Опишите физические и химические свойства соответствующих простых веществ. Перечислите важнейшие природные соединения магния и кальция и приведите уравнения реакций получения указанных металлов. Где они находят применение? Какова биологическая роль соединений магния и кальция?
Be, Mg, Ca, Sr, Ba, Ra – элементы II А группы, из них Ca, Sr, Ba, Ra – щелочноземельные металлы, т.к. их гидроксиды обладают щелочными свойствами.
Электронная структура внешнего уровня имеет вид ns2. Наиболее характерная степень окисления – +2. У атомов s-элементов второй группы более устойчивая электронная
конфигурация, состоящая из заполненного двумя электронами s-подуровня и незаполненного 2р-подуровня. В подгруппе по всем показателям резко выделяется
бериллий. Полными аналогами являются Ca, Sr, Ba, Ra. Магний занимает промежуточное положение.
Физические свойства
Щелочноземельные металлы – серебристо-белые вещества, за исключением бериллия, цвет которого – светло-серый. Температуры плавления и кипения уменьшаются по группе, но монотонность уменьшения нарушается у Mg. Дело в том, что Be
и Mg кристаллизуются в гексагональной кристаллической решетке с координационным числом КЧ = 12, а у подгруппы Са – кубические гранецентрированные ячейки с КЧ = 12. От Be к Mg при одном и том же типе решетки Тпл уменьшается. Затем изменяется тип решетки, и Тпл снова уменьшается. Кроме радия, щелочноземельные металлы легкие. Ход
изменения плотности должен быть монотонным, но из этого ряда выпадают Mg и Са. Дело в том, что по группе увеличиваются объемы и массы атомов, и, следовательно, плотность должна увеличиваться. При переходе от Be к Mg и от Mg к Са радиус
изменяется очень резко, а масса – мало, поэтому и получается скачок плотности.
Металлы хорошо проводят тепло и электрический ток. Слабее всех теплопроводен и электропроводен бериллий.
Химические свойства
Щелочноземельные металлы – это активные металлы. Сверху вниз по группе их активность увеличивается, так как уменьшаются первый и второй потенциалы ионизации. На воздухе Be и Mg устойчивы, потому что покрываются оксидной пленкой. Металлы
подгруппы Са на воздухе окисляются. На их поверхности образуются пленки различного состава: ЭО, ЭO2, Э3N2. По отношению к галогенам наименее активен Be, который реагирует без нагревания только со фтором. Все остальные металлы реагируют с галогенами при обычных условиях. Взаимодействуют щелочноземельные металлы с серой и кислородом, но Be и Mg при нагревании. С азотом и углеродом все металлы взаимодействуют при нагревании:
2Э + O2 → 2ЭО;
6Э + 2N2 → 2Э3N2;
Э + X2 → ЭX2, (Х – F, Сl, Вг, I);
Э + S → ЭS;
2Э + H2 → 2ЭН.
С водой Be и Мg реагируют при нагревании, а элементы подгруппы Са реагируют с водой уже при обычной температуре с образованием гидроксида и выделением водорода:
Mg + 2H2О → Mg(OH)2 + H2, реагирует слабо;
Са + 2H2О → Ca(OH)2 + H2, реагирует умеренно;
Sr + 2H2О → Sr(OH)2 + H2, реагирует энергично;
Ва + 2Н2О → Ва(ОН)2 + H2, реагирует очень энергично
Взаимодействуют с кислотами. Это энергичные восстановители, и при взаимодействии с H2SO4 и НNO3 получаются
самые низкие степени окисления серы и азота:
4Mg + 10НNО3 (оч. разб.) → 4Mg(NО3)2 + NH4NО3 + 3H2О;
4Са + 5H2SO4 (конц.) → 4CaSO4 + H2S + 4H2O.
Бериллий обладает амфотерными свойствами, растворяется и в кислотах и в щелочах:

Be + 2H+ + 4H2O = [Be(H2O)4]2+ + H2↑

Be + 2OH- + 2H2O = [Be(OH)4]2- + H2↑
Be пассивируется концентрированной азотной и серной кислотами, но при нагревании реагируют с этими кислотами:

Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже.
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C:
![]()
Главными видами нахождения магнезиального сырья являются:
морская вода — (Mg 0,12-0,13 %),
карналлит — MgCl2 • KCl • 6H2O (Mg 8,7 %),
бишофит — MgCl2 • 6H2O (Mg 11,9 %),
кизерит — MgSO4 • H2O (Mg 17,6 %),
эпсомит — MgSO4 • 7H2O (Mg 16,3 %),
каинит — KCl • MgSO4 • 3H2O (Mg 9,8 %),
магнезит — MgCO3 (Mg 28,7 %),
доломит — CaCO3·MgCO3 (Mg 13,1 %),
брусит — Mg(OH)2 (Mg 41,6 %).
Магний получают из оксидов восстановлением C и Si

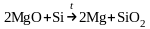
Mg + H2≠
Применение
Металлический магний применяют в металлургии в качестве раскислителя и десульфирующего агента, так как он восстанавливает оксиды и сульфиды с образованием трудно растворимых в расплавленных металлах соединений. Магний широко применяют в машиностроении и авиации в сплавах с другими металлами. Он присутствует в дюралюминии, электроне, магналии, гидроналии.
Металлический кальций используют в качестве восстановителя при металлотермическом способе получения металлов, а также для производства различных сплавов с бериллием, магнием, алюминием, медью, свинцом, висмутом и др.
Кальций вводят в сплавы железа для удаления углерода и серы. Металлический кальций используют для получения гидрида кальция и карбида кальция.
Биологическая роль
Магний и кальций относятся к макроэлементам. Комплексные соединения
магния и кальция играют важную роль в жизнедеятельности растений и живых организмов. Магний входит в состав многих ферментативных систем, а кальций
является главным компонентом костной ткани. Входя в состав различных
ферментативных систем, ион магния является их незаменимым компонентом. Катион Mg2+ является комплексообразователем в хлорофилле – пигменте зеленых растений, выполняющим важную роль в процессе фотосинтеза.
а) Уравнение реакции взаимодействия бериллия с гидроксидом калия в водном растворе:
Уравнение реакции взаимодействия оксида кальция с углеродом (избыток):
t
СаО + 3С = СаС2 + СО
Уравнение реакции взаимодействия висмутата натрия с хлороводородной кислотой (конц. раствор):
![]()
б) Pb → Pb(NO3)2 → PbO → K2[Pb(OH)4] → PbО2 → PbСl2.
Уравнения реакций, соответствующих превращениям:
1) Pb + 4HNO3(конц.) → Pb(NO3)2 + 2NO2 + 2H2O
t
2) 2Pb(NO3)2 = 2PbO + 4NO2 + O2
3) PbO + 2KOH + H2O = K2[Pb(OH)4]
4) K2[Pb(OH)4] + 4CH3COOH = 2CH3COOK + Pb(CH3COO)2 + 4H2O
Pb(CH3COO)2 + Cl2 + 4KOH = PbO2 + 2KCl + 2 CH3COOK + 2H2O
t
5) PbO2 + 4HCl(конц.) = PbCl2 + Cl2 + 2H2O
Т е м а ХVI
