
Контрольная работа № 2
3.
Свойства галогеноводородов
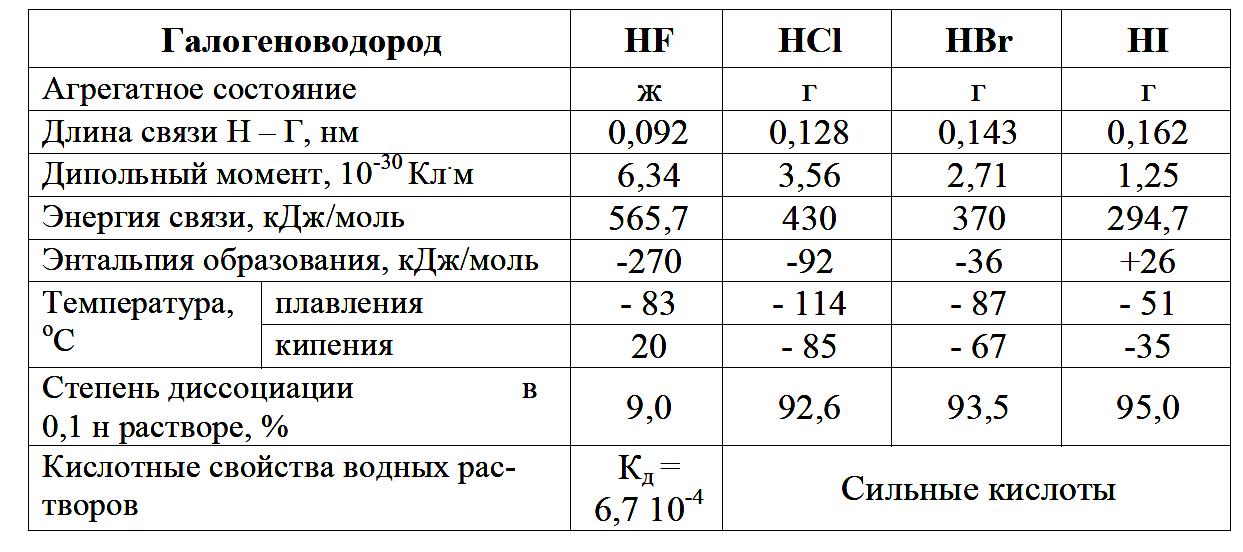
Связь в молекулах полярная, причем в ряду HF – HCl – HBr – HI длина связи Н – Г увеличивается, так как радиусы атомов галогенов увеличиваются, а прочность и полярность ее ослабевают. Поэтому в ряду
HF – HCl – HBr – HI отщепление иона водорода происходит легче, и сила кислот увеличивается.
Так как радиусы атомов галогенов в группе увеличиваются, а сродство к электрону становится меньше, то восстановительная активность в этом ряду возрастают.
HF и HCl с концентрированной H2SO4 не взаимодействуют, HBr восстанавливает H2SO4 до SO2:
2HBr + H2SO4 = Br2 + SO2 + 2H2O,
а HI восстанавливает H2SO4 до H2S:
8HI + H2SO4 = 4I2 + H2S + 4H2O
а) Взаимодействие иода с хлором в водном растворе:
I2 + Cl2 = 2ICl
Э лектронный
баланс:
лектронный
баланс:
I20 - 2e- = 2I+1 1 восстановитель
2
Cl20 + 2е- = Cl-1 1 окислитель
Взаимодействие дихромата натрия с иодидом калия в присутствии серной кислоты:
6 KI + K2Cr2O7 + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O
Э лектронный баланс:
2I-1 - 2e- = I20 3 восстановитель
6
2 Cr+6 + 6е- = 2Cr+3 1 окислитель
Взаимодействие гидрида кальция с соляной кислотой:
СаН2 + 2HCl = CaCl2 + 2H2↑
Э лектронный баланс:
2H-1 - 2e- = H20 1 восстановитель
2
H+1 + 1е- = H0 2 окислитель
б) LiCl → LiClO3 → Cl2 → Ca(ClO)2 → HCl → PCl3 .
электролиз
1) 6LiCl + 3H2O = LiClO3 + 5NaCl + 3H2
Э лектронный баланс:
Cl0 - 5e- = Cl+5 2 восстановитель
10
2H+1 + 2е- = H20 5 окислитель
2) 2LiClO3 = 2LiCl + 3O2
Э лектронный баланс:
2O-2 - 4e- = O20 3 восстановитель
12
Cl+5 - 6e- = Cl-1 2 окислитель
t
LiCl + H2SO4(конц.) = HCl + NaHSO4
2KMnO4 + 16HCl(конц.) = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Э лектронный баланс:
2Cl-1 - 2e- = Cl20 5 восстановитель
10
Mn+7 + 5е- = Mn+2 2 окислитель
3) Cl2 + Ca(OH)2 = Ca(ClO)2 + CaCl2
Э лектронный баланс:
2Cl0 - 2e- = 2Cl+1 1 восстановитель
2
2Cl0 + 2е- = 2Cl-1 1 окислитель
3) 4HCl(конц.) + MnО2 = MnCl2 + Cl2+ 2H2O
Э лектронный баланс:
2Cl-1 - 2e- = Cl20 1 восстановитель
2
Mn+4 + 2е- = Mn+2 1 окислитель
2Р + 3Cl2 = 2PCl3
Э лектронный баланс:
P0 - 3e- = P+3 2 восстановитель
6
Cl20 - 2e- = 2Cl-1 1 окислитель
Т е м а XI
Кислород, сера и ее аналоги
3. Как и почему изменяются окислительно-восстановительные свойства простых веществ в ряду кислород – полоний? Какие аллотропные модификации образуют кислород и сера? Охарактеризуйте химические свойства разбавленной серной кислоты.
Ответ:
К главной подгруппе VI группы периодической системы относятся кислород, сера, селен, теллур и полоний. Валентными у них являются электроны ns2 np4:

Так как атомы элементов VI-А группы содержат на внешнем слое шесть электронов, то они стремятся к заполнению электронами внешнего энергетического уровня и для них характерно образование анионов Э2-. К образованию катионов атомы рассматриваемых элементов (кроме полония) не склонны. Кислород и сера – типичные неметаллы, причем кислород относится к самым электроотрицательным элементам (на втором месте после
фтора). Полоний – металл серебристо-белого цвета, напоминающий по физическим свойствам свинец, а по электрохимическим свойствам – благородные металлы. Селен и теллур занимают промежуточное положение между металлами и неметаллами, они являются полупроводниками. По химическим свойствам они стоят ближе к неметаллам.
Вследствие увеличения радиусов атомов и уменьшения величины электроотрицательности в ряду O→S→Se→Те→Ро неметаллические и окислительные свойства элементов ослабляются, и значительно усиливаются восстановительные свойства.
В природе кислород существует в виде трех изотопов 16О, 17О, 18О и в виде двух аллотропных модификаций кислорода О2 и озона О3.
Кислород O2 - бесцветный газ, т. пл. -219° С, т. кип. -193° С. Жидкий кислород имеет голубую окраску. Oзон О3 - синий газ с резким запахом, т. кип. -110° С, т. пл. -193° С. Жидкий озон имеет темно-синюю окраску, твердый - черную. Ядовит; взрывчат (особенно в жидком и твердом состоянии).
Сера существует в виде нескольких модификаций: при обычных условиях в ромбической форме она называется α-серой (d = 2,06); при температуре выше 96 °С − в
моноклинной, β-сера (d = 1,96). При температуре 119,3 °С сера плавится, при температуре 744,6 °С − закипает. Сера отличается способностью образовывать цепи из ряда атомов. Наиболее стабильна кольцевая молекула S8. В парах серы с повышением температуры число атомов в молекуле уменьшается (S8→S6→S4→S2). Так, при 900 °С пары
серы состоят из молекул S2, а при 1500 °С молекулы S2 распадаются на атомы.
Если расплавленную серу быстро вылить в холодную воду, образуется так называемая пластическая сера (каучукоподобная масса), при быстром охлаждении паров серы − мелкораздробленная сера (серого цвета).
Химические свойства разбавленной серной кислоты.
H2SO4 - сильная двухосновная кислота. В разбавленных растворах полностью диссоциирована:
H2SO4 → H+ + HSO4-
Разбавленная
серная кислота взаимодействует с
металлами. Окислителем в этих процессах
является катион водорода, восстановители
– атомы металла. Все металлы, имеющие
стандартный электродный потенциал ниже
нуля, j <
0 В (т.е., стоящие в ряду активности
металлов до водорода), взаимодействуют
с разбавленной серной кислотой. При
этом образуется соль металла в его
низшей с.о. и идет восстановление
водорода. Эта реакция идет до конца,
если в результате процесса образуется
растворимая в воде соль. Например:
<
0 В (т.е., стоящие в ряду активности
металлов до водорода), взаимодействуют
с разбавленной серной кислотой. При
этом образуется соль металла в его
низшей с.о. и идет восстановление
водорода. Эта реакция идет до конца,
если в результате процесса образуется
растворимая в воде соль. Например:
Fe + H2SO4(разб.) = FeSO4 + H2;
Pb + H2SO4(разб.) ¹ PbSO4¯ + H2.
Последний процесс термодинамически возможен, т.к. в ряду напряжений Pb находится до водорода (j0 = −0,127 В), однако на поверхности металла образуется пленка из малорастворимого вещества PbSO4, которая изолирует поверхность металла от дальнейшего взаимодействия, процесс практически прекращается. Разбавленная серная кислота проявляет все свойства, характерные для кислот. Взаимодействует с основными и амфотерными оксидами, основаниями.
С основными оксидами:
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
С основаниями:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H+ + OH- = H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
2H+ + Cu(OH)2 = Cu2+ + 2H2O
Вступает в обменные реакции с солями:
BaCl2 + H2SO4 = BaSO4 + 2HCl
Ba2+ + SO42- = BaSO4
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Соли серной кислоты – сульфаты и гидросульфаты – в основном хорошо растворимы в воде. Из водных растворов они выделяются в виде кристаллогидратов.
а) S → Na2S2 → S → Na2S2O3 → Na2SO4 → NaHSO4
1) Na2S + S = Na2S2
2) Na2S2 = Na2S + S
t
3) S + Na2SO3 = Na2S2O3
4) Na2S2O3 + 4 С12 (избыток) + 5 Н2О = Na2SО4 + Н2SО4 + 8 НС1
Те м а XII
АЗОТ
3. Изобразите графическую формулу и рассмотрите строение молекулы азотной кислоты (тип и полярность связей, тип гибридизации орбиталей атома N, геометрическую форму и полярность молекулы). Охарактеризуйте физические и химические свойства азотной кислоты. В чем заключаются ее химические особенности? Как влияет концентрация азотной кислоты на ее окислительные свойства?
С точки зрения теории гибридизации атомных орбиталей атом азота в молекуле азотной кислоты находится в состоянии sp2-гибридизации, три гибридные орбитали участвуют в образовании трех связей с атомами кислорода, а негибридная р-орбиталь азота образует с р-орбиталями кислорода общую электронную плотность, связь является трехцентровой и четырехэлектронной, порядок связи N – O равен 1,5. Таким образом в целом, азот образует 4 связи. В HNO3 валентность азота равна 4, степень окисления +5, оба атома кислорода связаны с атом азота равноценно. В газовой фазе молекула азотной кислоты имеет плоское строение.

Aзотная
кислота – полярная молекула, диполь.
Наибольшая полярность связи на участке
H![]() O,
по этой связи и происходит электролитическая
диссоциация.
O,
по этой связи и происходит электролитическая
диссоциация.
Физические свойства. Азотная кислота - бесцветная летучая жидкость с едким запахом. Высококонцентрированная HNO3 имеет бурую окраску, вследствие происходящего на свету разложения:
4 НNO3 = 4 NO2 + 2 H2O + О2
Химические свойства.
НNO3 – сильная кислота, соли азотной кислоты гидролизу не подвергаются.
Уравнение диссоциации:
НNO3 → Н+ + NO3-
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
![]()
![]()
б) с основаниями:
![]()
в) вытесняет слабые кислоты из их солей:
![]()
Концентрированная HNO3 – сильный окислитель. Из металлов к ней устойчивы Au, Pt, Rh, Ir, Ti, Ta; металлы Al, Cr, Fe, Ni, Co она “пассивирует” за счет образования малорастворимых оксидных пленок. При окислении веществ азотной кислотой получаются ее соли – нитраты и продукты восстановления азота (NH3, N2, NО, N2O, NO2). Состав которых зависит от природы восстановителя, температуры и концентрации кислоты. Запись окислительно-восстановительных реакций с участием HNO3 условна, указывают только один продукт восстановления, который образуется в большом количестве. При любых концентрациях азотная кислота - сильный окислитель. Окислительные свойства азотной кислоты обусловливаются неустойчивостью молекул и присутствием в них азота в высшей степени окисления.
Степень ее восстановления зависит как от концентрации кислоты, так и от активности восстановителя. Чем более разбавлена кислота, тем сильнее она восстанавливается:
Сu + 4НNО3(конц.) = Сu(NО3)2 + 2NО2 + 2Н2О
3Сu + 8НNО3(разб.) = 3Сu(NО3)2 + 2NO + 4Н2О
4Мg + 10НNО3(разб.) = 4Мg(NО3)2 + N2О + 5Н2О
Если кислота очень разбавлена, то главным продуктом восстановления является аммиак, образующий с избытком кислоты аммонийную соль NН4NО3:
4Zn + 10НNО3 = 4Zn(NО3)2 + NH4NО3 + 3Н2О
Концентрированная азотная кислота при нагревании легко окисляет серу, фосфор, уголь и органические соединения:
S + 2НNО3 = 2NО + Н2SО4
3 Р + 5 НNO3 (конц.) + 2 Н2О → 3 Н3РО4 + 5 NO
3 С + 4 НNO3 (конц.) → 3 СО2 + 4 NO + 2 Н2О
Смесь концентрированных HNO3 и HCl (1:3) называется царской водкой, она растворяет золото и платиновые металлы (Pd, Pt, Os, Ru):
Au + HNO3 + 3HCl ® AuCl3 + NO + 2H2O.
а) Уравнения реакций термического разложения нитратов аммония, цезия, свинца(II) и серебра; карбоната, нитрита и дихромата аммония:
tо
NH4NO3 = N2O + 2H2O
tо
2CsNO3 = 2CsNO2 + O2
tо
2Pb(NO2) = PbO + NO2↑+ O2↑
tо
2AgNO3 = 2Ag + 2NO2+ O2
tо
(NH4)2CO3 = NH3↑ + H2O + CO2↑
tо
NH4NO2 = N2 + 2H2O
tо
(NH4)2Cr2O7 = Cr2O3 + N2↑ + 4H2O
б) Уравнения реакций, соответствующих превращениям:
HNO3 → NH3 → (NH4)2Cr2O7 → N2 → N2O → N2O3.
1) 4Мg + 9НNО3(разб.) =4Mg(NО3)2 + NH3 + 3Н2О
2) CrO3 + 2 NH3 + H2O = (NH4)2Cr2O7
tо
3) (NH4)2Cr2O7 = Cr2O3 + N2↑ + 4H2O
4)
t, p, кат.
N2 + H2 = 2NH3
NH3 + НNO3 = NH4NO3
tо
NH4NO3 = N2O + 2H2O
5) 2N2O = 2N2 + O2
≈ 30000С
N2+O2 = 2NO
tо
2NO + О2 = 2NО2
tо
NO+NO2 = N2O3
Т е м а XIII
ФОСФОР
3.
Основные свойства водородных соединений элементов VA группы обусловлены наличием неподеленной электронной пары у центрального атома. Атом может предоставить эту электронную пару для образования связи, например, с ионом водорода по донорно-акцепторному механизму.
Донорные свойства РН3 также значительно ослаблены по сравнению с NH3(электронная пара находится на негибридной 3s-орбитали). Поэтому, в отличие от аммиака, растворение фосфина в воде не сопровождается образованием соединений, а донорные свойства РН3 проявляет только при взаимодействии с очень сильными кислотами:
PH3 + HI = PH4I (иодид фосфония).
Водой соли фосфония разлагаются.
Арсин - AsH3, стибин - SbH3 и висмутин - BiH3 - в обычных условиях это газообразные вещества с резким запахом, практически нерастворимые в воде. Их молекулы имеют такое же строение, как и молекула РН3:
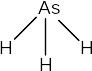
Валентные углы Н-Э-Н близки к 900, что позволяет сделать вывод об отсутствии гибридизации атомных орбиталей у центрального атома. Поэтому у молекул почти отсутствуют донорные свойства, а, следовательно, и основные свойства. AsH3, SbH3 и BiH3 не взаимодействуют с водой и даже с сильными кислотами. Напротив, у стибина проявляются слабые кислотные свойства и, при пропускании через раствор нитрата серебра, он образует чёрный осадок малоустойчивого стибида серебра:
SbH3 + 3AgNO3 = Ag3Sb¯ + 3HNO3.
Арсин и стибин проявляют сильные восстановительные свойства. Они горят на воздухе:
2ЭН3 + 3О2 = Э2О3 + 3Н2О
Арсин - AsH3, стибин - SbH3 и висмутин - BiH3 - в обычных условиях это газообразные вещества с резким запахом, практически нерастворимые в воде. Их молекулы имеют такое же строение, как и молекула РН3:
Валентные углы Н-Э-Н близки к 900, что позволяет сделать вывод об отсутствии гибридизации атомных орбиталей у центрального атома. Поэтому у молекул почти отсутствуют донорные свойства, а, следовательно, и основные свойства. AsH3, SbH3 и BiH3 не взаимодействуют с водой и даже с сильными кислотами. Напротив, у стибина проявляются слабые кислотные свойства и, при пропускании через раствор нитрата серебра, он образует чёрный осадок малоустойчивого стибида серебра:
SbH3 + 3AgNO3 Þ Ag3Sb¯ + 3HNO3.
В ряду PH3 ― AsH3 ― SbH3 ― BiH3 происходит усиление восстановительных свойств соединений, что связано с увеличением атомных радиусов Вв ряду N – P – As – Sb – Bi. Сувеличением размеров атомов уменьшается энергия ионизации, связь электронов наружного слоя с ядром ослабевает, все это приводит к восстановительных свойств водородных соединений. Все водородные соединения являются сильными восстановителями.
Фосфин является сильным восстановителем, он способен выделять металлы из растворов их солей:
PH3 + 8AgNO3 + 4H2O = Ag + H3PO4 + 8HNO3 .
При температуре около 1500С фосфин самовоспламеняется на воздухе:
PH3 + 2O2 = HPO3 + H2O.
Арсин и стибин также проявляют сильные восстановительные свойства. Они горят на воздухе:
2ЭН3 + 3О2 = Э2О3 + 3Н2О
и легко окисляются галогенами, серой, перманганатом калия, нитратом серебра(I):
2AsH3 + 12AgNO3 +3H2O = 12Ag + As2O3 + 12HNO3.
Фосфин можно получитьпри обработке фосфидов водой -
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
ЭН3 можно получить действием разбавленных кислот на арсениды, стибиды и висмутиды:
Mg3Э2 + 6HCl = 2ЭH3+ 3MgCl2.
Арсин и стибин наиболее просто получаются действием цинка на подкисленные растворы соединений мышьяка и сурьмы:
As2O3 + 6Zn + 6H2SO4 = 2AsH3+ 6ZnSO4 + 3H2O.
а) Уравнение реакции взаимодействия белого фосфора с сульфатом меди(II) в водном растворе:
Р4 + 10CuSO4 + 16Н2О → 10H2SO4 + 10Сu + 4Н3РО4
Уравнение реакции с дихроматом натрия в присутствии серной кислоты:
6P + 5Na2Cr2O7 + 20H2SO4 = 5Cr2(SO4)3 + 5Na2SO4 + 6H3PO4 + 11H2O
Уравнение реакции с гидроксидом калия в водном растворе при нагревании:
P4 + 3KOH + 3H2O = PH3+ 3KH2PO2
б) POCl3 → H3PO4 → Р4О6 → BaHPO4 → P4 → KH2PO2.
Уравнения реакций, соответствующих превращениям:
POCl3 + 3 H2O = H3PO4 + 3 HCl.
2) 2H3PO4 + 3Ca(OH)2 = Ca3(PO4)2 + 6H2O
2Ca3(PO4)2 + 10C + 6SiO2 = 6CaSiO3 + 10CO + P4
P4 + 3O2 = Р4О6
t
3) Р4О6 + 2О2 = Р4О10
Р4О10 + 4Ba(OH)2 = 4BaHPO4 + 2H2O
4) 2BaHPO4 + Ва(ОН)2 = Вa3(PO4)2 + 2Н2О
2Вa3(PO4)2 + 10C + 6SiO2 = 6ВaSiO3 + 10CO + P4
5) P4 + 3KOH + 3H2O = PH3+ 3KH2PO2
Т е м а XIV
