
- •Матеріали для самостійної роботи студентів і курсу відділення “Фармація” з дисципліни “Неорганічна хімія”
- •1 Тема «Вступ. Основні поняття та закони хімії.»
- •Основні поняття та закони хімії Атомно-молекулярна теорія
- •Основні поняття хімії
- •Відносні атомні та молекулярні маси. Моль, молярна маса
- •Основні закони хімії Закон збереження маси речовин
- •Закон сталості складу
- •Закон кратних відношень
- •Закон еквівалентів
- •Закон об’ємних відношень
- •Закон Авогадро та його наслідки
- •2 Тема «Класи неорганічних сполук»
- •Номенклатура оксидів
- •Одержання оксидів
- •Хімічні властивості оксидів
- •Номенклатура основ
- •Одержання гідроксидів
- •Хімічні властивості основ
- •Амфотерні гідроксиди
- •Кислота
- •Номенклатура солей
- •Традиційні та систематичні назви аніонів кислот
- •Методи одержання солей
- •Хімічні властивості солей
- •3 Тема “Номенклатура неорганічних сполук”
- •4 Тема “Періодичний закон д.І. Менделєєва та його тлумачення на основі електронної будови атомів” (3 г.)
- •Періодичний закон д. І. Менделєєва
- •Описання періодичної системи
- •Періодичний закон д. І. Менделєєва на основі теорії будови атома
- •5 Тема “Хімічний зв’язок”
- •Хімічний зв’язок і будова молекул
- •Основні параметри хімічного зв’язку
- •Ковалентний зв’язок
- •Властивості ковалентного зв’язку
- •Напрямленість ковалентного зв’язку
- •Теорія гібридизації
- •Полярність
- •Металічний зв’язок
- •6 Тема “ Будова молекул”
- •Міжмолекулярна взаємодія
- •Водневий зв’язок
- •7 Тема “ Швидкість хімічної реакції.”
- •Хімічна кінетика. Хімічна рівновага
- •Швидкість хімічної реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин
- •Вплив температури на швидкість реакції
- •Каталіз
- •8 Тема “ Швидкість хімічної реакції.”
- •Хімічна рівновага
- •Зміщення хімічної рівноваги. Принцип Ле Шательє
- •9 Тема “ Вода”
- •10 Тема “ Розчини”
- •Основні параметри стану розчину — це температура, тиск та концентрація.
- •11 Тема “ Властивості розчинів електролітів ”
- •Теорія електролітичної дисоціації
- •Внаслідок дії розчинника
- •Дисоціація кислот, основ, солей.
- •Ступінь та константа дисоціації
- •Іонні рівняння реакцій
- •12 Тема “ Окисно-відновні реакції ”
- •Окиснювально-відновні реакції
- •Ступінь (стан) окиснення елементів
- •13 Тема “ Окисно-відновні реакції ”
- •Окиснювально-відновні властивості простих речовин та сполук елементів
- •14 Тема “ Комплексні сполуки.”
- •Основні положення координаційної теорії
- •Хімічний зв’язок у комплексних сполуках
- •15 Тема “ Комплексні сполуки.” (2 г.)
- •16 Тема “ Елементи VII – а групи”
- •Поширення в природі. Одержання
- •Фізичні та хімічні властивості хлору
- •17 Тема “Елементи VII – а групи” (2 г.)
- •18 Тема “ Елементи VI а групи ”
- •Загальна характеристика
- •Оксиген
- •Біологічна роль та використання Оксигену в медицині
- •19 Тема “ Елементи VI а групи ”
- •Поширення в природі та одержання сірки
- •Біологічна роль і використання в медицині сполук сірки
- •20 Тема “ Елементи V а групи ”
- •Загальна характеристика елементів vа групи
- •Нітроген
- •Поширення в природі та одержання азоту
- •Фізичні та хімічні властивості
- •Водневі сполуки Нітрогену
- •Оксиди Нітрогену
- •21 Тема “ Елементи V а групи ”
- •Природні сполуки та одержання фосфору
- •Фізичні та хімічні властивості фосфору
- •Арсен, Стибій, Вісмут
- •Природні сполуки і одержання
- •Прості речовини. Фізичні та хімічні властивості
- •Сполуки Арсену, Стибію і Вісмуту
- •22 Тема “ Елементи-неметали IV та ііі а групи”
- •Загальна характеристика елементів iva групи
- •Карбон Поширення в природі
- •Алотропні видозміни і фізичні властивості вуглецю
- •Активоване вугілля
- •Кисневі сполуки Карбону
- •23 Тема “ Елементи – метали іv а та ііі а груп”
- •Фізичні та хімічні властивості
- •Біологічна роль і застосування у медицині сполук елементів іvа групи
- •24 Тема “ Елементи vі в групи”
- •Загальна характеристика d-елементів
- •Загальна характеристика елементів vів групи
- •Біологічне значення елементів vів групи
- •25 Тема “ Елементи viі в групи”
- •Загальна характеристика елементів vіів групи
- •Біологічне значення і використання в медицині сполук Мангану
- •26 Тема “ Елементи viіі в групи”
- •Загальна характеристика елементів vііів групи
- •Характеристика елементів тріади Феруму
- •Біологічна роль і використання в медицині сполук Феруму, Кобальту та Ніколю
- •27 Тема “ Елементи і в та іі в груп”
- •Загальна характеристика елементів ів групи
- •Поширення в природі та одержання металів підгрупи Купруму
- •Біологічна роль та використання в медицині сполук Купруму, Аргентуму і Ауруму
- •Загальна характеристика елементів іів групи
- •Поширення в природі і одержання металів підгрупи Цинку
- •Сполуки Цинку та Кадмію
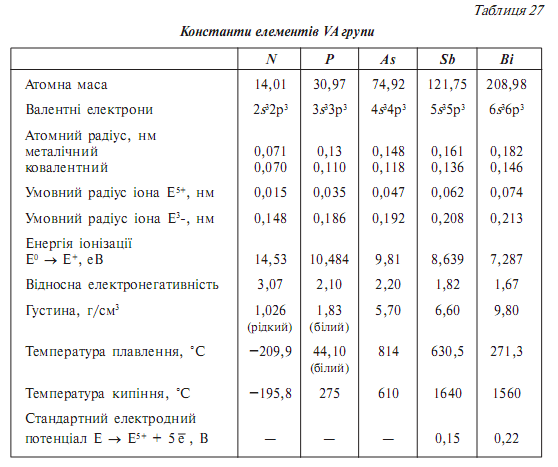
Загальна характеристика елементів vа групи
До VА групи періодичної системи належать два типових елементи — Нітроген N і Фосфор Р, а також три їх електронні аналоги — елементи великих періодів: Арсен Аs, Стибій Sb і Бісмут Ві. Елементи VА групи на зовнішньому енергетичному рівні містять п’ять електронів ns2np3. Наявність валентних d-орбіталей у атомів елементів, крім Нітрогену, обумовлює можливість переходу s-електронів на d-підрівень, завдяки чому ці елементи виявляють валентність 5, яка відповідає номеру групи. У своїх сполуках елементи VА групи мають широкий діапазон ступенів окиснення від —3 до +5.
Як видно з наведених даних, у межах VА групи розміри атомів та іонів зростають, енергії іонізації закономірно зменшуються. Неметалічні властивості зверху донизу зменшуються, а металічні збільшуються.
Нітроген
Нітроген — перший p-елемент VА групи. У перекладі з грецької «Нітроген» означає «нежиттєдіяльний». Таку назву Нітроген одержав за нездатність підтримувати горіння органічних речовин. На зовнішньому енергетичному рівні атом Нітрогену містить 5 електронів, які розміщуються на чотирьох валентних орбіталях 2s2, 2p1х, 2р1у, 2р1z Внаслідок відсутності d-підрівня Нітроген не може переходити у збуджений стан. У зв’язку з цим максимальна валентність Нітрогену в сполуках дорівнює чотирьом.
Ступінь окиснення Нітрогену в його сполуках змінюється у широких межах від —3 до +5:

У більшості сполук Нітрогену хімічний зв’язок між атомами ковалентний, тому ступінь окиснення Нітрогену та його валентність не співпадають.
Поширення в природі та одержання азоту
Основна маса Нітрогену зосереджена в атмосфері у вигляді простої речовини (78 об. часток, %). Зв’язаний Нітроген утворює мінерали у формі нітратів: чилійська NаNO3, індійська КNO3 і норвезька Са(NO3)2 селітри. Крім того Нітроген входить до складу білкових тіл усіх рослинних і тваринних організмів.
В техніці азот отримують фракційною перегонкою рідкого повітря.
У лабораторії азот одержують нагріванням суміші розчинів хлориду амонію і нітриту натрію. Спочатку як проміжний продукт утворюється нітрит амонію. Це термічно нестійка сполука, яка при подальшому нагріванні розкладається:
NH4Cl+NaNO2=NH4NO2+NaCl
NН4 NO2 -» N2 + 2Н20.
Фізичні та хімічні властивості
Азот — безбарвний газ, який не має ні смаку, ні запаху. Він погано розчиняється у воді та органічних розчинниках.
Потрійний зв’язок між атомами у молекулі N2 виключно міцний, його енергія дисоціації дорівнює 946 кДж/моль.
Внаслідок міцності молекули азот хімічно малоактивний, при кімнатній температурі реагує лише з літієм, утворюючи нітрид літію Lі3N
6Li + N2 = 2Lі3N
Активність азоту зростає з підвищенням температури. При високих температурах і у присутності каталізаторів азот взаємодіє з неметалами: киснем, воднем, галогенами та ін.
Використовують азот головним чином для промислового одержання аміаку, нітратної кислоти, а також як хімічно інертний газ для заповнення балонів електроламп, як середовище для перекачки нафтопродуктів та проведення хімічних синтезів, які потребують особливих умов.
При проведенні деяких хірургічних операцій методом кріотерапії використовують рідкий азот, який зберігають у посудині Дьюара.
