
- •1.Значение и классификация углеводов.
- •2.Переваривание и всасывание углеводов
- •3.Механизмы трансмембранного переноса глюкозы.
- •5. Гликонегенез. Биологическое значение.
- •8. Строение гликогена.Распад гликогена.
- •9.Окислетильный этап пентозофосфатный пути превращения глюкозы.Значение окислительного этапа гмф-пути.
- •10.Неокислительный этап пентозофосфатного пути превращения глюкозы.Значение неокислительного этапа гмф-пути.
- •11.Регуляция гликолиза и глюконеогенеза в печени.
- •2. Переключение печени с гликолиза на глюконеогенез и наоборот происходит с участием инсулина и глюкагона и осуществляется с помощью:
- •12.Гормрнальная регуляция метаболизма углеводов.Гормоны прямого действия. Инсулин, адреналин, глюкагон. Основные механизмы действия.
- •13.Гормональная регуляция метаболизма углеводов.Гормоны косвенного действия. Самотропный гормон,гормоны щитовидной железы.Основные механизмы действия.
- •14.Обмен фруктозы. Нарушение обмена фруктозы.
- •15.Обмен галактозы.Нарушение обмена галактозы.
- •16.Структура и биологическая роль гликозамингликанов.Строение и биологическое значение Гиалуроновой кислоты и Хондроитин-4-сульфат.
- •17.Структура и биологическая роль гликозамингликанов.Строение и биологическое значение Дерматансульфат и Гепарансульфат.
- •18. Структура и биологическая роль гликозамингликанов.Строение и биологическое значение Гепарина и Кератансульфат.
- •19. Структура и биологическая роль гликозамингликанов. Строение и биологическое значение Гиалуроновая кислота и Гепарансульфат.
- •23.,24.Состав и функции гликопротеидов. Общая характеристика функции гаптоглобина, трансферрина, церулоплазмина, фибриногена, - фетопротеина.
- •27.Метаболические и гормональные нарушения при сахарном диабете.
- •28.,29. Нарушения обмена гликогена
- •33.Пируватдегидрогеназный комплекс
- •Итоговое уравнение
- •37. Хемиосмотическое сопряжение.
- •Общая характеристика этапов хемиосмотического процесса
- •40.Окислительное фосфорилирование
- •41. Разобщение дыхания и фосфорилирования
- •43. Регуляция энергетического обмена
- •44. Гипоэнергетические состояния
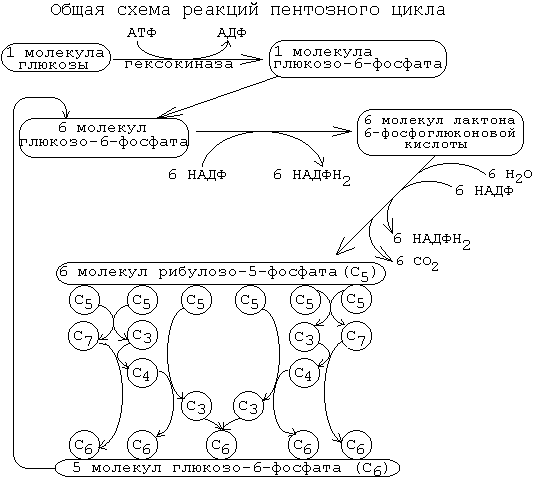
10.Неокислительный этап пентозофосфатного пути превращения глюкозы.Значение неокислительного этапа гмф-пути.
Протекает в цитоплазме. Состоит из 2-х этапов: 1. Окислительный. 2. Неокислительный .
Неокислительный этап – это совокупность большого количества обратимых реакций. Каждая из них - это перенос 2-х или 3-х углеродного фрагмента с одного моносахарида на другой. Между моносахаридами происходит взаимный обмен частями своих молекул. При этом из пентозофосфатов, вступающих в реакцию, образуются моносахариды с разным числом углеродных атомов. Это триозы (например, фосфоглицериновый альдегид (ФГА)), тетрозы, гексозы, гептозы. Реакции неокислительного этапа катализируются ферментами трансальдолазами и транскетолазами. В состав кофермента транскетолаз входит витамин В1. В результате 6 молекул рибозо-5-фосфата превращаются в 5 молекул глюкозо-6-фосфата. Эти 5 молекул глюкозо-6-фосфата вместе с еще одной, поступающей дополнительно, опять вступают в пентозофосфатный путь. Получается цикл. На каждом его "обороте" происходит частичное окисление 6-ти молекул глюкозо-6-фосфата, то есть 5 молекул глюкозо-6-фосфата остаются нетронутыми, а одна молекула полностью расщепляется до СО2 и Н2О. Значение неокислительного этапа пентозофосфатного пути
1.Является источником моносахаридов с разным числом углеродных атомов. Это строительный материал для разных синтезов, в том числе для синтезов различных олигосахаридов, которые входят в состав различных клеточных рецепторов.
2 Образующийся фосфоглицериновый альдегид является точкой сопряжения между пентозофосфатным путем и некоторыми другими путями метаболизма. Например: он может восстанавливаться до фосфоглицерина, который нужен для синтеза жиров.
Пентозофосфатный путь существует не во всех типах клеток. Наиболее интенсивно пентозофосфатный путь протекает в печени, эритроцитах, надпочечниках, половых железах, жировой ткани и молочной железе. Но даже в этих тканях пентозофосфатный путь расщепляется не более 25-30% глюкозы. Почему в этих тканях пентозофосфатный путь имеет такое значение? Потому что клеткам этих тканей нужно много НАДФН2.
11.Регуляция гликолиза и глюконеогенеза в печени.
Печень отличается наиболее сложным обменом глюкозы по сравнению с другими органами. Кроме двух противоположных процессов — синтеза и распада гликогена — в печени могут происходить два других противоположно направленных процесса — гликолиз и глюконеогенез.
В случае как синтеза и распада гликогена, так и гликолиза и глюконеогенеза направление метаболизма глюкозы в печени связано с ритмом питания. При пищеварении значительная часть глюкозы (около половины) из крови воротной вены задерживается печенью, откладывается в форме гликогена, а также используется для синтеза жиров. Исходные субстраты для синтеза жиров — -глицерофосфат и жирные кислоты — образуются в процессе гликолиза и ОПК. Синтез жиров из глюкозы происходит подобным образом и в жировой ткани.
2. Переключение печени с гликолиза на глюконеогенез и наоборот происходит с участием инсулина и глюкагона и осуществляется с помощью:
аллостерических механизмов;
ковалентной модификации ферментов путем фосфорилирования / дефосфорилирования;
индукции / репрессии синтеза ключевых ферментов, катализирующих реакции субстратньх циклов.
Регуляция направлена на необратимые стадии гликолиза и глюконеогенеза.
В период пищеварения после приема богатой углеводами пищи инсулин-глюкагоновый индекс возрастает, индуцируется транскрипция генов и увеличивается количество гликолитических ферментов глюкокиназы, фосфофруктокиназы и пируваткиназы, что стимулирует гликолитический путь.
При уменьшении инсулин-глюкагонового индекса транскрипция гена и синтез этих ферментов снижаются, но синтез ферментов глюконеогенеза — фосфоенолпируваткарбоксикиназы, фруктозо-6-фосфатазы и глюкозо-6-фосфатазы — увеличивается, в результате чего стимулируется глюконеогенез.
Регуляция энергетического статуса гепатоцитов осуществляется путем изменения скорости аэробного распада глюкозы.
Глюкоза в клетках печени используется не только для синтеза гликогена и жиров, но и как источник энергии, который необходим для синтеза веществ на экспорт и для жизнеобеспечения самих гепатоцитов. АТР синтезируется в реакциях субстратного и окислительного фосфорилирования при аэробном гликолизе, в результате окислительного декарбоксилирования пирувата и окисления ацетил-КоА в цитратном цикле.
Основными потребителями АТР в гепатоцитах являются трансмембранный перенос веществ, синтез белков, гликогена, жиров, глюконеогенез. От скорости утилизации АТР в этих процессах зависит скорость его синтеза. Это достигается тем, что АТР и AMP являются аллостерическими эффекторами некоторых гликолитических ферментов. В частности, AMP активирует фосфофруктокиназу и ингибирует фосфатазу фруктозо-1,6-бифосфата, а АТФ ингибирует пируваткиназу.
Следовательно, при усилении расходования АТФ и снижении его концентрации (при одновременном увеличении концентрации АМФ) активируется гликолиз и синтез АТФ, а глюконеогенез замедляется. От АТФ и АМФ зависит и скорость реакций общего пути катаболизма.
