
VI. Процессы сульфирования и сульфатирования
6.1. Реакции сульфирования
Сульфирование ароматических углеводородов
Сульфированием называется процесс введения сульфогруппы - SODOH в органическое соединение. Продуктами реакции являются сульфоновые кислоты (сульфокислоты). Сульфирование широко используется в лабораторной практике и промышленности.
Сульфокислоты и их производные находят разнообразное применениеюни являются полупродуктами в производстве фенолов и нафтолов; многие производные сульфокислот используются в производстве азокрасителей, моющих средств, лекарственных препаратов, поверхностно-активных веществ, применяются также как алкилирующие агенты и дезинфицирующие средств.
Для введения сульфогруппы применяются различные сульфирующие агенты: серная кислота различных концентраций серный ангидрид, сернистый ангидрид и др.
Парафиновые углеводороды устойчивы к действию обычных сульфирующтх агентов. Высшие парафины (от гексана) сульфируются 15%-м олеумом при температуре кипения:
C6H14+HOS02OHСбН1зS0зН+Н20.
Большое промышленное значение имеет сульфирование парафинов и циклопарафинов смесью диоксида серы(4) и хлора (сульфохлорирование), а также смесью диоксида серы(4) и кислорода (сульфооксиление).
Сульфирование ароматических соединений
Одно из характерных отличий ароматических углеводородов от парафиновых легкость, с которой ароматических соединения сульфируются серной кислотой.
Наиболее легко сульфируются полициклические ароматические углеводороды (антрацен,фенантрен и др),труднее-нафталин ,еще труднее-бензол. Сульфирование серной кислотой - обратимый процесс: ArH+HOS03HArS03H+H20.
Вода, выделяющаяся при реакции, понижает концентрацию серной кислоты, которая при этом теряет свои сульфирующие свойств, и вызывает обратную реакцию-гидролиз образующейся сульфокислоты. Поэтому при сульфировании применяют большой избыток серной кислоты (от двух-до пятикратного) или же используют олеум с таким содержанием серного ангидрида, которого достаточно для связывания выделяющейся воды.
При исследовании кинетики реакции сульфирования было установлено, что сульфирующим агентом сульфирования было установлена, что сульфирующим агентом являются ион сульфония SO+, образующийся по реакции: 2H2S04S03++H20++HS04.
Легкость сульфирования производных ароматических углеводородов зависит также от характера их заместителей. Заместители 1 рода, расположенные в порядке убывания их влияния, OH>OR>NH2>NHCOR>R(гдe R-алкил) облегчают введение сульфогруппы: заместители 2 рода N02>S03H>CO>COOH,a также галогены затрудняют введение сульфогруппы.
Для получение полисульфокислот ароматического ряда сульфируемое соединение обрабатывают либо сразу необходимым количеством серной кислоты или олеума, либо проводят сульфирование ступенчато, выбирая для каждой «ступени» оптимальную температуру и подходящую концентрацию; при этом требуются уже более жесткие условия,ч ем для получения моносульфокислот.
Важным фактором, влияющим на течение реакции сульфирование, являются температура. Повышение температуры не только ускоряет процесс, но и способствует образованию различных побочных продуктов (полисульфокислот, сульфинов, продуктов реакции окисления и реакции конденсации). Однако не только поэтому при каждом процессе сульфирования должна поддерживается строго определенная оптимальная температура. Часто температурный режим обусловливает место вхождения сульфогруппы в ароматическое ядро. При сульфировании соединений с заместителями 1 рода повышение температуры способствует увеличению выхода пара-изомера. Так, например, при 0°С из толуола образуются о- и n-толуолсульфокислоты примерно в равных количествах, а при 100 °С получается 79% пара-изомера и лишь 13% орто-изомера. Сулфирование фенола при комнатной температуре приводит к образованию о-фенолсульфокислоты, а при 100С - к пара-изомеру. Направление реакции сульфирования нафталина также в основном зависит от температуры. При сульфирование 100%-й серной кислотой при 80-90С получается главным образом - нафталинсульфокислота: наряду с ней образуется - изомер в соотношении 96:4.В результате сульфирования нафталина при 160С получается преимущественно 6 - нафталинсульфокислота, но наряду с ней образуются также ex- изомер и продукты дальнейшего сульфирования дисульфокислоты. Объясняется это тем, что при сульфировании нафталина протекает две обратимые реакции с образованием а и В-изомеров: C1oH8+H2S04C10H7SO2OH+H2O
При низких температурах скорость образования а-нафталинсульфокислоты в несколько раз выше, чем В-изомера, поэтому главным образом и получается а- нафталинсульфокислота с примесью В-изомера. При повышении температуры а- нафталинсульфокислота гидролиизуется в 16 раз быстрее, чем В - изомер, следовательно, количество а -нафталинсульфокислоты уменынается,а В-изомера - все более увеличивается. Таким образом, при высокой температуре равновесие реакции сульфирования нафталина сдвинуто для а - изомера влево, а для В-изомера, как более устойчивого к гидролизу, вправо.
В некоторых случаях место вступления сульфогруппы зависит от катализатора, Так ,при сульфировании антрахинона без катализатора образуется главным образом В - антрахиносульфокислота, а в присутствии незначительного количества солей ртута получается а - антрахинонсульфокислота.
Сульфокислоты являются трудно характеризуемыми веществами, так как большинство из них не имеет определенных температур плавления и кипения. Кроме того, при выделении свободных сульфокислот трудно освободиться от органических примесий. В связи с этим сульфокислоты выделяются обычно в виде солей, которые могут быть очищены кристаллизацией, и многие из них имеют характерные температуры плавления.
6.2.Лабора горная работа № 7
Получение 2-нафталипсульфокислоты
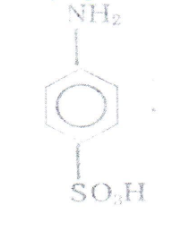
Основные реакций:
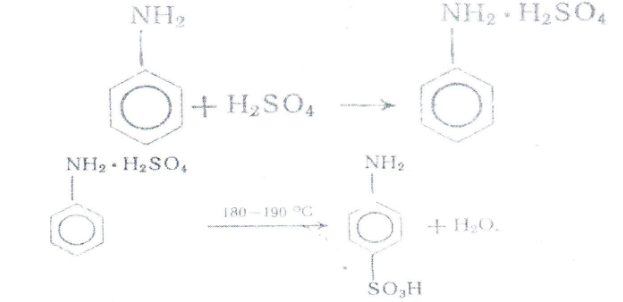
Побочная реакция:
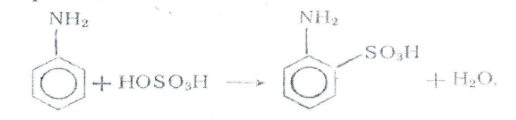
Для получения сульфаниловой кислоты и других моносульфокнслот первичных ароматических амином обычно применяется метод, основамный на гом, что при нагревании в течение нескольких часом при ISO 190 °С гидросульфаты многих первичных аминов переходя» в сульфокислоты, преимущественно в пара-положение. Анилин сульфируется легко, при лом и качестве побочного продукта образуется ортанилоная кислота (оамннобензолсульфокислота ), которую с хорошим выходом можно получить мри сульфировании анилина хлорсульфоновой кислотой м органических растворителях.

Сборка приборов
1. В круглодонную колбу вместимостью 100 мл вставляют термометр так, чтобы его шарик был погружен в реакционную массу, и помещают колбу на песчаную баню. Горло колбы закрывают пробкой с боковой прорезью.
2. Прибор для отсасывания.
Выполнение синтеза
В круглодонную колбу прибора 1 помещают 12 мл концентрированной
серной кислоты и постепенно, при перемешивании, порциями вносят 12,8 г тщательно измельченного нафталина. После прибавления всей кислоты нагревают реакционную массу в течение 4 ч на песчаной бане при 160-170 °С (термометр в колбе), наблюдая, чтобы температура не поднималась выше, иначе могут иметь место побочные процессы-образование полисульфокислот, сульфонов, реакция окисления.
По окончании реакции смесь немного охлаждают и постепенно, при перемешивании переливают ее в стакан, содержащий 200 мл холодной воды. При этом выделяется осадок, состоящий из непрореагировавшего нафталина и небольшого количества побочного подукта - ди- В-нафтилсульфона, который отсасывают на воронке Бюхнера или отделяют декантацией (побочный процесс можно исключить, если применять большой избыток серной кислоты).
Избыток исходной серной кислоты нейтрализует постепенным добавлением 8 г карбоната натрия. Для получения натриевой соли В-нафталинсульфокислоты сульфомассу постепенно, при перемешивании вливают в насыщенный на холоду раствор хлорида натрия, который находится в стакане, охлаждаемом льдом ( насыщенный раствор хлорида натрия готовят растворением 38 г NaCl в 125 мл горячей воды).
Вывод
На практике по «Нефтехимическому синтезу» я изучил технику безопасности в лаборатории, эту ответственную работу нужно выполнять аккуратно, также надо уметь оказывать медицинскую помощь и я понял, что технику безопасности знать нужно обязательно. Научился правильно пользоваться приборами и реактивами во время работы, ознакомился с методикой и проведением лабораторных работ, синтезировали продукты нефтехимического синтеза, такие как бензойная кислота, бензиновый спирт, нафталинсульфокислоты, стирол и т.д. Благодаря этой практике я закрепил свои теоретические знания в лабораторных условиях.
Литература
1. Белов П.С. «Основы технологии нефтехимического синтеза», М, Химия, 1982.
2. Адельсон СВ. и др. «Технология нефтехимического синтеза», М., Химия, 1985.
3. Лебедев Н.Н. «Химия и технология основного органического нефтехимического синтеза», М., Химия, 1988
4. Храмкина М.Н. «Практикум по органическому синтезу».
