
II. Процессы алкилирования
2.1.Реакции алкилирования. Алкилирование ароматических углеводородов спиртами в присутствии серной кислоты
Алкилированием называют процессы введения алкильных групп в молекулы органических и некоторых неорганических веществ. Эти реакции имеют очень большое практическое значение для синтеза алкилированных в ядро ароматических соединений, изопарафинов, многих меркаптанов и сульфидов, аминов, веществ с простой эфирной связью, элемент- и металлорганических соединений, продуктов переработки а-оксидов и ацетилена. Процессы алкилирования часто являются промежуточными стадиями в производстве мономеров, моющих веществ и т. д.
Многие из продуктов алкилирования производятся в очень крупных масштабах. Так, в США синтезируют ежегодно около 4 млн. т этилбензола, 1,6 млн. т изопропилбензола, 0,4 млн. т высших алкилбензолов, свыше 4 млн. т гликолей и других продуктов переработки алкиленоксидов, около 30 млн. т изопарафинового алкилата, около 1 млн. т трет бутилметилового эфира и т. д.
Алкилирование ароматических соединений по методу Фриделя-Крафтса. Некоторые ароматические соединения в присутствии хлорида алюминия могут легко алкилироваться гапогенолакилами, олефинами и спиртами. Скорость реакции зависит от природы галогена и алкилируемого агента.
В лаборатории алкилирование по Фриделю-Крафсту имеет ограниченное значение. При алкилировании бензола получается смесь моно-, ди- и полизамещенных углеводородов. Это объясняется тем, что скорость реакции алкилирования самого бензола меньше, чем скорость реакции алкилирования образующегося на первой стадии алкилбензола. Под влиянием хлорида алюминия может происходить не только замещение алкильным радикалом водорода ароматического ядра, но и дегидрирование, гидрирование, изомеризация и полимеризация продуктов. Течение реакции алкилирования бензола частично можно регулировать путем подбора соответствующих количеств реагентов. Если хотят получить моноалкилзамещенный продукт бензола, то берут большой избыток последнего, а для получения полиалкилзамещенных производных бензола применяют избыток алкилирующего агента. Однако нельзя полностью избежать образования продуктов разной степени замещения, что снижает выход и представляет определенные трудности при выделении основного продукта. Во время взаимодействия ароматического соединения с первичными галогеналкилами, имеющими неразветвленную цепь углеводородных атомов, могут получаться производные с разветвленную боковой цепью. Например, из бензола и пропилхлорида получается изопропилбензол, из бутилбромида и бензола-втор-бутилбензол.
Алкилирование в присутствии хлорида алюминия, на примере образования изопропилбензола, можно представить следующим образом. В безводном хлориде алюминия атом алюминия имеет лишь шесть электронов на внешней орбитали. Он дополняет эту группировку до октета за счет оттягивания электронов хлора пропилхлорида.
Перед синтезом по методу Фриделя-Крафтса все реагенты должны быть тщательно высушены, так как хлорид алюминия очень легко подвергается гидролизу. Аппаратуру для проведения синтеза также должна быть высушена и защищена от доступа влаги
2.2. Лабораторная работа № 2
Алкилирование толуола бутанолом
Сборка приборов
1. Трехгорлую круглодонную колбу вместимостью 500 мл снабжают обратными холодильником, капельной воронкой и мешалкой.
2. Прибор для фракционной разгонки.
Выполнение синтеза
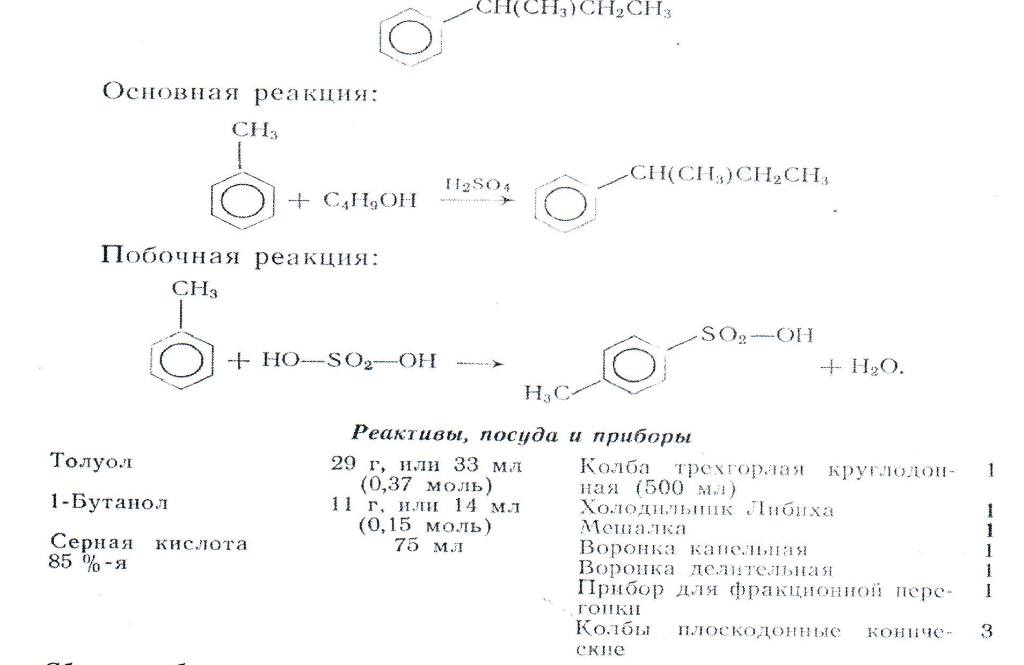
В трехгорлую круглодонную колбу вместимостью 500 мл помещают 75 мл 85 %-й серной кислоты и из капельной воронки в течение 1 ч при энергичном перемешивании и нагревании на водяной бане при 70-80 °С по каплям вносят смесь, состоящую из 33 мл толуола и 14 мл 1 -бутанола.
Необходимо поддержать строго определенную концентрацию кислоты, так как это сильно влияет на выход продукта. Опыт ведется при интенсивном перемешивании, чтобы реакционная смесь не разделялась на две несмешивающихся слоя серной кислоты и толуола. Необходимо строго следить за температурным режимом, так как при 55°С реакция идет очень медленно, а при повышении ее до 95°С продукты начинают сульфироваться. После внесения смеси размешивание продолжают еще в течение 5 ч при той же температуре.
После окончания реакции переливают содержимое реакционной колбы в делительную. Воронку, отделяют верхний углеводородный слой, два раза промывают его водой, высушивают над хлоридом кальция, а затем переносят в круглодонную колбу и проводят фракционную разгонку, отбирая две фракции: до 190 °С и 190-196,0°С. Последняя фракция представляет собой частный втор-бути л бензол.
1-Втор—Бутил-4-метилбензол-жилкостъ; t кип=196°С; /т=873 кг/м3 n20D= 1.497.
