
- •Поверхность раздела твердое тело-газ
- •1. Адсорбционные методы исследования пористых материалов (адсорбентов и катализаторов)
- •1.1. Общая характеристика пористых тел
- •1.1.1. Пористость
- •1.1.2. Удельная поверхность и методы ее определения
- •1.2. Адсорбционно-структурный анализ пористых твердых тел
- •1.2.1. Определение величины удельной поверхности скелета по методу бэт
- •1.2.2. Определение поверхности адсорбционной пленки
- •1.2.3. Раздельное определение объемов микро- и мезопор
- •1.2.4. Построение кривой распределения объема пор по радиусам
- •Лабораторная работа № 1 Определение удельной поверхности адсорбентов методом тепловой десорбции азота
- •Сущность метода тепловой десорбции азота (аргона)
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Лабораторная работа № 2 Определение пористой структуры адсорбентов
- •Порядок выполнения работы
- •1.2.5. Адсорбционная способность пористых тел
- •Лабораторная работа № 3 Адсорбционная активность силикагеля
- •Порядок выполнения работы
- •Порядок работы на рефрактометре рл-2
- •Обработка результатов измерений
- •II. Поверхность раздела твердое тело - жидкость
- •2.1. Межфазные взаимодействия между конденсированными фазами.
- •2.2. Управление смачиванием.
- •Лабораторная работа № 4. Изучение влияния природы материала на смачивание его поверхности.
- •Порядок выполнения работы.
- •Обработка результатов
- •Контрольные вопросы и задания
- •Лабораторная работа № 5 Определение теплоты смачивания
- •Обработка полученных результатов
- •Экспериментальная часть
- •Вариант № 1
- •Вариант № 2
- •Опыт № 1. Влияние рН на набухание и определение изоэлектрической точки желатина
- •Опыт № 1.1. Влияние рН на набухание
- •Опыт № 2. Влияние электролитов на набухание
- •Контрольные вопросы и задания
- •Лабораторная работа № 7 Изучение устойчивости лиофобных золей Краткие теоретические сведения
- •Коагуляция лиофобных дисперсных систем
- •Экспериментальная часть
- •Изучение устойчивости коллоидных систем.
- •Порядок выполнения работы
- •1. Получение золя «берлинской лазури» с отрицательно заряженными частицами.
- •4. Получение золя Fе(он)3 методом пептизации.
- •Определение знака заряда коллоидных частиц
- •Вариант № 1 Опыт № 1. Определение порога коагуляции гидрозоля железа (III)
- •Вариант № 2
- •Опыт № 2. Исследование процесса коагуляции золя «берлинской лазури» с отрицательно заряженными частицами.
- •Порядок выполнения работы
- •Контрольные вопросы и задания
- •Лабораторная работа № 8 Адсорбция на границе раздела твердое тело–раствор. Избирательность адсорбции.
- •Экспериментальная часть
- •Избирательность адсорбции
- •Порядок выполнения работы:
- •2. Адсорбционная хроматография
- •Порядок выполнения работы:
- •3.Ионообменная хроматография
- •Хроматография на бумаге
- •Распределительная хроматография на бумаге
- •Контрольные вопросы
- •Рекомендуемая литература
Экспериментальная часть
Экспериментальная часть работы представлена в двух вариантах. Вариант для выполнения практической части работы определяется преподавателем.
Вариант № 1
Цель работы : исследовать кинетику набухания и зависимость скорости набухания от времени для различных образцов полимеров, определить степень набухания, константу скорости набухания и число набухания ВМС.
Приборы и реактивы:
1. Образцы полимеров (2 обр. размером не менее 1х1, массой 0,1 – 1 г);
2. Конические колбы или химические стаканы – 4 шт;
3. Стеклянная палочка;
4. Водные растворы солей моно- или поливалентных металлов или дистиллированная вода;
5. Органические растворители (толуол, бутанол);
6. Аналитические весы;
7. Фильтр Шотта.
Порядок выполнения работы:
1. Образец высушенного полимера (массой не менее 0,1–1 г) взвешивают на аналитических весах и помещают в колбу или химический стакан с заданной средой набухания.
2. Через равные промежутки времени, например 10 мин, набухший образец отфильтровывают через тонкую пористую сетку (или фильтр Шотта) и переносят в другой химический стакан и взвешивают на аналитических весах (стакан предварительно взвешивают). Результаты измерений записывают в табл. 1. Набухший гель снова помещают в тот же самый раствор на 10 мин. Эксперимент повторяют до тех пор, пока масса взвешенного набухшего полимера не перестанет изменяться.
Таблица 1
Опытные данные по кинетике набухания полимера
Условия набухания гидрогеля: температура °С,_____ ; среда набухания_______; масса сухого образца m0__г; масса набухшего образца mt ___ г; исходный объем раствора____ мл.
Время набухания, t, мин |
Масса образца m, г |
Степень набухания, α, г/г |
Скорость набухания, dα/dt |
ln[m1∞-m10], г/г |
0 |
m1 |
|
|
|
10 |
m2 |
α1 |
|
|
20 |
m3 |
α2 |
|
|
30 |
m4 |
α3 |
|
|
40 |
m5 |
α4 |
|
|
∞ |
mmax |
αmax |
|
|
Константа скорости набухания K ………
Равновесная степень набухания αмакс ………. г/г.
По результатам опыта строят кривую набухания m1τ, τ, а также график ln(m1∞ - m1τ), τ для определения константы набухания К. Вычисляют число набухания.
Обработка результатов
1. По данным табл.1 строят график зависимости степени набухания от времени, где по оси ординат откладывают степень набухания α (г/г), по оси ординат – время в минутах.
2. На полученных кривых набухания α = f (t) проводят касательные для различных величин α. Находят тангенсы углов, составляемые касательными с осью абсцисс tg ϕ = dα/dt, рассчитывают скорости набухания полимеров.
3. Строят график зависимости ln [αмакс − α(t)] от t (мин) для данного растворителя и по тангенсу угла наклона определяют константу набухания.
По данным таблицы 1 строят график зависимости количества поглощенной жидкости от времени. Кинетика набухания описывается уравнением, подобным уравнению необратимой реакции первого порядка:
W=dV/dt =K(Vmax - Vt); W=dm/dt =K(mmax - mt) (6.8),
где W – скорость набухания, Vt - количество жидкости, поглощенной веществом к моменту времени t; Vmax - максимальное количество жидкости, поглощенной веществом, K – константа скорости набухания.
Интегрируя данное уравнение (6.8), получаем:
- ln (Vmax – Vt) + ln (Vmax) = kt (6.9)
или –2.3*lg (Vmax – Vt) + 2.3*lg (Vmax) = kt (6.10)
Переносим 2.3*lg (Vmax) в правую часть и каждый член уравнения делим на -2.3. В результате получаем :
lg (Vmax – Vt) = -0.434*kt + lg Vmax (6.11)
Это уравнение прямой в координатах lg (Vmax–Vt) = a*t + b (рис. 2), где а = – 0.434*k и представляет собой тангенс угла α, образуемого прямой с осью абсцисс. Отсюда константа скорости набухания k равна:
k = - tg α/ 0.434 = tg β/ 0.434 (6.12)
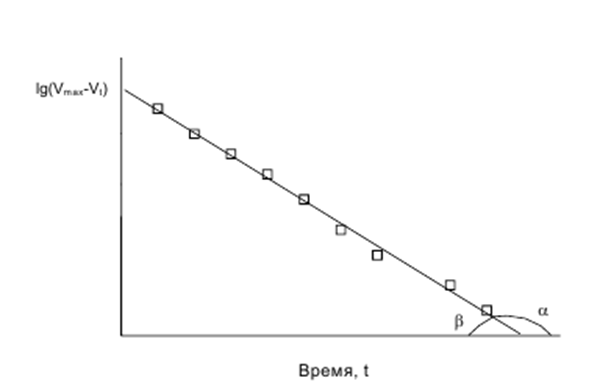
Рис. 6.5. Графический способ определения констант скорости набухания.
