
- •Поверхность раздела твердое тело-газ
- •1. Адсорбционные методы исследования пористых материалов (адсорбентов и катализаторов)
- •1.1. Общая характеристика пористых тел
- •1.1.1. Пористость
- •1.1.2. Удельная поверхность и методы ее определения
- •1.2. Адсорбционно-структурный анализ пористых твердых тел
- •1.2.1. Определение величины удельной поверхности скелета по методу бэт
- •1.2.2. Определение поверхности адсорбционной пленки
- •1.2.3. Раздельное определение объемов микро- и мезопор
- •1.2.4. Построение кривой распределения объема пор по радиусам
- •Лабораторная работа № 1 Определение удельной поверхности адсорбентов методом тепловой десорбции азота
- •Сущность метода тепловой десорбции азота (аргона)
- •Порядок выполнения работы
- •Обработка результатов измерений
- •Лабораторная работа № 2 Определение пористой структуры адсорбентов
- •Порядок выполнения работы
- •1.2.5. Адсорбционная способность пористых тел
- •Лабораторная работа № 3 Адсорбционная активность силикагеля
- •Порядок выполнения работы
- •Порядок работы на рефрактометре рл-2
- •Обработка результатов измерений
- •II. Поверхность раздела твердое тело - жидкость
- •2.1. Межфазные взаимодействия между конденсированными фазами.
- •2.2. Управление смачиванием.
- •Лабораторная работа № 4. Изучение влияния природы материала на смачивание его поверхности.
- •Порядок выполнения работы.
- •Обработка результатов
- •Контрольные вопросы и задания
- •Лабораторная работа № 5 Определение теплоты смачивания
- •Обработка полученных результатов
- •Экспериментальная часть
- •Вариант № 1
- •Вариант № 2
- •Опыт № 1. Влияние рН на набухание и определение изоэлектрической точки желатина
- •Опыт № 1.1. Влияние рН на набухание
- •Опыт № 2. Влияние электролитов на набухание
- •Контрольные вопросы и задания
- •Лабораторная работа № 7 Изучение устойчивости лиофобных золей Краткие теоретические сведения
- •Коагуляция лиофобных дисперсных систем
- •Экспериментальная часть
- •Изучение устойчивости коллоидных систем.
- •Порядок выполнения работы
- •1. Получение золя «берлинской лазури» с отрицательно заряженными частицами.
- •4. Получение золя Fе(он)3 методом пептизации.
- •Определение знака заряда коллоидных частиц
- •Вариант № 1 Опыт № 1. Определение порога коагуляции гидрозоля железа (III)
- •Вариант № 2
- •Опыт № 2. Исследование процесса коагуляции золя «берлинской лазури» с отрицательно заряженными частицами.
- •Порядок выполнения работы
- •Контрольные вопросы и задания
- •Лабораторная работа № 8 Адсорбция на границе раздела твердое тело–раствор. Избирательность адсорбции.
- •Экспериментальная часть
- •Избирательность адсорбции
- •Порядок выполнения работы:
- •2. Адсорбционная хроматография
- •Порядок выполнения работы:
- •3.Ионообменная хроматография
- •Хроматография на бумаге
- •Распределительная хроматография на бумаге
- •Контрольные вопросы
- •Рекомендуемая литература
Контрольные вопросы и задания
1. В чем заключается физико-химическая основа процесса растекания?
2. Как влияет температура на величину θ?
3. Запишите уравнение, связывающее свободную энергию и полную энергию образования поверхности и наоборот.
4. Какими способами гидрофильную поверхность можно сделать гидрофобной и наоборот? Для чего это бывает необходимо на практике?
5. Покажите связь между адгезией и способностью жидкости смачивать твердую поверхность. В чем различие между явлениями адгезии и смачивания?
Лабораторная работа № 5 Определение теплоты смачивания
Цель работы: определить теплоту смачивания водой адсорбентов и вычислить их удельную поверхность.
Приборы и реактивы: калориметр (1 шт.), механическая мешалка (1 шт.), термометр Бекмана (1 шт.), секундомер, плоскодонная колба емкостью на 500 мл (1 шт), стакан емкостью на 1 л ( 1шт.), цилиндр на 500 мл (1 шт), KCl, вода, адсорбенты.
Смачивание твердой поверхности какой-либо жидкостью сопровождается обычно выделением теплоты, вызываемым действием межмолекулярных сил твердой смачиваемой поверхности и смачивающей жидкости. Особенно заметно выделение тепла при смачивании пористых или высокодисперсных тел, обладающих большой поверхностью.
Теплота, выделяющаяся при смачивании 1 г вещества жидкостью, называется интегральной теплотой смачивания или просто теплотой смачивания.
Величина теплоты смачивания зависит от природы жидкости и твердого тела, а также от величины его смачивающей поверхности. Вещества, которые хорошо смачиваются водой и выделяют при этом большое количество теплоты, чем при смачивании органическими жидкостями, называются гидрофильными. Вещества, которые плохо смачиваются водой, и большее количество теплоты выделяют при смачивании органическими жидкостями, чем водой, называются гидрофобными. Если отношение теплоты смачивания водой к теплоте смачивания бензолом больше единице, то вещество гидрофильное и наоборот.
Поверхностная энергия твердого тела после смачивания уменьшается на величину, равную поверхностной энергии смачивающей жидкости. За счет этого уменьшается и теплота смачивания. Величина теплоты смачивания 1 м2 поверхности твердого тела q выражается формулой 5.1:
 (5.1)
(5.1)
где U2 – полная поверхностная энергия смачиваемого тела на границе твердое тело – жидкость; U1 – полная поверхностная энергия смачиваемого тела на границе твердое тело – воздух; Uж – полная поверхностная энергия смачивающей жидкости на границе жидкость – газ.
Полная поверхностная энергия жидкости согласно уравнению Гиббса – Гельмгольца при T = const может быть выражена следующим образом:
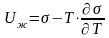 (5.2)
(5.2)
где
σ - поверхностное натяжение жидкости,
 -
температурный коэффициент, который для
воды равен –0,151·10-3
Дж/м2·К.
-
температурный коэффициент, который для
воды равен –0,151·10-3
Дж/м2·К.
Отсюда:
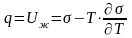 (5.3)
(5.3)
Это уравнение справедливо для тех случаев, когда жидкость полностью смачивает твердую поверхность.
Поверхностное натяжение на границах твердое тело – газ, твердое тело – жидкость практически измерить невозможно, поэтому нельзя вычислить полную поверхностную энергию твердого тела до и после смачивания. Но можно найти полную поверхностную энергию смачивающей жидкости Uж, которая равна теплоте смачивания.
Теплота смачивания 1 г вещества Q (удельная теплота смачивания) имеет вид:
 (5.4)
(5.4)
где q – теплота смачивания 1 м2 поверхности (Дж/м2); S – удельная поверхность адсорбента (м2/г).
Теплоту смачивания находят экспериментально калориметрическим методом. Зная теплоту смачивания, можно рассчитать удельную поверхность адсорбента.
Порядок выполнения работы
1. Исследуемый адсорбент (по указанию преподавателя) поместить в фарфоровую чашечку и высушить в сушильном шкафу в течение 1-1,5 ч. Затем охладить в эксикаторе до комнатной температуры.
2. Установить термометр Бекмана в интервале между 2 и 3 0.
3. Взвесить 2 г хлорида калия.
4. В калориметр налить 200 мл воды и закрыть его крышкой с двумя отверстиями (для термометра Бекмана и мешалки). Погрузить термометр, опустить мешалку и включить перемешивание, постепенно увеличивая скорость, но не доводя до разбрызгивания воды. Термостатировать воду в течение 5 мин.
5. Как только изменение температуры станет равномерным начать отсчеты показаний термометра через 30 с в течение 5 мин.
6. После 10 отсчетов выключить мешалку, засыпать навеску хлорида калия и, включив мешалку, продолжить запись температуры через 30 с в течение 5 мин (время высыпания вещества не более 30 с). Результаты записать в таблицу:
Таблица
№ |
Время от начала опыта, мин |
Показания термометра для воды, град. |
Время от начала опыта, мин |
Показания термометра для раствора КСl, град. |
|
|
|
|
|
7. Взвесить 2 г исследуемого образца.
8. В калориметр налить 200 мл воды на 2-3 0С выше комнатной и закрыть его крышкой. Термометр и мешалку погрузить в воду, включить мешалку и дать установиться температуре всех частей калориметра. Термостатировать воду в течение 5 мин.
9. Как только изменение температуры станет равномерным начать отсчеты показаний термометра через 30 с в течение 5 мин. Это начальный период.
10. После 10 отсчетов выключить мешалку, засыпать навеску исследуемого вещества и, включив мешалку, продолжить запись температуры через 30 с (время высыпания вещества не более 30 с). С момента высыпания вещества начинается главный период, который продолжается до тех пор, пока наблюдается неравномерное повышение температуры. Как только начнется понижение температуры (или равномерное повышение), начинается конечный период, в котором тоже надо сделать 10 отсчетов. Результаты записать в таблицу:
Таблица
№ |
Время от начала опыта, мин |
Показания термометра для воды, град. |
Время от начала опыта, мин |
Показания термометра для суспензии исследу-емого образца, град. |
|
|
|
|
|
