
- •Диетическая коррекция гипотрофии
- •Лечение
- •Антибактериальная терапия пневмоний. Пневмонии у новорожденных. Лечение пневмонии у новорожденного ребенка практически всегда проводится в стационаре. Антибиотики вводятся парентерально.
- •Критерии диагностики врожденных пороков сердца
- •2. Невроз
- •3. Конституциональные особеннсости нервной системы
- •4. Сочетание указанных видов патологии
- •3. Суправентрикулярная пароксизмальная тахикардия.
- •Лечение
- •Хронический гастрит (гастродуоденит) – хроническое, рецидивирующее, склонное к прогрессированию, воспалительно-дистрофическое поражение слизистой оболочки желудка (и двенадцатиперстной кишки)
- •Нет язвы язва
- •Н ейро-эндокринная регуляция
- •Г енетические факторы
- •Классификация язвенной болезни у детей
- •Классификация острых кишечных инфекций по типу диареи
- •1.2. Вирология
- •1.3. Эпидемиология и патогенез
- •1.4. Пути передачи
- •1.5. Клиническая картина
- •1.6. Лабораторные исследования
- •1.10. Лечение
- •1.11. Течение, осложнения и прогноз
- •1.12. Профилактика
- •2. Острый вирусный гепатит в
- •2.1. Определение
- •2.2. Вирология
- •2.3. Частота и эпидемиология
- •2.4. Пути передачи
- •2.5. Клиническая картина и внепеченочные осложнения
- •2.6. Лабораторные исследования
- •2.12. Течение и прогноз
- •3.1. Определение
- •3.2. Вирология
- •3.3. Частота и эпидемиология
- •3.4. Путь передачи
- •3.5. Клиническая картина
- •3.7. Антигены и антитела
- •3.8. Естественное течение
- •3;9. Лечение
- •3.10. Профилактика
- •I. Отбор больных.
- •II.Объем исследований.
- •III. Диагностика.
- •V.Интенсификация.
- •VI. Дополнительные условия.
- •VII. Выписка из стационара, наблюдение и контроль
- •5. Острый вирусный гепатит е
- •5.1. Определение
- •5.2. Вирология
- •5.3. Клиническая картина и эпидемиология
- •5.4. Диагностика и дифференциальная диагностика
- •5.5. Лечение и течение
- •5.6. Профилактика
- •Критерии здоровья
- •1. Особенности онтогенеза, определяемые по данным генеалогического, биологического и социального анамнезов.
- •2. Уровень физического развития и степень его гармоничности.
- •3. Уровень нервно-психического развития и степень его гармоничности.
- •4. Уровень резистентности организма.
- •6. Наличие хронических заболеваний и врождённых пороков развития.
- •XV. Требования к условиям хранения, приготовления и реализации пищевых продуктов и кулинарных изделий в дошкольных организациях
- •XVI. Требования к составлению меню для организации питания детей разного возраста в дошкольных организациях
- •II. Гигиенические требования к режиму дня
Антибактериальная терапия пневмоний. Пневмонии у новорожденных. Лечение пневмонии у новорожденного ребенка практически всегда проводится в стационаре. Антибиотики вводятся парентерально.
При внутриутробных пневмониях препаратами выбора являются ампициллин, ампициллин/сульбактам и сочетании с аминогликозидами. При листериозе препаратом выбора является ампициллин в сочетании с гентамицином. Следует подчеркнуть, что листерии устойчивы к цефалоспоринам. Поэтому допустимо комбинировать цефалоспорины с ампициллином.
В лечении нозокомиальных пневмоний, особенно поздних ВП, предпочтительна комбинация ингибиторозащищённых пенициллинов или цефалоспоринов III поколения с аминогликозидами. При подозрении на пневмоцистную инфекцию применяют ко-тримоксазол, при грибковой этиологии — флуконазол.
Выбор антибиотиков при терапии пневмоний у новорожденных детей
Форма пневмонии |
Этиология |
Антибиотики |
|
Выбора |
Альтернативные |
||
Врожденная |
Стрептококк группы В, кишечная палочка, клебсиелла, листерии, стафилококк |
Ампициплин + аминогликозид; амоксициллин/ клавуланат + аминогликозид; ампициллин/ сульбактам + аминогликозид |
Цефотаксим + аминогликозид
|
Поздняя ВП |
Синегнойная палочка, энтеробактерии, стафилококк |
Цефтазидим + аминогликозид; цефоперазон + аминогликозид; антисинегнойный пенициллин + аминогликозид |
|
Антибактериальная терапия внебольничной пневмони
Возраст, форма |
Этиология |
Антибиотики |
||||
Выбора |
Альтернативные |
|||||
1-6 мес, типичная (фебрильная температура тела, инфильтративная тень на рентгенограмме)
|
Вирусы E.coli, Enterbacteriaceae, S.aureus S.pneumoniae, H.influenzae
|
Парентерально: амоксициллин/ клавуланат, ампициллин/ сульбактам. Внутрь: амоксициллин/ клавуланат
|
Парентерально: цефазолин, цефуроксим, цефтриаксон, цефотаксим, линкомицин, карбопенемы*. Все препараты могут назначаться в комбинации с аминогликозидами
|
|||
1-6 мес, атипичная (афебрильная с диффузным процессом на рентгенограмме)
|
Вирусы, C.trachornatis
|
Внутрь: современный макролид
|
Внутрь: эритромицин
|
|||
6 мес-6 лет, типичная, неосложненная (с гомогенной тенью на рентгенограмме)
|
Вирусы S.pneumoniae, H.influenzae
|
Внутрь: амоксициллин и/или современный макролид
|
Внутрь: амоксициллин/ клавуланат, цефуроксим, бензатин феноксиметилпенициллин, эритромицин. Парентерально: ампициллин, цефуроксим, цефотаксим, цефтриаксон, цефоперазон
|
|||
6-15 лет, типичная, неосложненная (с гомогенной тенью на рентгенограмме)
|
S.pneumoniae |
Внутрь: амоксициллин или/и современный макролид |
Внутрь: амоксициллин/ клавуланат, цефуроксим, бензатин феноксиметилпенициллин. Парентерально: пенициллин, линкомицин, цефуроксим, цефотаксим, цефтриаксон, цефоперазон |
|||
6-15 лет, атипичная, неосложненная (с гомогенной тенью на рентгенограмме) |
C.pneumoniae, M.pneumoniae |
Внутрь: современный макролид
|
Внутрь: эритромицин, доксициклин (дети старше 12 лет)
|
|||
6 мес-15 лет, осложненная плевритом или деструкцией
|
S.pneumoniae, H.influenzae, Enterobacteriaceae
|
Парентерально: амоксициллин/ клавуланат или ампициллин/ сульбактам |
Парентерально: цефалоспорины II-IV поколений (цефуроксим, цефотаксим, цефтриаксон, цефоперазон, цефипим), цефазолин + аминогликозид, линкомицин + аминогликозид, карбопенем
|
|||
Внебольничные пневмонии. Эмпирический выбор антибиотика при лечении внебольничных пневмоний представлен в табл. Приведенные в графе "Антибиотики выбора" препараты обладают примерно одинаковой эффективностью. Выбор между ними основывается на материальных возможностях.
При неосложненных пневмониях, особенно в амбулаторных условиях, предпочтительно введение антибиотиков внутрь.
Если терапия была начата с парентерального введения препаратов, то по достижении эффекта следует перейти на пероральное введение антибиотика (ступенчатая терапия).
Не доказана эффективность одновременного назначения противогрибковых препаратов (нистатин, леворин), антигистаминных препаратов.
Лечение детей первых 6 мес жизни при типичных формах проводится, как правило, в условиях стационара с использованием парентерального введения антибиотиков. При типичных пневмониях назначают амоксициллин/клавуланат, ампициллин/сульбактам, ампициллин парентерально. Альтернативными антибиотиками являются цефалоспорины II и III поколений или цефазолин в комбинации с аминогликозидами. Препаратами выбора при атипичных формах являются современные макролиды.
При анаэробной инфекции эффективны ингибиторозащищенные пенициллины, линкомицин, клиндамицин, метронидазол, карбопенемы (меропенем разрешен к применению у детей в возрасте от 3 мес), при пневмоцистной инфекции — котримоксазол.
У детей в возрасте от 6 мес до 6 лет лечение нетяжелых, неосложнённых пневмоний проводится амбулаторно с назначением пероральных препаратов. Антибиотиками первого выбора являются амоксициллин и макролиды, альтернативными - амоксициллин/клавуланат, цефуроксим аксетил.
У детей со склонностью к аллергическим реакциям предпочтительно назначать современные макролиды.
У детей в возрасте от 6 до 15 лет нетяжелые пневмонии лечатся в основном на дому с использованием пероральных препаратов. При типичной форме показаны амоксициллин, современные макролиды и др. При атипичной пневмонии лечение целесообразно начинать с макролидов.
Тяжелые формы пневмоний у детей всех возрастов, как правило, являются показанием к госпитализации. В стационаре желательно проводить ступенчатую терапию. Предпочтительны ингибиторозащищенные пенициллины, цефалоспорины II-II1 поколений. При необходимости, для расширения спектра активности можно сочетать бета-лактамные антибиотики (пенициллины, цефалоспорины, карбопенемы) с макролидами, а при грамотрицательной этиологии — с аминогликозидами.
Нозокомиальные пневмонии. В педиатрическом стационаре прослеживается достаточно четкая зависимость вида возбудителя и его чувствительности от предшествующей терапии. Замена на альтернативный препарат проводится на основании бактериологических данных или эмпирически при отсутствии эффекта от препарата первого выбора в течение 56 — 48 ч. При тяжелых формах обязательно внутривенное введение прспаратов.
В избранных случаях при инфекциях, вызванных грамотрицательной микрофлорой, и при отсутствии альтернативы могут быть использованы препараты из группы фторхинолонов (ципрофлоксацин, офлоксацин). При анаэробном характере инфекции применяются ингибиторозащищенные пенициллины, метронидазол, линкосамиды, карбопенемы. При грибковой этиологии назначают противогрибковые препараты.
Стартовая терапия при внутрибольничной пневмонии
Терапия до пневмонии |
Рекомендуемые препараты |
Не проводилась |
Перентерально: пенициллин, ампициллин .Внутрь: макролид
|
Пенициллин, ампициллин |
В/м, в/в: оксациллин, линкомицин, цефазолин. Внутрь: амоксициллин-клавуланат, макролид
|
Макролид |
Внутрь, в/м, в/в: оксациллин, линкомицин, цефазолин
|
Цефалоспорин-1, оксациллин, линкомицин |
Перентерально: аугметин, цефалоспорин 2-3, аминогликозид, ванкомицин, комбинации препаратов
|
Аминогликозид |
Перентерально: пенициллин, ампициллин, при отсутствии эффекта: уреидопенициллины, рифампицин, карбопенем, ванкомицин, аминогликозид в высоких дозах
|
Аминогликозид+цефалоспорин 2-3 |
Перентерально: карбопенем, уреидопенициллины, рифампицин, ванкомицин, азтреонам, тиментин, аминогликозид в высоких дозах
|
Вентиляционные пневмонии. При ранних ВП (без предшествующей антибиотикотерапии) назначают ингибиторозащищенные пенициллины (амоксициллин/клавуланат, ампициллин/сульбактам, тикарциллин/клавуланат) или цефуроксим. Цефалоспорины III поколения и аминогликозиды являются альтернативными препаратами. При выборе антибиотика учитывается предшествующая терапия.
Если проведение ИВЛ начато с 3-4-х суток пребывания в стационаре, выбор антибиотика определяется алгоритмом его назначения при нозокомиальных пневмониях (см. выше).
При поздних ВП назначают ингибиторозащищенные антисинегнойные пенициллины (тикарциллин/клавуланат, пиперациллин/тазобактам) или цефалоспорины 11I-IV поколений с антисинегнойной активностью (цефтазидим, цефоперазон, цефопим) с аминогликозидами (нетилмицин, амикацин). Альтернативными препаратами являются карбопенемы (имипенем, меропенем).
Пневмонии детей с иммунодефицитом. Данная группа пациентов требует обеспечения гнотобиологических условий на пике иммунодепрессии, а также проведения профилактической антибактериальной терапии. Кроме того, целесообразен постоянный мониторинг микрофлоры, который позволяет проводить этиотропное лечение.
Для эмпирической терапии у лиц с бактериальной природой пневмонии используют цефалоспорины III—IV поколений или ванкомицин в сочетании с аминогликозидами (нетилмицин, амикацин). При пневмоцистной этиологии пневмонии применяется ко-тримоксазол в высоких дозах, при грибковой инфекции — противогрибковые препараты (флуконазол, амфотерицин В), герпетической инфекции - ацикловир, при цитомегаловирусной инфекции - ганцикловир. Длительность терапии составляет не менее 3 нед, при протозойной и грибковой пневмониях — 4—6 нед и более.
Критерии эффективности антибиотиков. Залогом успеха антибактериальной терапии пневмоний является четкая регистрация эффекта и смена препарата в случае его отсутствия.
Полный эффект: падение температуры тела ниже 37,5"С через 24-48 ч при неосложнённой и через 3-4 сут при осложненной пневмонии на фоне улучшения общего состояния и аппетита, уменьшения одышки. В эти сроки рентгенологические изменения не нарастают или уменьшаются.
Частичный эффект: сохранение фебрильной температуры тела после указанных выше сроков при уменьшении выраженности токсикоза, одышки, улучшении аппетита и отсутствии отрицательной рентгенологической динамики. Наблюдается обычно при деструктивных пневмониях и/или при ме-тапневмоническом плеврите. Смены антибиотика не требует.
Отсутствие эффекта: сохранение лихорадки при ухудшении общего состояния и/или нарастании патологических изменений в легких или плевральной полости (увеличение объема выпота и его цитоза). При хламидиозе, пневмоцистозе отмечается нарастание одышки и гипоксемии. Отсутствие эффекта требует смены антибиотика.
БРОНХИАЛЬНАЯ АСТМА У ДЕТЕЙ
Бронхиальная астма - это хроническое аллергическое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, приводящей к повторным эпизодам свистящих хрипов, одышке, чувству заложенности в груди и кашлю, особенно по ночам или ранним утром. Во время этих эпизодов обычно отмечается диффузная, вариабельная бронхиальная обструкция, обратимая спонтанно или под действием лечения.
Более высокая распространенность БА у детей характерна для экологически неблагополучных промышленных районов городов. У жителей города чаще регистрируют БА, чем у жителей села (7,1 и 5,7% соответственно). В исследованиях, выполненных в разных странах, показана большая распространенность БА в регионах с влажным и теплым климатом и меньшая частота болезни в высокогорных районах, что связано с различным уровнем насыщенности воздуха аэроаллергенами. Несмотря на множество существующих гипотез, ни одна из них не объясняет в полной мере рост БА и аллергических заболеваний во всем мире.
ЭТИОЛОГИЯ БРОНХИАЛЬНОЙ АСТМЫ
Развитие бронхиальной астмы тесно связано с комплексом генетических и внешнесредовых (экологических) факторов. У подавляющего большинства больных детей бронхиальная астма атопическая. Однако помимо этиологического (сенсибилизирующего) воздействия антигенов на организм ребенка в развитии бронхиальной астмы большое значение имеют предрасполагающие факторы, факторы, усугубляющие действия причинных факторов и триггерные воздействия, вызывающие обострение заболевания. Факторы риска возникновения бронхиальной астмы у детей предложено РГ «БАД» классифицировать следующим образом:
Факторы риска возникновения бронхиальной астмы у детей
Факторы, предрасполагающие к развитию бронхиальной астмы:
- атопия;
- гиперреактивность бронхов;
- наследственность.
Причинные (сенсибилизирующие) факторы:
- пищевые аллергены;
- бытовые аллергены (домашняя пыль, клещи домашней пыли);
- эпидермальные аллергены животных, птиц, аллергены тараканов и дру-гих насекомых;
- грибковые аллергены;
- пыльцевые аллергены;
- лекарственные средства;
- вирусы и вакцины;
- химические вещества.
Факторы, способствующие возникновению бронхиальной астмы, усугубляющие действие причинных факторов:
- вирусные респираторные инфекции;
- патологическое течение беременности у матери ребенка;
- недоношенность;
- нерациональное питание;
- атопический дерматит;
- поллютанты;
- табачный дым.
Факторы, вызывающие обострение бронхиальной астмы (триггеры):
- аллергены;
- вирусные респираторные инфекции;
- физическая нагрузка;
- психоэмоциональная нагрузка;
- изменение метеоситуации;
- загрязнения воздуха (ксенобиотики, табачный дым, резкие запахи);
- непереносимые продукты, лекарства, вакцины.
ПАТОГЕНЕЗ
Механизм развития бронхиальной астмы сложен. Основными моментами в патогенезе являются аллергические реакции и нарушения нейрогуморальной регуляции на фоне предрасположенности к развитию бронхиальной астмы.
Основными факторами, лежащими в основе предрасположенности к развитию бронхиальной астмы, являются атопия и гиперреактивность бронхов.
Атопия определяется как способность организма к выработке повышенного количества IgE в ответ на воздействие аллергенов окружающей среды и регистрируется у 80-90% больных детей. Гиперреактивность бронхов – это состояние, выражающееся в повышенной реакции бронхов на раздражитель, при котором развивается бронхиальная обструкция в ответ на воздействие, не вызывающее такой реакции у большинства здоровых лиц.
В развитии приступа бронхиальной астмы выделяются 3 стадии аллергического процесса.
Иммунологическая стадия – взаимодействие специфического антигена с антителом или специализированным Т-лимфоцитом на территории клеток шокового органа. В результате этой реакции происходит активация тканевых и сывороточных ферментов.
Патохимическая стадия – при распознавании фиксированными на тучной клетке антителами поступающего аллергена происходит агрегация IgE и перекрестное реагирование двух или более FcεRI, что приводит к активации тучной клетки (базофила) и ее дегрануляции (секреции депонированных в гранулах – преформированных и вновь образующихся биологически активных веществ – медиаторов аллергии).
Патофизиологическая стадия обусловлена повреждающим действием биологически активных веществ и нарушением функции систем организма (отек, спазм бронхов, гиперсекреция железистого аппарата бронхов). В реализации аллергических реакций при бронхиальной астме важную роль играют ионы кальция.
Морфологической основой бронхиальной гиперреактивности при бронхиальной астме является аллергическое хроническое воспаление стенки бронхиального дерева. Воспалительный процесс затрагивает все ее структуры: эпителий, базальную мембрану, бронхассоциированную лимфоидную ткань, сосуды, гладкие мышцы. Просвет дыхательных путей выполнен десквамированным эпителием, эозинофилами и бронхиальным секретом. Десквамация эпителиальных клеток происходит под действием протеинов, синтезируемых гранулами эозинофилов, и их освобождение наступает при дегрануляции последних. Базальная мембрана сильно изменена: отечна, утолщена на всем протяжении, основное вещество дезорганизовано. Серозные и бокаловидные клетки дезорганизованы, количество бокаловидных клеток увеличено. Сосудистая проницаемость венул и капилляров стенки бронхов повышена. Описанная морфологическая картина специфична для бронхиальной астмы и сохраняется у больных бронхиальной астмой и в стадии ремиссии. Это свидетельствует о персистирующем характере воспалительного процесса при бронхиальной астме.
КЛАССИФИКАЦИЯ
По этиологии
Аллергическая
Ig-Е опосредованная (атопическая)
Не Ig-Е опосредованная
Неаллергическая
По тяжести
Интермиттирующая
Лёгкая персистирующая
Среднетяжёлая персистирующая
Тяжёлая персистирующая
По уровню контроля
Контролируемая
Частично контролируемая
Неконтролируемая
По периоду
Обострение
Ремиссия
I. Клинико-функциональные критерии диагноза БА. Для каждой степени тяжести заболевания характерны определенные изменения клинико-функциональных параметров. Важным является то, что наличие хотя бы одного признака, соответствующего более высокой степени тяжести (чем остальные признаки) позволяет определить ребенка в данную категорию. Стоит отметить, что использовать критерии, приведенные в таблице 1, для верификации степени тяжести астмы следует лишь в тех случаях, если пациент никогда не получал противовоспалительной терапии или использовал противоастматические препараты более месяца назад. Такой подход к оценке тяжести болезни используется только для решения вопроса о стартовой терапии.
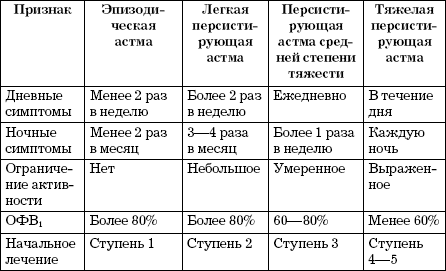
Таблица 1. Классификация БА по степени тяжести [GINA, 2006]
Характеристики |
Степень тяжести |
|||
Интермиттирующая |
Персистирующая |
|||
Легкая |
Легкая |
Средней степени |
Тяжелая |
|
Дневные симптомы |
< 1 раза в неделю |
> 1 раза в неделю, но < 1 раза в день |
Ежедневно |
Ежедневно |
Ночные симптомы |
< 2 раз в месяц |
> 2 раз в месяц |
> 1 раза в неделю |
Частые симптомы |
Обострения |
Кратковременные |
Нарушают активность и сон |
Нарушают активность и сон |
Частые обострения |
ОФВ1 или ПСВ (от должного) |
≥ 80% |
≥ 80% |
60-80% |
≤ 60% |
Вариабельность ПСВ или ОФВ1 |
< 20% |
≤ 30% |
> 30% |
> 30% |
Классификация по тяжести течения с учетом начальной терапии
После начала лечения состояние оценивают по тем же признакам, что и до начала лечения, но с учетом ступени начального лечения[61] (табл. 4).
Таблица 4
Всем детям старше 5 лет с рецидивирующими свистящими хрипами в качестве скрининга необходимо проводить:
- спирометрию;
- пробы с бронхолитиком;
- пикфлоуметрию с ведением дневника самоконтроля.
II. Определение уровня контроля над БА в зависимости от ответа на терапию. Несмотря на первостепенное значение (для определения степени тяжести БА) клинико-функциональных параметров, а также объема терапии, приведенная классификация заболевания не отражает реакцию организма на проводимое лечение. Так, пациент может обратиться к врачу с симптомами астмы, соответствующими средней степени тяжести, в результате ему будет поставлен диагноз среднетяжелой персистирующей БА. Однако в случае недостаточного объема фармакотерапии в течение некоторого времени клинические проявления заболевания будут соответствовать тяжелой персистирующей БА. С учетом данного положения для принятия решения об изменении объема текущей терапии экспертами GINA предложено выделять не только степень тяжести, но и уровень контроля заболевания (табл. 2).
Таблица 2. Уровни контроля над БА [GINA, 2006]
Характеристики |
Контролируемая БА (все перечисленное) |
Частично контролируемая БА (наличие любого проявления в течение недели) |
Неконтролируемая БА |
Дневные симптомы |
Нет (≤ 2 эпизодов в неделю) |
> 2 раз в неделю |
Наличие 3 или более признаков частично контролируемой БА в течение любой недели |
Ограничение активности |
Нет |
Есть - любой выраженности |
|
Ночные симптомы/ пробуждения |
Нет |
Есть - любой выраженности |
|
Потребность в препаратах неотложной помощи |
Нет(≤ 2 эпизодов в неделю) |
> 2 раз в неделю |
|
Показатели функции легких (ПСВ или ОФВ1)(1) |
Норма |
< 80% от должного (или от наилучшего показателя для данного пациента) |
|
Обострения |
Нет |
1 или более раз в год(2) |
Еженедельно(3) |
1 Исследование функции легких не является надежным методом исследования у детей 5 лет и младше. Периодическая оценка уровня контроля над БА, в соответствии с критериями, указанными в таблице 2, позволит индивидуально подбирать пациенту режим фармакотерапии.
2 Каждое обострение требует немедленного пересмотра поддерживающей терапии и оценки ее адекватности.
3 По определению, развитие любого обострения говорит о том, что БА не контролируется.
III. Диагноз аллергической и неаллергической БА у детей. Аллергический вариант БА определяется при наличии сенсибилизации к внешнесредовым аллергенам и сопровождается повышенным уровнем сывороточного IgE. При неаллергическом варианте сенсибилизация в ходе обследования не выявляется, имеет место низкий уровень сывороточного IgE. В последнем случае заболевание развивается, как правило, в более позднем возрасте, чем когда имеет место аллергический вариант (неаллергический вариант не характерен для детей).
Предлагается выделять аллергическое IgE-опосредованное и аллергическое не IgE-опосредованное заболевание. У большинства пациентов аллергическая реакция связана с IgE-антителами, то есть у них имеет место IgE-опосредованная аллергия, или атопия. Атопия определяется как способность организма к выработке повышенного количества IgE в ответ на воздействие аллергенов окружающей среды и выявляется по возрастанию уровня общего или специфического IgE в сыворотке, положительным результатам кожного прик-теста со стандартизированными аллергенами. В типичных случаях атопии доза ингаляционного аллергена, необходимая для появления сенсибилизации и симптомов, чрезвычайно мала. У некоторых людей, которые не могут быть охарактеризованы как атопики и не имеют сенсибилизации (в раннем возрасте) на распространенные аллергены, позднее наступает развитие IgE-опосредованной аллергии при экспозиции высоких доз аллергенов, часто в сочетании с адъювантами, такими как табачный дым. В этой связи термин "аллергическая астма" является более широким по сравнению с термином "атопическая астма".
IV. Классификация в зависимости от периода болезни.
Обострение - это эпизоды нарастающей одышки, кашля, свистящих хрипов или заложенности в грудной клетке, или какой-либо комбинации перечисленных симптомов. Стоит отметить, что наличие симптомов у пациентов с астмой, в соответствии с критериями, приведенными в таблицах 1 и 2, является проявлением заболевания, а не обострением. Так, например, если пациент имеет ежедневные дневные симптомы, два ночных симптома в неделю и ОФВ1 = 80%, врач констатирует факт наличия у больного БА средней степени тяжести, поскольку все перечисленное является критериями этой формы заболевания (а не обострения). В том случае, когда у пациента к имеющимся симптомам добавляется дополнительная (сверх имеющейся) потребность в бронхолитиках короткого действия, увеличивается количество дневных и ночных симптомов, появляется выраженная одышка, -констатируется обострение БА, которое также необходимо классифицировать по степени тяжести (см. раздел - "Определение степени тяжести обострений").
Контроль - это устранение проявлений заболевания на фоне текущей базисной противовоспалительной терапии БА. Полный контроль (контролируемая астма) сегодня определен экспертами GINA как основная цель лечения астмы.
Ремиссия - это полное отсутствие симптомов болезни на фоне отмены базисной противовоспалительной терапии. Так, например, назначение соответствующего степени тяжести астмы фармакотерапевтического режима в течение некоторого времени приводит к уменьшению (а возможно, и к полному отсутствию) клинических проявлений болезни и восстановлению функциональных параметров легких. Такое состояние необходимо воспринимать как контроль над заболеванием. В случае же, если функция легких остается неизмененной, а симптомов БА нет и после отмены терапии, следует констатировать ремиссию. Необходимо отметить, что у детей в пубертатном периоде иногда регистрируется спонтанная ремиссия заболевания. Примеры диагноза:
Бронхиальная астма, аллергическая (атопическая), средней степени, персистирующая, частично контролируемая (J 45.0).
Бронхиальная астма, атопическая, средней степени, персистирующая, обострение средней степени тяжести (J 45.0).
Бронхиальная астма, неаллергическая, тяжелая, персистирующая, контролируемая (J 45.1).
ДИАГНОСТИКА
Анамнез и физикальное обследование
Вероятность БА возрастает, если в анамнезе есть указания на:
- атопический дерматит;
- аллергический риноконъюнктивит;
- отягощенный семейный анамнез по БА или другим атопическим заболеваниям.
Диагноз БА часто можно предположить на основании следующих симптомов:
- эпизоды одышки;
- свистящие хрипы;
- кашель, усиливающийся преимущественно в ночные или предутренние часы;
- заложенность в грудной клетке.
- астматический статус:
тяжёлый, некупируемый более 8 часов приступ бронхиальной обструкции;
резистентность к бета2-агонистам;
нарушение дренажной функции бронхов;
гипоксемия и гиперкапния;
Появление или усиление симптомов:
- после эпизодов контакта с аллергенами (при контакте с животными, клещами домашней пыли, пыльцевыми аллергенами);
- в ночные и предутренние часы;
- при контакте с триггерами (химическими аэрозолями, табачным дымом, резкими запахами);
- при перепадах температуры окружающей среды;
- при любых острых инфекционных заболеваниях дыхательных путей;
- при сильных эмоциональных нагрузках;
- при физической нагрузке (пациенты отмечают типичные симптомы БА или иногда длительный кашель, обычно развивающийся через 5-10 минут после прекращения нагрузки (редко -во время нагрузки), который самостоятельно проходит в течение 30-45 минут).
При осмотре необходимо обратить внимание на следующие признаки, характерные для БА:
- одышка;
- эмфизематозная форма грудной клетки;
- вынужденная поза;
- дистанционные хрипы.
При перкуссии возможен коробочный перкуторный звук.
При аускультации могут определяться:
- удлинение выдоха или свистящие хрипы. Следует учитывать, что в периоде ремиссии проявления болезни могут отсутствовать, что не исключает диагноза БА. У детей в возрасте до 5 лет диагноз БА основывается главным образом на данных анамнеза и результатах клинического (но не функционального) обследования. У детей грудного возраста, имевших 3 и более эпизодов свистящих хрипов, связанных с действием триггеров, при наличии атопического дерматита и/или аллергического ринита, эозинофилии в крови следует подозревать БА, проводить обследование и дифференциальную диагностику.
Лабораторные и инструментальные исследования
Спирометрия. У детей старше 5 лет необходимо проводить оценку функции внешнего дыхания. Спирометрия позволяет оценить степень обструкции, ее обратимость и вариабельность, а также тяжесть течения заболевания. Однако спирометрия позволяет оценивать состояние ребенка только на момент осмотра. При оценке показателей ОФВ1 и ФЖЕЛ важно учитывать этнические особенности и возрастные градации.
Таким образом, оценивают следующие показатели:
объем форсированного выдоха за первую секунду (ОФВ1);
форсированную жизненную емкость легких (ФЖЕЛ);
отношение ОФВ1/ФЖЕЛ;
обратимость бронхиальной обструкции - увеличение ОФВ1 по крайней мере, на 12% (и 200 мл) после ингаляции сальбутамола либо в ответ на пробную терапию ГКС.
Пикфлоуметрия. Определение ПСВ - важный метод диагностики и последующего контроля за лечением БА. Последние модели пикфлоуметров относительно недороги, портативны, выполнены из пластика и идеально подходят для использования пациентами старше 5 лет в домашних условиях. При анализе показателей ПСВ у детей используют специальные номограммы, но более информативен ежедневный мониторинг ПСВ в течение 2-3 недель для определения индивидуального наилучшего показателя. ПСВ измеряют утром (обычно наиболее низкий показатель) и вечером перед сном (как правило, наиболее высокий показатель). Заполнение больным дневников самоконтроля с ежедневной регистрацией в нем симптомов, результатов ПСВ и лечения играет важную роль в стратегии лечения БА. Мониторинг ПСВ может быть информативен для определения ранних симптомов обострения заболевания. Дневной разброс показателей ПСВ более чем на 20% рассматривается как диагностический признак БА, а величина отклонений прямо пропорциональна тяжести заболевания. Результаты пикфлоуметрии свидетельствуют в пользу диагноза БА, если ПСВ увеличивается по крайней мере на 15% после ингаляции бронхолитика или при пробном назначении ГКС.
Таким образом, важно оценить:
- суточную вариабельность ПСВ (разность между максимальным и минимальным значениями в течение дня, выраженную в процентах от средней за день ПСВ и усредненную за 1-2 недели);
- минимальное значение ПСВ за неделю (измеряемой утром до приема бронхолитика) в процентах от самого лучшего в этот же период показателя (Min/Max).
Выявление гиперреактивности дыхательных путей. У пациентов c симптомами, характерными для БА, но с нормальными показателями функции легких в постановке диагноза БА может помочь исследование реакции дыхательных путей на физическую нагрузку. В исследовательских целях для выявления бронхиальной гиперреактивности можно использовать тест с метахолином или гистамином. Эти тесты в педиатрии назначаются крайне редко (в основном у подростков), с большой осторожностью, по особым показаниям. При диагностике БА эти тесты имеют высокую чувствительность, но низкую специфичность.
У некоторых детей симптомы БА провоцирует только физическая нагрузка. В этой группе полезно проведение нагрузочного теста (6-минутный протокол нагрузки бегом). Использование этого метода исследования совместно с определением ОФВ1 или ПСВ может быть полезно для постановки точного диагноза БА.
Специфическая аллергологическая диагностика проводится врачами аллергологами/имунологами в специализированных учреждениях (отделениях/кабинетах). Аллергологическое обследование является обязательным для всех больных с БА и включает: сбор аллергологического анамнеза, проведение кожного тестирования, определение уровня общего IgE (и специфических IgE-АТ в случаях, когда невозможно проведение кожных проб).
Кожные тесты с аллергенами и определение уровней специфических IgE в сыворотке крови помогают выявить аллергический характер заболевания, установить причинно-значимые аллергены, на основании чего может быть рекомендован соответствующий элиминационный режим и разработаны схемы специфической иммунотерапии.
Неинвазивное определение маркеров воспаления дыхательных путей (дополнительные диагностические методы):
- исследование спонтанно продуцируемой или индуцированной ингаляцией гипертонического раствора мокроты на клетки воспаления - эозинофилы или нейтрофилы;
- определение уровня оксида азота (NO) и окиси углерода (FeCO) в выдыхаемом воздухе.
ОПРЕДЕЛЕНИЕ СТЕПЕНИ ТЯЖЕСТИ ОБОСТРЕНИЙ БА
Обострения БА классифицируются в соответствии с критериями, указанными в таблице 3.
Таблица 3. Определение тяжести обострений БА
Показатель |
Легкое обострение |
Среднетяжелое обострение |
Тяжелое обострение |
Остановка дыхания неизбежна |
Одышка |
При ходьбе Может лежать |
При разговоре. Плач тише и короче, трудности при кормлении. Предпочитает сидеть |
В покое. Прекращает принимать пищу. Сидит, наклоняясь вперед |
|
Речь |
Предложения |
Отдельные фразы |
Отдельные слова |
|
Уровень бодрствования |
Может быть возбужден |
Обычно возбужден |
Обычно возбужден |
Заторможен или в состоянии спутанного сознания |
ЧДД* |
Повышена |
Повышена |
Высокая (> 30/мин) |
Парадоксальное дыхание |
Участие вспомогательных мышц в акте дыхания, втяжение надключичных ямок |
Обычно нет |
Обычно есть |
Обычно есть |
Парадоксальные движения грудной клетки и брюшной стенки |
Свистящие хрипы |
Умеренные |
Громкие |
Обычно громкие |
Отсутствуют |
ЧСС* |
< 100/мин |
100-120/мин |
> 120/мин |
Брадикардия |
ПСВ |
> 80% |
60-80% |
< 60% |
|
PaO2 |
Обычно нет необходимости измерять |
> 60 мм рт.ст. |
< 60 мм рт.ст. |
|
PaCO2 |
< 45 мм рт.ст. |
< 45 мм рт.ст. |
> 45 мм рт.ст. |
|
SaO2 |
> 95% |
91-95% |
< 90% |
|
* Указаны показатели для детей школьного возраста и подростков, в каждом конкретном случае необходимо ориентироваться на возрастную норму.
Нормальная частота дыхания у детей: < 2 месяцев - < 60 в минуту; 2-12 месяцев - < 50 в минуту; 1-5 лет - < 40 в минуту; 6-8 лет -< 30 в минуту.
Нормальная частота пульса у детей: 2-12 месяцев - < 160 в минуту; 1-2 года - < 120 в минуту; 2-8 лет - < 110 в минуту.
Главной целью лечения больных бронхиальной астмой является достижение и длительное поддержание контроля над заболеванием. Лечение должно начинаться с оценки текущего контроля над астмой, а объем терапии – регулярно пересматриваться, чтобы обеспечить достижение этого контроля.
Лечение бронхиальной астмы (БА) включает:
Элиминационные мероприятия, направленные на уменьшение или исключение воздействия причинных аллергенов.
Фармакотерапию.
Аллерген-специфическую иммунотерапию (АСИТ).
Обучение больных.
ФАРМАКОТЕРАПИЯ
Для лечения БА у детей используют препараты, которые можно разделить на две большие группы:
Средства базисной (поддерживающей, противовоспалительной) терапии.
Симптоматические средства.
К препаратам базисной терапии относятся:
лекарственные средства (ЛС) с противовоспалительным и/или профилактическим эффектом (глюкокортикостероиды (ГКС), антилейкотриеновые препараты, кромоны, анти-IgE-препараты);
длительно действующие бронходилататоры (длительно действующие β2-адреномиметики, препараты теофиллина с медленным высвобождением).
Наибольшая клиническая и патогенетическая эффективность показана при использовании ингаляционных ГКС (ИГКС). Все средства базисной противовоспалительной терапии принимаются ежедневно и длительно. Принцип регулярности использования базисных препаратов позволяет достигать контроля над болезнью. Необходимо отметить, что в нашей стране для базисной терапии БА у детей с использованием комбинированных препаратов, содержащих ИГКС (с 12-часовым перерывом), зарегистрирован лишь режим стабильного дозирования. Другие схемы использования комбинированных препаратов у детей не разрешены.
К симптоматическим средствам относятся:
ингаляционные короткодействующие β2-адреномиметики;
антихолинергические препараты;
препараты теофиллина с немедленным высвобождением;
пероральные короткодействующие β2-адреномиметики.
Симптоматические препараты также называют средствами «скорой помощи». Их необходимо использовать для устранения бронхообструкции и сопутствующих ей острых симптомов (свистящие хрипы, чувство стеснения в груди, кашель). Данный режим применения лекарственных средств называется «по требованию».
ПРОТИВОВОСПАЛИТЕЛЬНЫЕ (БАЗИСНЫЕ) ПРЕПАРАТЫ
I. Ингаляционные глюкокортикостероиды и комбинированные средства, содержащие ИГКС
В настоящее время ИГКС являются самыми эффективными препаратами для контроля БА, поэтому их рекомендуют для лечения персистирующей БА любой степени тяжести
У детей применяют следующие ИГКС: беклометазон, флутиказон, будесонид. Дозы препаратов, используемых для базисной терапии, разделяют на низкие, средние и высокие. Прием ИГКС в низких дозах является безопасным, при назначении более высоких доз необходимо помнить о возможности развития побочных эффектов.
ИГКС входят в состав комбинированных препаратов для лечения БА. Такими препаратами являются Серетид (сальметерол + флутиказона пропионат) и Симбикорт (формотерол + будесонид). В большом количестве клинических исследований показано, что комбинация длительно действующих β2-адреномиметиков и ИГКС в низкой дозе более эффективна, чем увеличение дозы последнего.
II. Антагонисты лейкотриеновых рецепторов
Антилейкотриеновые препараты (зафирлукаст, монтелукаст) обеспечивают частичную защиту от бронхоспазма, вызванного физической нагрузкой, в течение нескольких часов после приема. Добавление антилейкотриеновых препаратов к лечению в случае недостаточной эффективности низких доз ИГКС обеспечивает умеренное клиническое улучшение, в том числе статистически значимое уменьшение частоты обострений.
III. Кромоны
Недокромил и кромоглициевая кислота менее эффективна, чем ИГКС, в отношении клинических симптомов, функции внешнего дыхания, БА физического усилия, гиперреактивности дыхательных путей. Длительная терапия кромоглициевой кислотой при БА у детей по эффективности не отличается значительно от плацебоА. Недокромил, назначенный перед физической нагрузкой, позволяет уменьшить тяжесть и продолжительность вызванной ею бронхоконстрикции. Кромоны противопоказаны при обострении БА, когда требуется интенсивная терапия бронхорасширяющими препаратами быстрого действия. Роль кромонов в базисной терапии БА у детей (особенно у дошкольников) ограничена, в связи с отсутствием доказательств их эффективности. Проведенный в 2000 году метаанализ не позволил сделать однозначный вывод об эффективности кромоглициевой кислоты как средства базисной терапии БА у детейB. Следует помнить, что препараты данной группы не могут быть использованы для стартовой терапии среднетяжелой и тяжелой астмы. Применение кромонов в качестве базисной терапии возможно у пациентов с полным контролем симптомов БА. Кромоны не следует сочетать с β2-агонистами длительного действия, так как применение данных препаратов без ИГКС повышает риск смерти от астмы.
IV. Анти-IgE-препараты
Это принципиально новый класс ЛС, используемых сегодня для улучшения контроля над тяжелой персистирующей атопической БА. Омализумаб – наиболее изученный, первый и единственный рекомендованный к применению у детей старше 12 лет препарат. Высокая стоимость лечения омализумабом, а также необходимость ежемесячных визитов к врачу для инъекционного введения препарата оправданны у больных, нуждающихся в повторных госпитализациях, экстренной медицинской помощи, применяющих высокие дозы ингаляционных и/или системных ГКС.
V. Метилксантины длительного действия
Теофиллин значительно более эффективен, чем плацебо, для контроля БА и улучшения функции легких даже в дозах ниже обычно рекомендуемого терапевтического диапазонаА. Однако применение теофиллинов для лечения БА у детей проблематично из-за возможности тяжелых быстро возникающих (сердечная аритмия, смерть) и отсроченных (нарушение поведения, проблемы в обучении) побочных эффектов. В связи с чем применение теофиллинов возможно только под строгим фармакодинамическим контролем.
VI. Длительно действующие β2-агонисты
Ингаляционные β2-адреномиметики длительного действия
Препараты этой группы эффективны для поддержания контроля БА. На постоянной основе их применяют только в комбинации с ИГКС и назначают только тогда, когда стандартные начальные дозы ИГКС не позволяют достичь контроля БА. Эффект этих препаратов сохраняется на протяжении 12 часов.
Препараты данной группы следует назначать только совместно с базисной терапией ИГКС, так как монотерапия β2-адреномиметиками длительного действия без ИГКС увеличивает вероятность смерти больных!
Пероральные β2-адреномиметики длительного действия
Препараты этой группы включают лекарственные формы сальбутамола длительного действия. Эти ЛС могут помочь в контроле ночных симптомов БА. Их можно использовать в дополнение к ИГКС, если последние в стандартных дозах не обеспечивают достаточного контроля ночных симптомов. Возможные побочные эффекты включают стимуляцию сердечно-сосудистой системы, тревогу и тремор. В нашей стране в педиатрии препараты данной группы используются редко.
VII. Антихолинергические препараты
Ингаляционные антихолинергические средства не рекомендованы для длительного применения (базисной терапии) у детей с БА.
VIII. Системные ГКС
Несмотря на то что системные ГКС эффективны в отношении БА, необходимо учитывать развитие нежелательных явлений при длительной терапии, таких как угнетение гипоталамо-гипофизарно-надпочечниковой системы, увеличение массы тела, стероидный диабет, катаракта, АГ, задержка роста, иммунносупрессия, остеопороз, психические расстройства. Учитывая риск побочных эффектов при длительном применении, пероральные ГКС следует использовать у детей с астмой только в случае развития тяжелых обострений, как на фоне вирусной инфекции, так и в ее отсутствие.
СРЕДСТВА НЕОТЛОЖНОЙ ТЕРАПИИ
Ингаляционные β2-адреномиметики быстрого действия (короткодействующие β2-агонисты) самые эффективные из существующих бронхолитиков, они являются препаратами выбора для лечения острого бронхоспазма. К данной группе препаратов относятся сальбутамол, фенотерол и тербуталин.
Антихолинергические средства имеют ограниченную роль в лечении БА у детей. В метаанализе исследований ипратропиума бромида в комбинации с β2-агонистами при обострении БА показано, что применение антихолинергического препарата сопровождается статистически значимым (хотя и умеренным) улучшением функции легких и снижением риска госпитализации.
Больные, у которых отсутствует эффект от проводимой спазмолитической терапии и нарастает тяжесть состояния, то есть констатируется астматический статус, переводятся в отделение интенсивной терапии и реанимации.
В стадии относительной компенсации (I стадия) проводят оксигенотерапию, регидратацию, которая необходима при развитии дегидратации вследствие увеличения частоты дыхания и уменьшения приема жидкости. Если ребенок пьет, можно проводить оральную регидратацию. Общий объем жидкости примерно в 1,5 раза выше суточной возрастной потребности. В качестве базисных растворов при проведении инфузионной терапии используются изотонический раствор натрия хлорида и 5 % раствор глюкозы в соотношении 1:1. Количество внутривенно вводимой жидкости у детей раннего возраста составляет 10-20 мл/кг, общий объем - 150-300 мл, скорость введения 12-14 капель /мин, длительность инфузии – 3-6 ч. Жидкостная нагрузка должна тщательно контролироваться, так как в астматическом статусе у больных отмечается повышенная секреция антидиуретического гормона.
Начинают или продолжают начатую эуфиллинотерапию. Нагрузочная и поддерживающая дозы соответствуют дозам, применяемым при тяжелом приступе бронхиальной астмы. При наличии возможности определяют концентрацию препарата в крови во избежание токсических эффектов. Теофиллин повышает сниженную во время астматического статуса чувствительность 2-адренорецепторов к катехоламинам в связи с тем, что одним из эффектов препарата является ингибирование фосфодиэстеразы, а следовательно, увеличение цАМФ в клетке. Повышение чувствительности 2-адренорецепторов на фоне эуфиллинотерапии делает возможным введение тербуталина или применение ингалиционных селективных адреномиметиков. Положительный эффект может отмечаться при применении аэрозоля атровента или беродуала.
Кислотно-основное состояние контролируется введением гидрокарбоната натрия 1,5-2 ммоль/кг каждые 6 ч при ph 7,3. При неэффективности проводимых мероприятий внутривенно вводят преднизолон по 2 мг/кг каждые 4-6 ч до улучшения состояния больного. Введение глюкокортикоидов также приводит к восстановлению чувствительности 2-адренорецепторов.
В стадии субкомпенсации (II стадия астматического статуса) должны осуществляться контроль газового состава крови, проводиться более интенсивная кислородотерапия и регидратационная терапия. В первый час рекомендуется внутривенное введение изотонического раствора натрия хлорида, далее 50-60 мл/кг/сут 5 % раствора глюкозы (добавляя на каждые 100 мл 2 ммоль калия и 3ммоль натрия) и 10-15 мл/кг/сут раствора глюкозы дополнительно для возмещения текущих потерь воды. Ребенка следует взвешивать каждые 6 ч для регулирования интенсивности водной нагрузки, так как при перегрузке больного жидкостью существует опасность развития отека легких, сердечной недостаточности и других осложнений.
Нагрузочную дозу эуфиллина (6 мг/кг) вводят за 15 мин (если больной в ближайшие 6 ч уже получал эуфиллин, то вводят половинную дозу препарата). Далее используют те же поддерживающие дозы, что и при тяжелом приступе и I стадии астматического статуса. Одновременно назначают преднизолон (2-3 мг/кг - ½ дозы внутривенно и ½ дозы внутримышечно), повторные введения могут быть каждые 6 ч.
III стадия астматического статуса является показанием для перевода больного на ИВЛ. В этой стадии может быть использована «пульс-терапия» стероидами – введение метилпреднизолона в разовой дозе 10-15 мг/кг, половина из которой вводится внутривенно, половина – внутримышечно.
Проводят коррекцию патологического ацидоза введением гидрокарбоната натрия. Имеются данные о положительном эффекте в этой стадии гемосорбции и плазмафереза, которые повышают чувствительность 2-адренорецепторов.
Таблица 4. Соответствие ступеней терапии клиническим характеристикам БА
Ступени терапии |
Клиническая характеристика пациентов |
Ступень 1 |
Кратковременные (до нескольких часов) симптомы БА в дневное время (кашель, свистящие хрипы, одышка, возникающие ≤ 2 раз в неделю или еще более редкие ночные симптомы). В межприступный период – отсутствуют проявления БА и ночные пробуждения, функция легких в пределах нормы. ПСВ ≥ 80% от должных значений |
Ступень 2 |
Симптомы БА чаще 1 раза в неделю, но реже 1 раза в день. Обострения могут нарушать активность пациентов и ночной сон. Ночные симптомы чаще 2 раз в месяц. Функциональные показатели внешнего дыхания в пределах возрастной нормы. В межприступный период – отсутствуют проявления БА и ночные пробуждения, переносимость физической нагрузки не снижена. ПСВ ≥ 80% от должных значений |
Ступень 3 |
Симптомы БА отмечаются ежедневно. Обострения нарушают физическую активность ребенка и ночной сон. Ночные симптомы чаще 1 раза в неделю. В межприступном периоде отмечаются эпизодические симптомы, сохраняются изменения функции внешнего дыхания. Переносимость физической нагрузки может быть снижена. ПСВ 60–80% от должных значений |
Ступень 4 |
Частое (несколько раз в неделю или ежедневно, по несколько раз в день) появление симптомов БА, частые ночные приступы удушья. Частые обострения заболевания (1 раз в 1–2 месяца). Ограничение физической активности и выраженные нарушения функции внешнего дыхания. В периоде ремиссии сохраняются клинико-функциональные проявления бронхиальной обструкции. ПСВ ≤ 60% от должных значений |
Ступень 5 |
Ежедневные дневные и ночные симптомы, по несколько раз в день. Выраженное ограничение физической активности. Выраженные нарушения функции легких. Частые обострения (1 раз в месяц и чаще). В периоде ремиссии сохраняются выраженные клинико-функциональные проявления бронхиальной обструкции. ПСВ < 60% от должных значений |
Ступени лечения бронхиальной астмы
Ступень 1, включающая применение препаратов для облегчения симптомов по потребности, предназначена только для пациентов, не получавших поддерживающей терапии. В случае более частого появления симптомов или эпизодического ухудшения состояния пациентам показана регулярная поддерживающая терапия (в дополнение к препаратам для облегчения симптомов по потребности.
Ступени 2–5 включают комбинацию препарата для облегчения симптомов (по потребности) с регулярной поддерживающей терапией. В качестве начальной поддерживающей терапии БА у больных любого возраста на ступени 2 рекомендуются ИГКС в низкой дозе. Альтернативными средствами являются ингаляционные антихолинергические препараты, пероральные β2-агонисты короткого действия или теофиллин короткого действия. Однако для этих препаратов характерно более медленное начало действия и более высокая частота побочных эффектов.
На ступени 3 рекомендуется назначать комбинацию ИГКС в низкой дозе с ингаляционным β2-агонистом длительного действия в виде фиксированной комбинации. Благодаря аддитивному эффекту комбинированной терапии пациентам обычно оказывается достаточно назначения низких доз ИГКС; увеличение дозы ИГКС требуется только пациентам, у которых контроль над БА не был достигнут через 3–4 месяца терапии. Показано, что β2-агонист длительного действия формотерол, для которого характерно быстрое начало действия при применении в виде монотерапии или в составе фиксированной комбинации с будесонидом, не менее эффективен для купирования острых проявлений БА, чем β2-агонисты короткого действия. Однако монотерапия формотеролом для облегчения симптомов не рекомендуется, и этот препарат должен всегда использоваться только вместе с ИГКС. У всех детей, а в особенности у детей в возрасте 5 лет и младше, комбинированная терапия изучена в меньшей степени, чем у взрослых. Однако в недавнем исследовании показано, что добавление β2-агониста длительного действия более эффективно, чем увеличение дозы ИГКС. Вторым вариантом терапии является увеличение доз ИГКС до средних доз. Больным любого возраста, получающим средние или высокие дозы ИГКС с помощью ДАИ, рекомендовано применение спейсера для улучшения доставки препарата в дыхательные пути, снижения риска орофарингеальных побочных эффектов и системной абсорбции препарата. Еще одним альтернативным вариантом терапии на ступени 3 является комбинация ИГКС в низкой дозе с антилейкотриеновым препаратом. Вместо антилейкотриенового препарата возможно назначение низкой дозы теофиллина замедленного высвобождения. Эти варианты терапии не исследовались у детей в возрасте 5 лет и младше.
Выбор препаратов на ступени 4 зависит от предшествующих назначений на ступенях 2 и 3. Однако порядок добавления дополнительных препаратов должен быть основан на доказательствах их сравнительной эффективности, полученных в клинических исследованиях. Больных, у которых не был достигнут контроль над БА на ступени 3, следует направлять (если есть возможность) к специалисту в области лечения БА с целью исключения альтернативных диагнозов и/или причин БА, трудно поддающейся терапии. Предпочтительным подходом к лечению на ступени 4 является использование комбинации ГКС в средней или высокой дозе с ингаляционным β2-агонистом длительного действия. Длительное применение ИГКС в высоких дозах сопровождается повышенным риском развития побочных эффектов.
Терапия ступени 5 требуется пациентам, у которых не достигнут эффект лечения на фоне применения высоких доз ИГКС в комбинации с β2-агонистами длительного действия и другими препаратами для поддерживающей терапии. Добавление перорального ГКС к другим препаратам для поддерживающей терапии может увеличивать эффект лечения, но сопровождается тяжелыми нежелательными явлениями. Больной должен быть предупрежден о риске развития побочных эффектов; также необходимо рассмотреть возможность всех других альтернатив терапии БА.
Схемы уменьшения объема базисной терапии БА
Если контроль над БА достигнут на фоне базисной терапии комбинацией ИГКС и β2-агониста длительного действия и поддерживается не менее 3 месяцев, можно начинать постепенное уменьшение ее объема: снижения дозы ИГКС не более чем на 50% в течение 3 месяцев при продолжении терапии β2-агонистом длительного действия. При сохранении полного контроля на фоне терапии низкими дозами ИГКС и β2-агонистом длительного действия 2 раза в сутки следует отменить последний и продолжать терапию ИГКС. Достижение контроля на фоне применения кромонов не требует редукции их дозы.
Другая схема уменьшения объема базисной терапии у больных, получающих ИГКС и β2-агонист длительного действия и, предполагает отмену последнего на первом этапе при продолжении монотерапией ИГКС в такой же дозе, какая содержалась в фиксированной комбинации. В последующем постепенно снижать дозу ИГКС не более чем на 50% в течение 3 месяцев при условии сохранения полного контроля над БА. Монотерапия β2-агонистом длительного действия без ИГКС недопустима, так как может сопровождаться увеличением риска смерти больных БА. Прекращение поддерживающей терапии возможно, если полный контроль над БА сохраняется при использовании минимальной дозы противовоспалительного препарата, отсутствии рецидива симптомов в течение одного годаD.
При уменьшении объема противовоспалительной терапии следует учитывать спектр чувствительности пациентов к аллергенам. Например, перед сезоном цветения у пациентов с БА и пыльцевой сенсибилизацией категорически нельзя уменьшать дозы применяемых базисных средств, напротив, объем противовоспалительной терапии на этот период следует увеличить!
Увеличение объема базисной терапии в ответ на утрату контроля над астмой
Объем терапии следует увеличивать при утрате контроля над БА (увеличении частоты и тяжести симптомов БА, потребности в ингаляции β2-агонистов в течение 1–2 дней, снижении показателей пикфлоуметрии или ухудшении переносимости физической нагрузки). Объем терапии БА регулируется в течение года в соответствии со спектром сенсибилизации причиннозначимых аллергенов. Для купирования у больных БА остро возникших нарушений бронхиальной проходимости используют сочетание бронхолитических (β2-агонисты, антихолинергические препараты, метилксантины) и ГКС препаратов. Предпочтение следует отдавать ингаляционным формам доставки, позволяющим достичь быстрого эффекта при минимальном общем воздействии на организм ребенка.
Имеющиеся рекомендации по уменьшению доз различных препаратов базисной терапии могут иметь достаточно высокий уровень доказательности (преимущественно B), но основываются на данных исследований, в которых оценивали только клинические показатели (симптомы, ОФВ1) и не определяли влияние уменьшенного объема терапии на активность воспаления и структурные изменения при астме. Таким образом, рекомендации по снижению объема терапии требуют проведения дальнейших исследований, направленных на оценку процессов, лежащих в основе заболевания, а не только клинических проявлений.
ОБУЧЕНИЕ ПАЦИЕНТА
Образование является необходимой составной частью комплексной программы лечения детей с БА, и подразумевает установление партнерства между пациентом, его семьей и медицинским работником.
Задачи образовательных программ:
информирование о необходимости элиминационных мероприятий;
обучение технике использования ЛС;
информирование об основах фармакотерапии;
обучение мониторингу симптомов заболевания, пикфлоуметрии (у детей старше 5 лет), ведению дневника самоконтроля;
составлению индивидуального плана действий при обострении.
ПРОГНОЗ
У детей с повторяющимися эпизодами свистящих хрипов на фоне ОРВИ, не имеющих признаков атопии и атопических заболеваний в семейном анамнезе, симптомы БА обычно исчезают в дошкольном возрасте и в дальнейшем не развиваются, хотя могут сохраняться минимальные изменения функции легких и бронхиальная гиперреактивность. При возникновении свистящих хрипов в раннем возрасте (до 2 лет) в отсутствие других проявлений семейной атопии вероятность того, что симптомы будут сохраняться и в более позднем возрасте, невелика. У детей раннего возраста с частыми эпизодами свистящих хрипов, БА в семейном анамнезе и проявлениями атопии, риск развития БА в возрасте 6 лет значительно увеличивается. Мужской пол является фактором риска для возникновения БА в препубертатном периоде, однако существует большая вероятность того, что по достижению взрослого возраста заболевание исчезнет. Женский пол является фактором риска персистирования БА во взрослом возрасте.
ПРОФИЛАКТИКА
Выделяют первичную, вторичную и третичную профилактику БА.
Первичная профилактика направлена на лиц группы риска и предусматривает предотвращение у них аллергической сенсибилизации (образование IgE-антител). Известно, что сенсибилизация может развиваться уже внутриутробно, во II триместре беременности. Нарушение барьерных функций плаценты ведет к поступлению в амниотическую жидкость аллергенов, даже небольших концентраций которых достаточно для развития у плода реагинового иммунного ответа. Поэтому профилактикой аллергии у плода в этом периоде является предупреждение патологического течения беременности.
Фактически единственным мероприятием, направленным на развитие толерантности в постнатальном периоде, является сохранение естественного вскармливания ребенка до 4-6 месяцев жизни. Следует обратить внимание, что эффект грудного вскармливания носит транзиторный и кратковременный характер. Среди мероприятий первичной профилактики является обоснованным исключение влияния табачного дыма, воздействие которого как в пренатальном, так и в постнатальном периодах способствует развитию заболеваний, сопровождающихся бронхиальной обструкцией.
Мероприятия вторичной профилактики ориентированы на детей, у которых при наличии сенсибилизации симптомы БА отсутствуют. Для этих детей характерны:
- отягощенный семейный анамнез в отношении БА и других аллергических заболеваний;
- наличие у ребенка других аллергических заболеваний (атопический дерматит, аллергический ринит);
- повышение уровня общего IgE в крови в сочетании с выявлением значимых количеств специфических IgE к коровьему молоку, куриному яйцу, аэроаллергенам.
В целях вторичной профилактики БА в этой группе риска предлагается превентивная терапии цетиризином. Так, в исследовании ЕТАС [Early Treatment of the Atopic Child, The UCB Institute of Allergy, 2001] показано, что назначение данного препарата в дозе 0,25 мг/кг в сутки в течение 18 месяцев детям из групп высокого риска с бытовой или пыльцевой сенсибилизацией приводит к снижению частоты бронхо-обструкции с 40 до 20%.
Целью третичной профилактики является улучшение контроля БА и уменьшение потребности в медикаментозной терапии путем устранения факторов риска неблагоприятного течения заболевания.
Большое значение имеет здоровый образ жизни, профилактика респираторных инфекций, санация лор-органов, рациональная организация быта с исключением активного и пассивного табакокурения, контактов с пылью, животными, птицами, устранению плесени, сырости, тараканов в жилом помещении. Необходима известная осторожность в применении лекарственных препаратов, особенно антибиотиков пенициллиновой группы, аспирина, и других НПВС у детей с атопией. Важным разделом третичной профилактики является регулярная базисная противовоспалительная терапия.
Элиминационный режим. Элиминация бытовых, эпидермальных и других причинных аллергенов является необходимым компонентом в достижении контроля БА и уменьшении частоты обострений. Согласно современным представлениям элиминационные мероприятия должны быть индивидуальными для каждого больного и содержать рекомендации по уменьшению воздействия клещей домашней пыли, аллергенов животных, тараканов, грибков и других неспецифических факторов.
Соблюдение элиминационного режима может способствовать уменьшению тяжести течения уже существующего заболевания.
БРОНХОЭКТАТИЧЕСКАЯ БОЛЕЗНЬ – приобретённое хроническое воспалительное заболевание бронхолёгочной системы, характеризующееся гнойно-воспалительным процессом в расширенных деформированных бронхах с инфильтративными и склеротическими изменениями в перибронхиальном пространстве.
Критерии диагностики
1. Анамнестические:
частые ОРВИ, перенесённые коклюш, корь, аспирации инородных тел, повторные пневмонии с локализацией процесса в одном определённом месте с затяжным течением, начавшиеся в раннем возрасте, перенесённые аспирационные и деструктивные пневмонии;
первичные иммунодефицитные состояния.
2. Клинические:
постоянный влажный кашель, усиливающийся в период обострения, с выделением мокроты, чаще после сна (характер мокроты меняется от тяжести и фазы процесса);
синдром хронической интоксикации: бледность, серость кожных покровов, сниженная толерантность к физическим нагрузкам, снижение аппетита и эмоционального тонуса;
синдром хронической лёгочно-сердечной недостаточности: цианоз носогубного треугольника, акроцианоз, одышка и тахикардия при физической нагрузке, уплощение ногтевых фаланг, «часовые стёкла», «барабанные палочки»;
деформация грудной клетки: уплощение на стороне поражения, асимметрия, западение отдельных участков или выбухание, возможно отставание в акте дыхания одной половины грудной клетки;
физикальные изменения характеризуются стабильностью:
а) перкуторно – укорочение звука или тимпанит над зоной поражения в лёгких;
б) аускультативно – изменение дыхания в зависимости от выраженности процесса (жёсткое, бронхиальное, иногда амфорическое, может быть ослабленное), стабильные разнообразные влажные хрипы, нередко и сухие хрипы, лучше выслушиваются при форсированном дыхании, кашле.
- рецидивы воспалительного процесса в патологически изменённых участках лёгких.
3. Инструментальные:
на рентгенограммах, сделанных в период ремиссии, усиленный деформированный лёгочный рисунок, утолщение стенок бронхов в одном или нескольких сегментах, уменьшение в объёме отдельных сегментов лёгких (пневмосклероз);
бронхоскопия, бронхография, КТ – необратимые расширения бронхов (цилиндрические или мешотчатые бронхоэктазы) с выраженными структурными изменениями их стенок и функциональной неполноценностью.
исследование функции внешнего дыхания: спирография – снижение резервных возможностей аппарата внешнего дыхания, стойкая ДН; пневмотахиметрия – нарушение бронхиальной проходимости.
4. Лабораторные:
общие анализы крови – картина зависит от периода и активности воспалительного процесса в лёгких, при обострении лейкоцитоз с нейтрофилёзом и палочкоядерным сдвигом, ускоренная СОЭ.
Лечение
Консервативное лечение хронической пневмонии является основным, хирургическое лечение имеет преимущество у небольшого числа больных.
Антибиотикотерапия
Основные показания: обострение болезни, а также ОРВИ для его профилактики. Основной путь введения антибиотиков - системный (внутрь, в/в, в/м). С учетом преобладающих возбудителей используются антибиотики пенициллинового и цефалоспоринового ряда, макролиды, левомицетин; всегда предпочтителен учет индивидуальной чувствительности возбудителя, тяжести процесса, переносимости препарата и его эффективности в прошлом. При обострении, особенно сопровождающемся гнойным эндобронхитом, лечение начинают с парентерального применения антибиотиков с переходом на пероральные препараты по улучшении процесса. Длительность курса составляет 2-3 недели, в тяжелых случаях больше.
При гнойном эндобронхите полезно внутрибронхиальное введение антибиотика при бронхоскопии (после промывания бронхов), в тяжелых случаях эту процедуру следует повторить.
Муколитическая терапия
Применяется широко и особенно показана в тех случаях, когда слизисто-гнойная или гнойная мокрота отходит с трудом. Наиболее активен ацетилцистеин, его применяют внутрь (гранулы АСС для приготовления раствора - детям в возрасте 6-14 лет по 100-200 мг 3 раза в сутки), реже в ингаляциях (10% раствор). Хорошим отхаркивающим действием обладает карбоцистеин (Мукопронт), он выпускается в капсулах и сиропе.
Муколитическим действием обладают амброксол (Лазолван, «Фервекс от кашля») и бромгексин (Бисольвон), эти препараты помимо этого стимулируют выработку сурфактанта. Удовлетворительный эффект дают соляно-щелочные ингаляции и ингаляции физраствора.
Лечение обструктивного синдрома
Проводится бронхорасширяющими препаратами по общим правилам лечения астмы. При аллергических проявлениях у больного используются противогистаминные препараты.
Лечебная бронхоскопия
Не является самостоятельным или приоритетным видом лечения хронической пневмонии. Ее следует применять при нарушении оттока мокроты и стойком сохранении гнойного эндобронхита Методика заключается в отсасывании мокроты из бронхов и их промывании физраствором или другими растворами с последующим местным введением антибиотиков. Обычно бывает достаточно 1-2 процедур.
Лечебная физкультура (ЛФК)
Позиционный дренаж и вибрационный массаж грудной клетки являются основными и высоко эффективными методами ЛФК. Дренаж проводится в положении Квинке (головой вниз с поднятой тазовой областью) в течение 5-10 минут, когда больной производит кашлевые движения. Это положение обеспечивает отток секрета из наиболее часто поражаемых базальных сегментов легких. Эффективность дренажа возрастает при применении вибромассажа и дыхательных упражнений, сочетающихся с ритмическим сжатием грудной клетки. Дренаж должен проводиться как в периоде обострения, так и в ремиссии. Детям с хронической пневмонией показаны занятия ЛФК в полном обоеме, а также контролируемые занятия спортом, что улучшает их физическую и умственную работоспособность.
Показания к хирургическому лечению
Показания следует определять с учетом высокой эффективности консервативной терапии и благоприятного течения заболевания в детском и подростковом возрасте. Хирургическое лечение наиболее показано больным с долевыми поражениями и стойким гнойным эндобронхитом, не поддающимся консервативному лечению. При тяжелых двусторонних процессах удаление наиболее пораженных сегментов уменьшает степень интоксикации и способствует физическому развитию ребенка.
Физиотерапия
Эффективность большинства используемых в России методов не изучалась по правилам терапевтического испытания, их использование - только в комплексе с другими лечебными средствами - не являются обязательными. При обострении хронической пневмонии применяют высокочастотную электротерапию (микроволны, индуктотермия). При замедленной ликвидации обострения применяют лекарственный электрофорез с кальцием, медью, йодом, а также грязевыми растворами. Применяется также бальнео- и грязелечение. Изучается эффективность лазеротерапии.
Санаторное лечение
Имеет целью закрепление результатов терапии обострения, предоперационную подготовку и реабилитацию после операции. Основными методами являются проведения ЛФК, подвижных игр, прогулок и спортивных упражнений.
Диспансерное наблюдение и профилактика
Поликлинический этап - наблюдение и лечение в периоде ремиссии, диагностика и лечение обострений на дому. Особое внимание уделяется режиму в детском саду и школе, ЛФК и постуральному дренажу. Занятия физкультурой в школе не противопоказаны, врач поликлиники осуществляет контроль за ними, руководствуясь способностью больного переносить нагрузки. Необходимо осуществлять санацию очагов хронического воспаления в рото- и носоглотке.
В своей работе врач должен руководствоваться рекомендациями пульмонологического центра (специализированного отделения), где больной должен состоять на диспансерном учете и периодически (2-4 раза в год) там осматриваться. При наличии районного (межполиклинического) детского пульмонолога, участковый врач должен работать в тесном взаимодействии с ним, проводя периодическую консультацию больного.
Профилактическими в отношении хронической пневмонии считаются меры, препятствующие переходу острых пневмоний в затяжные, а также весь комплекс профилактики острых пневмоний. Своевременная диагностика и удаление инородных тел бронхов, профилактика их аспирации, а также раннее распознавание и лечение ателектазов различного происхождения способны предотвратить развитие хронической пневмонии.
КОНСПЕКТ ЛЕКЦИИ ДЛЯ САМОПОДГОТОВКИ
СТУДЕНТОВ СПЕЦИАЛЬНОСТИ «СЕСТРИНСКОЕ ДЕЛО»
ПО СЕСТРИНСКОМУ ДЕЛУ В ПЕДИАТРИИ С КУРСОМ ЗДОРОВОГО РЕБЁНКА
ПО ТЕМЕ:
Анатомо-физиологические особенности системы органов кровообращения у детей. Методы исследования. Семиотика.
Проблемы пациента. Заболевания сердечно-сосудистой системы у детей. Причины, клинические проявления, методы диагностики, принципы лечения, диспансеризации, реабилитации. Проблемы пациента и сестринская помощь.
СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА
Основным кровообращением плода является хориальное, представленное сосудами пуповины. Хориальное (плацентарное) кровообращение начинает обеспечивать газообмен плода уже с конца 3-й — начала 4-й недели внутриутробного развития. Капиллярная сеть хориальных ворсинок плаценты сливается в главный ствол — пупочную вену, проходящую в составе пупочного канатика и несущую оксигенированную и богатую питательными веществами кровь. В теле плода пупочная вена направляется к печени и перед вхождением в печень через широкий и короткий венозный (аранциев) проток отдает существенную часть крови в нижнюю полую вену, а затем соединяется со сравнительно плохо развитой воротной веной. Таким образом, печень получает максимально оксигенированную кровь пупочной вены уже в некотором разведении с чисто венозной кровью воротной вены.
Пройдя через печень, эта кровь поступает в нижнюю полую вену по системе возвратных печеночных вен. Смешанная в нижней полой вене кровь поступает в правое предсердие. Сюда же поступает и чисто венозная кровь из верхней полой вены, оттекающая от краниальных областей тела. Вместе с тем строение этой части сердца плода таково, что здесь полного смешения двух потоков крови не происходит. Кровь из верхней полой вены направляется преимущественно через правое венозное отверстие в правый желудочек и легочную артерию, где раздваивается на два потока, один из которых (меньший) проходит через легкие, а другой (больший) через артериальный боталлов проток попадает в аорту и распределяется между нижними сегментами тела плода. Кровь, поступившая в правое предсердие из нижней полой вены, попадает преимущественно в широко зияющее овальное окно и затем в левое предсердие, где она смешивается с небольшим количеством венозной крови, прошедшей через легкие, и поступает в аорту до места впадения артериального протока, таким образом обеспечивая лучшую оксигенацию и трофику головного мозга, венечных сосудов и всей верхней половины тела. Кровь нисходящей аорты, отдавшая кислород, по пупочным артериям возвращается в капиллярную сеть хориальных ворсинок плаценты. Таким образом функционирует система кровообращения, представляющая собой замкнутый круг, обособленный от системы кровообращения матери, и действующая исключительно за счет сократительной способности сердца плода. Определенную помощь в осуществлении гемодинамики плода оказывают начинающиеся с 11 —12-й недели дыхательные движения. Возникающие при них периоды отрицательного давления в грудной полости при нерасправившихся легких способствуют поступлению крови из плаценты в правую половину сердца. Жизнеспособность плода зависит от снабжения его кислородом и выведения углекислоты через плаценту в материнский круг кровообращения.
Пупочная вена доносит оксигенированную кровь только до нижней полой и воротной вен. Все органы плода получают только смешанную кровь. Однако наилучшие условия оксигенации имеются в печени, головном мозге и верхних конечностях, худшие условия — в легких и нижней половине тела.
Частота сердечных сокращений человеческого эмбриона сравнительно низкая (15 — 35 в минуту). По мере формирования плацентарного кровообращения она увеличивается до 125—130 в минуту. При нормальном течении беременности этот ритм исключительно устойчив, но при патологии может резко замедляться или ускоряться. Это говорит о раннем созревании рефлекторных и гуморальных регулирующих воздействий на систему внутриутробного кровообращения. Раньше созревает симпатическая и несколько позже парасимпатическая иннервация сердца. Кровообращение плода является важнейшим механизмом его жизнеобеспечения, и поэтому контроль за деятельностью сердца имеет самое непосредственное практическое значение при наблюдении за течением беременности.
Кровообращение новорожденного
При рождении происходит перестройка кровообращения, которая носит исключительно острый характер.
Наиболее существенными моментами считаются следующие: 1) прекращение плацентарного кровообращения; 2) закрытие основных фетальных сосудистых коммуникаций (венозный и артериальный протоки, овальное окно); 3) переключение насосов правого и левого сердца из параллельно работающих в последовательно включенные; 4) включение в полном объеме сосудистого руста малого крута кровообращения с его высоким сопротивлением и склонностью к вазоконстрикции; 5) увеличение потребности в кислороде, рост сердечного выброса и системного сосудистого давления.
С началом легочного дыхания кровоток через легкие возрастает почти в 5 раз, в 5 —10 раз снижается сосудистое сопротивление в малом круге кровообращения. Через легкие протекает весь объем сердечного выброса, в то время как во внутриутробном периоде через них проходило только 10% этого объема. Основную роль в уменьшении сосудистого сопротивления играет расширение мышечных артерий и артериол под влиянием увеличенного рО2. Определенное значение придается освобождению в эпителии легких из клеток Кульчицкого под влиянием кислорода больших количеств брадикинина, непосредственно расширяющего легочные сосуды.
Вследствие уменьшения сопротивления в легочном русле, увеличения притока крови в левое предсердие, уменьшения давления в нижней полой вене происходит перераспределение давления в предсердиях и шунт через овальное окно перестает функционировать. Однако при легочной гипертензии этот шунт может сохраниться или возобновиться, что наблюдается при респираторном дистресс-синдроме, пневмонии и др.
Иногда возникает обратная ситуация, т. е. шунтирование крови слева направо, что наблюдается тогда, когда вторичная межпредсердная перегородка не прикрывает полностью отверстия в первичной перегородке. Однако чаще этот сброс крови между предсердиями оказывается очень маленьким и дефект ликвидируется в течение первых месяцев и лет жизни без какого-либо лечения. Анатомическое же закрытие овального окна происходит позднее. Так, отверстие, пропускающее тонкий зонд, но не имеющее какого-либо значения для гемодинамики, обнаруживается почти у 50% детей в возрасте 5 лет и у 10 — 25% взрослых людей.
Сразу после первого вдоха под влиянием парциального давления кислорода наступает спазм артериального протока (не исключено, что в этом процессе играют также роль биологически активные вещества — простагландины, ацетилхолин и брадикинин). Однако проток, функционально закрытый после первых дыхательных движений, может снова раскрыться, если эффективность дыхания нарушается. Анатомическое перекрытие артериального протока происходит позднее (у 90% детей к 2 мес жизни). Вследствие прекращения кровообращения прекращается кровоток и по венозному протоку, который обли-терируется. Таким образом начинают функционировать малый (легочный) и большой круги кровообращения.
Анатомические особенности сердца и сосудов
Масса сердца у новорожденных составляет 0.8% от массы тела, что несколько больше аналогичного соотношения у взрослых (0.4%). Правый и левый желудочки примерно равны между собой. Толщина их стенок составляет около 5 мм. Предсердия и магистральные сосуды имеют относительно большие размеры по отношению к желудочкам, чем в последующие возрастные периоды.
С возрастом происходит нарастание массы сердца: к 8 мес происходит удвоение, к 3 годам — утроение, к 5 годам масса сердца увеличивается в 4 раза, к 6 годам — в 11 раз, а затем его увеличение замедляется.
Стимулятором роста левого желудочка является возрастающее сосудистое сопротивление и артериальное давление. Масса правого желудочка в первые месяцы может уменьшаться почти на 20%, что объясняется уменьшением периферического сопротивления, особенно вследствие выключения артериального протока. Одновременно происходит тканевая дифференцировка. Гистологически миокард у новорожденного имеет очень тонкие, слабо отграниченные друг от друга мышечные волокна. Слабо выражена продольная фибриллярность и поперечная исчерченность. Ядра представлены в большом количестве, но они мелкие, малодифференцированные. Слабо развита соединительная ткань. У детей в первые два года жизни увеличена толщина мышечных волокон, уменьшено число ядер мышечных клеток при значительном увеличении их размеров. Появляются септальные перегородки и поперечная исчерченность волокон. В стволе сердца в это время происходит редукция мышечных волокон и увеличение диаметра сердечных проводящих миоцитов (волокон Пуркинье). В периоде с 3 до 7 —8 лет при относительно медленном темпе роста массы сердца происходят его окончательная тканевая дифференцировка, обогащение соединительной и эластической тканью, дальнейшее утолщение мышечных волокон. В стволе сердца идет интенсивная редукция мышечных волокон, появляется фибриллярность, разрастается соединительная ткань. В возрасте старше 10 лет происходит интенсивный рост всех элементов с заметным увеличением количества соединительной ткани и эластических волокон, появляются вкрапления жира.
Калибр ствола сердца в течение всего периода детства остается без изменений и, следовательно, в первые годы жизни имеет относительно большие размеры, чем у взрослого. У детей чаще наблюдается интрамуральный тип ствола, т. е. его расположение в мышечной, а не в соединительнотканной части перегородки между желудочками.
Главный ствол легочной артерии к моменту рождения относительно короткий и делится на две примерно равные ветви, что создает у некоторых детей перепад давления между сосудами, доходящий до 8—15 мм рт. ст. и может быть причиной появления характерного систолического шума периферического стеноза легочной артерии. После рождения просвет легочной артерии сначала не увеличивается, а диаметр ее ветвей растет достаточно интенсивно, что приводит к исчезновению перепада давления обычно через 5 — 6 мес. Стенка легочной артерии состоит из каркаса эластических волокон, чередующихся с гладкомышечными элементами. В ответ на гипоксию и ацидоз просвет артерии может существенно уменьшаться. У ребенка первых недель и месяцев жизни мышечный слой легочных сосудов менее выражен, чем объясняется меньшая ответная реакция детей на гипоксию. Несмотря на значительное снижение сосудистого сопротивления в легких после начала дыхания, давление в легочной артерии снижается относительно медленно. У детей, родившихся на высоте уровня моря, стабильный уровень давления достигается к 6 нед жизни. Это обусловлено высокой реактивностью сосудов малого круга к гипоксии и ацидозу, пока не произошла регрессия мощного мышечного слоя артериол малого круга.
Длина аорты до бифуркации к моменту рождения в среднем составляет 125 мм, диаметр ее у выхода — около 6 мм. Такая же ширина свойственна нисходящему отделу. Истмус аорты, расположенный на расстоянии 10 мм от места отхождения левой подключичной артерии, имеет внутренний диаметр только около 4 мм. В первые месяцы жизни область истмуса расширяется, и после полугодия сужение просвета здесь уже не определяется.
Параллельно с ростом сердца увеличиваются и размеры магистральных сосудов, однако темп их роста более медленный. Так, если объем сердца к 15 годам увеличивается в 7 раз, то окружность аорты — только в 3 раза. С годами несколько уменьшается разница в величине просвета отверстий легочной артерии и аорты. Если к моменту рождения соотношение просветов легочной артерии и аорты превышает 20 — 25% (аорта 16 мм, легочная артерия 21 мм), к 10—12 годам их просвет сравнивается, а у взрослых просвет аорты превышает просвет легочной артерии (аорта 80 мм, легочная артерия 74 мм).
Окружность ствола легочной артерии у детей постоянно больше окружности ствола восходящей аорты. Просвет артерий в целом с возрастом несколько сужается относительно размеров сердца и нарастающей длины тела. Только после 16 лет происходит некоторое расширение артериального сосудистого русла.
Кровеносные сосуды новорожденных тонкостенные, в них недостаточно развиты мышечные и эластические волокна. Просвет артерий относительно широк. Отношение просвета вен и артерий приблизительно 1:1. Поскольку вены растут быстрее артерий, то к 16 годам их просвет становится вдвое шире артерий. С ростом сосудов происходит и развитие в них мышечной оболочки и соединительнотканных элементов. Наиболее интенсивно утолщается интима сосудов. Дифференцировка артериальной и венозной сети проявляется развитием коллатеральных сосудов, возникновением клапанного аппарата, увеличением числа и длины капилляров. Переход к прямостоянию и ходьбе меняет условия гемодинамики, способствуя более интенсивному развитию венозной системы нижней половины тела.
Наряду с общей закономерностью роста сосудов большого круга кровообращения обратная картина происходит в артериолах малого круга кровообращения. Если к моменту рождения они выглядят как мышечные артерии с гипертрофией мышечного слоя и гиперплазией внутренней оболочки, то в первые месяцы жизни происходит их инволюция с истончением стенок и значительным увеличением просвета сосудов.
Анатомически сердце новорожденного расположено более краниально, чем у детей старшего возраста, что частично обусловлено более высоким стоянием диафрагмы. Большая ось сердца лежит почти горизонтально. Форма сердца шарообразна вследствие изменения соотношений между длинным и поперечным размером, причем последний может быть больше первого. Объем сердца относительно объема грудной клетки значительно больше. Проекция сердца на позвоночный столб приходится на уровень между IV и VIII грудными позвонками. Левый край сердца выходит за среднеключичную линию, правый выступает за край грудины. Передняя поверхность сердца образована правым предсердием, правым желудочком и большей, относительно других возрастов, частью левого желудочка.
На протяжении первых лет жизни и в подростковом возрасте происходит серия поворотов и перемещений сердца внутри грудной клетки.
Уже в конце периода новорожденности границы сердца смещаются во фронтальной плоскости вправо, вследствие чего правая граница удаляется от правого края грудины, а левая, наоборот, приближается к левому краю, что обусловлено уменьшением размеров печени и увеличением объема левого легкого. В грудном возрасте начинается поворот сердца справа налево вокруг вертикальной оси, вследствие чего правая и левая границы их приближаются к краю грудины. Однако продолжение поворота вокруг вертикальной оси в пред- и дошкольном возрасте снова приводит к удалению обеих границ сердца от грудины, причем это особенно заметно в возрасте от 1 года до 3 лет. Такое положение может сохраняться в течение нескольких лет, после чего имеет место некоторая обратная динамика отстояния левой границы сердца от грудины.
Нижняя граница относительно стабильна вплоть до 6 — 7 лет жизни.
Верхняя граница сердца постепенно опускается. За первый месяц жизни от уровня первого межреберья - II ребро доходит до второго межреберья. а к 7 годам до третьего межреберья.
Проекция устья легочного ствола и аорты в раннем возрасте смещается вниз: устье легочного ствола — со II до III ребра, устье аорты — с III до IV ребра. Проекция правого предсердно-желудочкового отверстия смещается с III до V ребра, левого — с III ребра до четвертого межреберья. После трехлетнею возpacта начинается обратное перемещение точек проекции и их приближение к соответствующим точкам взрослого человека.
Верхушка сердца у новорожденного представлена двумя желудочками, но уже с 6 мес ее образует только левый желудочек. Проекция верхушки сердца у новорожденного находится в четвертом межреберье, но к возрасту около 1½ лет смещается в пятое межреберье.
Частота пульса у детей
Пульс новорожденных аритмичен, характеризуется неодинаковой продолжительностью и неравномерностью отдельных пульсовых волн и промежутков между ними. Иногда это заметно при пальпации пульса над артерией, но лучше всего иллюстрируется данными сфигмографии.
Пульс у детей всех возрастов чаще, чем у взрослых, что в первую очередь объясняется более интенсивным обменом веществ. Наряду с этим определенное значение также имеет сравнительно позднее развитие вагусной иннервации сердца.
Переход ребенка в вертикальное положение и начало активной двигательной деятельности способствуют урежению сердечных сокращений, повышению эффективности и экономичности деятельности сердца. Признаками начала вагусного влияния на сердце ребенка является тенденция к урежению пульса в состоянии покоя и возникновение дыхательной аритмии. Последняя заключается в изменении частоты пульса на вдохе и выдохе. Эти признаки можно констатировать уже с начала 2-го года жизни, но особенно ярко они проявляются у старших детей и подростков, занимающихся спортом.
Возраст |
Частота пульса в 1 мин |
Новорожденный |
120-140 |
1 год |
120 |
3 года |
105 |
5 лет |
100 |
8 » |
90 |
10 » |
85 |
12 » |
80 |
У детей с достаточной двигательной нагрузкой частота пульса несколько меньшая, чем у их сверстников с гиподинамией. Частота пульса у девочек, как правило, несколько выше, чем у мальчиков. Во сне пульс у детей замедляется. Этого не наблюдается у детей первых месяцев жизни; разница в пульсе во время сна и бодрствования у детей до 1—2 лет составляет около 10 ударов в минуту, а после 4 — 5 лет может достигать 15 — 20 ударов в минуту.
Артериальное давление у детей
С возрастом детей растет преимущественно систолическое (максимальное) артериальное давление. Диастолическое (минимальное) давление имеет только тенденцию к повышению. Рост давления происходит более интенсивно в первые 2 — 3 года жизни, в препубертатном и пубертатном периодах.
Повышение давления с возрастом идет параллельно росту скорости распространения пульсовой волны по сосудам мышечного типа и связано с повышением тонуса этих сосудов. Показатели артериального давления тесно коррелируют с физическим развитием детей. Имеет значение не только достигнутый уровень размеров или массы тела, но и их динамика, т. е. темп роста ребенка. Наивысшие нормальные показатели артериального давления определяются в те периоды, когда имеется наиболее интенсивное увеличение размеров тела, но еще не произошло соответствующее нарастание массы сердечной мышцы. У старших школьников и подростков изменения артериального давления отражают и созревание эндокринной системы, прежде всего увеличение активности надпочечников с увеличением выработки минералокортикоидов и катехоламинов, особенности их метаболизма и чувствительности рецепторов.
Для ориентировочного расчета артериального давления (в мм рт. ст.) у мальчиков старше 1 года можно пользоваться следующими формулами: среднее возрастное: систолическое 90 + 2n, диастолическое 60 + n, верхнее пограничное: систолическое 105 + 2n, диастолическое 75 + n, нижнее пограничное: систолическое 75 + 2n, диастолическое 45 + n, где n — возраст детей в годах. Для девочек от полученных величин систолического давления следует отнять 5.
Cумма частоты пульса и величины систолического артериального давления во все периоды детства равна около 200.
