- •«Вступ. Основи термодинаміки»
- •Основні поняття термодинаміки.
- •1 Закон термодинаміки.
- •2.1. Залежність теплових ефектів реакцій від температури.
- •2 Закон термодинаміки.
- •Основні поняття термодинаміки
- •Перший закон термодинаміки
- •Залежність теплових ефектів реакцій від температури.
- •Другий закон термодинаміки
«Вступ. Основи термодинаміки»
План
Основні поняття термодинаміки.
1 Закон термодинаміки.
2.1. Залежність теплових ефектів реакцій від температури.
2 Закон термодинаміки.
Хімічна термодинаміка – найважливіший розділ фізичної хімії. Головна мета вивчення хімічної термодинаміки - це розв'язання фундаментальних завдань металургійної технології: кількісне обчислення енергетичних ефектів, які супроводжують хімічні реакції, що проходять в металургійних процесах; визначення можливості самовільного проходження процесів при заданих параметрах, а також умов, при яких дані процеси будуть проходити з максимальним виходом продуктів.
Основні поняття термодинаміки
Термодинаміка — це наука про перетворення енергії. Вона розглядає механічні, електричні, магнітні процеси разом з тепловими процесами, що їх супроводжують. Вивчає закони взаємного перетворення різних видів енергії, енергетичні ефекти, що упроводять різні фізичні і хімічні процеси, залежність їх від умов перебігу процесів за певних умов. Термодинаміка ґрунтується на: 1) законі збереження енергії, 2) законі зростання ентропії, 3) тепловій теоремі Нерста про недосяжність абсолютного нуля температур.
Об'єкт вивчення термодинаміки - термодинамічні системи, тобто макроскопічні об'єкти, які відокремлені від навколишнього середовища реальною або умовною поверхнею. Системи бувають:
- відкриті, тобто такі системи, в яких існує обмін енергією і речовиною з навколишнім середовищем;
- закриті, в яких існує обмін енергією з навколишнім середовищем, але відсутній обмін речовиною;
- ізольовані, в яких відсутній обмін і речовиною і енергією.
Стан системи описують за допомогою макроскопічних параметрів.
Параметри бувають:
- внутрішні, які визначаються лише координатами тіл системи, наприклад: густина, внутрішня енергія U;
-зовнішні, які визначають координати тіл в навколишньому середовищі, наприклад: об'єм V, напруженість електричного поля Е;
-екстенсивні, які пропорційні масі системи або числу часточок: об'єм V, внутрішня енергія U, ентропія S, теплоємність С;
- інтенсивні, які не залежать від маси системи або числа часточок, наприклад: температура Т, тиск Р.
Відношення двох любих екстенсивних параметрів являється інтенсивним параметром, наприклад: мольний об'єм, чи мольна частка X.
Параметри системи можуть залежати або не залежати від часу. В залежності від цього розрізняють такі стани системи:
- стаціонарний, коли параметри системи не змінюються з часом, але в системі можуть бути потоки маси або енергії;
-рівноважний, коли параметри системи не залежать від часу і не має потоків;
- нерівноважні, коли параметри системи залежать від часу.
Якщо хоча б один із параметрів системи змінюється з часом, то кажуть, що в системі проходить процес. Процеси бувають:
- оборотні, коли перехід системи з одного стану в інший і в зворотному напрямку проходить по одному і тому ж шляху, і після повернення системи в початковий стан в навколишньому середовищі не залишаються макроскопічні зміни;
- рівноважний або квазістатичний, який проходить під дією безкінечно малої різниці сил;
нерівноважні або необоротні, коли параметри змінюються з кінцевою швидкістю.
Крім того процеси бувають:
ізотермічні, Т- сonst;
ізохорні, V-соnst;
ізобарні, Р - соnst;
адіабатичні, q = 0.
Вся термодинаміка заснована на двох постулатах і трьох законах.
Основний постулат термодинаміки: Будь-яка ізольована система з часом приходить в рівноважний стан і самочинно не може з нього вийти. Перехід системи в рівноважний стан називається релаксацією.
Другим постулатом, або нульовим законом термодинаміки описуються властивості систем, які знаходяться в стані теплової рівноваги: Якщо система А знаходиться в тепловій рівновазі з системою В, а та в свою чергу з системою С, то системи А і С також: знаходяться в тепловій рівновазі. Цей параметр вводить поняття температура. Системи, які знаходяться в тепловій рівновазі мають однакову температуру. Найпростішим рівнянням стану є рівняння стану ідеального газу (рівняння Менделєєва-Клапейрона):
PV=nRT (1.1)
де
Р – тиск; Т – температура; V – молярний
об’єм;
n – кількість молів ідеального
газу; R – універсальна газова стала.
Т=273 К і Р0=101325 Па V=22,410-3
м3. R= 8,314
![]()
Ідеальні гази- це гази, які рухаються безперервно і хаотично, які постійно стикаються між собою і стінками посудини. Ідеальні гази є мізерними ( не враховується розмір).
Для ідеальних газів також використовують рівняння Бойля-Маріотта:
![]()
![]()
При розширенні газу виконується певна робота А. Робота, що виконується при зміні об’єму ідеального газу від V до V, визначається за формулою:
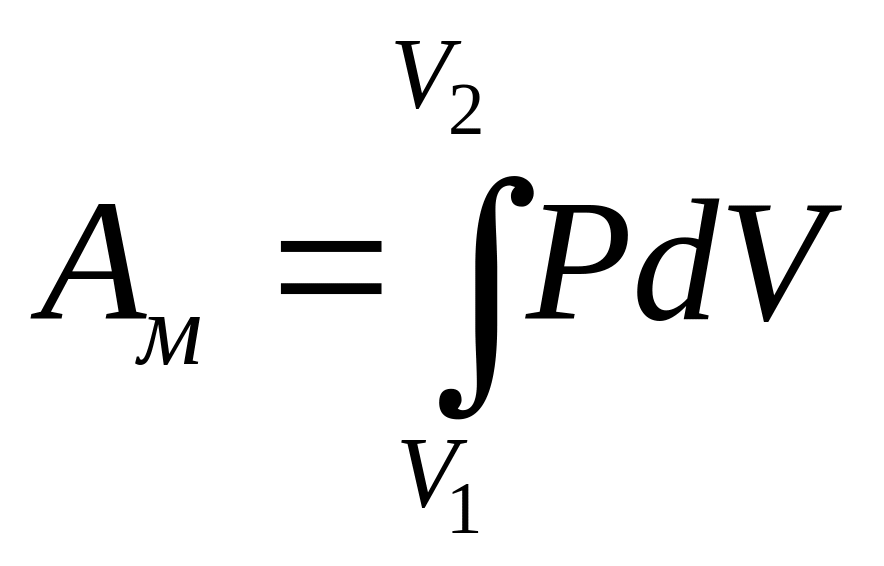
(1.2.)
При оборотних процесах робота буде максимальна.
Робота та енергія.
Робота – це енергія, яка передається одним тілом другому при взаємодії їх і не залежить від температури цих тіл. Розрізняють додатню роботу, яка виконується системою над середовищем (розширення газу, дисоціація), та від’ємну роботу, яку навколишнє середовище виконує над системою (стиснення газу).
Теплоту, яку підводять до системи в термодинаміці вважають додатною, а віддану системою – від’ємною.
Теплоємність системи або речовини називається відношення кількості теплоти, яку одержує система при нагріванні або віддає при охолодженні до відповідної зміни температури.
Теплоємність є мольна теплоємність — для нагрівання одного моля речовини, питома теплоємність — для нагрівання одного грама речовини. Вона позначається символом С.
Поділяють : ізохорна та ізобарвна теплоємність.
![]()
![]()
Мольна теплоємність
Роботу ідеального газу в деяких процесах розширення V1—V2 можна визначити за такими рівняннями:
Процес |
Робота |
Теплота |
|
Ізотермічний |
|
0 |
|
Ізохорний |
А=0 |
|
|
Ізобарний |
|
|
|
адіабатичний |
|
А= -∆V |
|
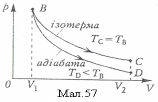
Адіабатичний (адіабатний) процес — термодинамічний процес, при якому система не дістає ззовні і не віддає теплоти (Q = 0). Адіабатичний процес можна здійснити в системі, оточеній теплоізоляційною оболонкою. Але, якщо процес відбувається дуже швидко - теплообміном з навколишнім середовищем можна нехтувати, то його можна вважати адіабатичним і тоді, коли немає теплової ізоляції.
На мал. 57 подано графік адіабатного процесу. При адіабаті зміна тиску від об’єму відбувається швидше, ніж при ізотермі.. Це пояснюється тим, що при адіабатному стисненні збільшення тиску газу зумовлено не тільки зменшенням його об’єму, як при ізотермічному стисненні, а й підвищенням температури.