
- •Вопросы и задачи к главе 1
- •§ 1. Основные понятия термодинамики
- •§ 2. Уравнения состояния
- •§ 3. Первый закон термодинамики. Термохимия
- •§ 4. Второй закон термодинамики. Энтропия
- •§ 5. Термодинамические потенциалы
- •Вопросы и задачи к главе 2
- •§ 6. Термодинамика растворов неэлектролитов
- •§ 7. Гетерогенные (фазовые) равновесия. Однокомпонентные системы
- •§ 8. Гетерогенные (фазовые) равновесия. Двухкомпонентные системы
- •§ 9. Химическое равновесие
- •§ 10. Расчеты равновесий при наличии дополнительных видов работ
- •Вопросы и задачи к главе 3
- •§ 11. Термодинамика растворов электролитов
- •§ 12. Электропроводность растворов электролитов
- •§ 13. Электрохимические цепи
- •Вопросы и задачи к главе 4
- •§ 14. Основные понятия и постулаты статистической термодинамики
- •Вопросы и задачи к главе 5
- •§ 17. Основные понятия химической кинетики
- •§ 18. Кинетика реакций целого порядка
- •§ 20. Влияние температуры на скорость химических реакций
- •§ 21. Кинетика сложных реакций
- •§ 22. Приближенные методы химической кинетики
- •§ 23. Катализ
- •§ 24. Фотохимические реакции
- •§ 25. Теории химической кинетики
- •Вопросы и задачи к главе 6
- •§ 27. Линейная неравновесная термодинамика
- •§ 28. Сильно неравновесные системы
- •Варианты контрольных работ
- •Тема «Основы химической термодинамики»
- •Тема «Приложения химической термодинамики»
- •Тема «Электрохимия»
- •Тема «Статистическая термодинамика»
- •Тема «Химическая кинетика»
- •Приложения
- •Приложение I. Единицы измерения физических величин
- •Приложение II. Фундаментальные физические постоянные
- •Приложение III. Таблицы физико-химических данных
- •Приложение IV. Математический минимум
- •Приложение V. Список основных физико-химических формул
- •Приложение VI. Литература
- •Приложение VII. Интернет-ресурсы
- •Ответы
68 |
Вопросы и задачи к главе 2 |
если стандартная энергия Гиббса реакции оксигенирования Mb + O2 = MbO2 при 310 К равна −12,95 кДж · моль−1.
9-34. В красных кровяных тельцах концентрации ATФ4−, AДФ3− и HPO24− равны 2,25, 0,25 и 1,65 ммоль · л−1 соответственно. Рассчитайте значение rG
реакции
АТФ4− + H2O AДФ3− + HPO24− + H+,
протекающей в красных кровяных тельцах при 25 ◦C и pH 7, если |
|
G◦ = |
|||||||
= |
− |
30,5 кДж |
· |
моль−1. |
|
|
|
|
|
|
|
|
|
|
|
||||
|
9-35. |
Используя данные предыдущей задачи, рассчитайте значение кон- |
|||||||
станты равновесия реакции |
|
|
· |
|
|||||
|
|
|
|
|
4 |
2 |
G◦ = +13,8 кДж |
моль−1 |
|
глюкоза + HPO2− глюкозо-6-фосфат2− |
+ H O, |
|
|||||||
(штрихом обозначают стандартные состояния в биохимии). Оцените, чему равно отношение концентраций глюкозо-6-фосфата и глюкозы в красных кровяных тельцах в условиях химического равновесия при 25 ◦C и pH 7.
9-36. В клетке при 25 ◦C и pH 7 протекает реакция
пируват + НАДН + H+ = лактат + НАД+.
Рассчитайте значение G для приведенной выше реакции, если концентрации
веществ в живой клетке равны: пирувата |
— |
|
380 мкмоль |
· |
л−1, НАДН — |
|||
1 |
, лактата — 3700 мкмоль · |
1 |
, НАД |
+ |
|
1 |
||
50 мкмоль · л− |
л− |
|
— 540 мкмоль · л−1. |
|||||
Стандартная энергия Гиббса реакции при pH 7 |
G◦ = −25,1 кДж · моль− . |
|||||||
В какую сторону будет смещено равновесие при указанных условиях?
§10. Расчеты равновесий при наличии дополнительных видов работ
ВОПРОСЫ
1.Покажите, как изменятся частные условия равновесия при наличии в системе дополнительных видов работ, если обобщенные координаты а) пропорциональны количеству компонентов, б) не зависят от количества компонентов.
2.Что такое полный потенциал? Приведите примеры полных потенциалов.
3.Объясните, за счет чего вещества с высокоразвитой поверхностью проявляют повышенную активность в фазовых и химических превращениях. Приведите примеры.
4.По каким признакам можно различить физическую и химическую адсорбцию?
5.Есть ли возможность, используя справочные величины, оценить корректность применения уравнения БЭТ для аппроксимации экспериментальных данных?
6.Что такое изостерическая теплота адсорбции и почему при определении тепловых эффектов адсорбционных процессов надо накладывать какие-то дополнительные условия на систему (в отличие от теплот химических реакций)?
7.Перечислите условия, которые должны выполняться, чтобы по результатам электрохимических измерений можно было определять значения термодинамических функций.

Вопросы и задачи к главе 2 |
69 |
8.Чем обусловлена необходимость использования одинаковых металлических проводников на концах электрохимических цепей при определении термодинамических характеристик происходящих в них процессов?
9.Предложите термодинамическое объяснение эффекта Мейснера.
10.Может ли один и тот же фазовый переход в зависимости от условий идентифицироваться как переход 1-го или 2-го рода?
ПРИМЕРЫ
Пример 10-1. При 195 К и парциальном давлении аргона 24 Торр на 1 г коксового угля адсорбируется некоторое количество Ar. При увеличении давления в 9 раз количество сорбирующегося газа возрастает в 5 раз. Определите степень заполнения поверхности при 195 К и давлении аргона 100 Торр.
Решение. Для определения степени заполнения необходимо знать константу адсорбционного равновесия KL. Для нахождения ее воспользуемся отношением
|
a1 = am |
|
|
KLp1 |
|
и a2 = am |
|
|
KLp2 |
, |
|
|
||||||||
|
1 |
+ KLp1 |
1 + KLp2 |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
a1 |
= |
p1(1 + KLp2) |
, |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
a2 |
p2(1 + KLp1) |
|
|
|
|
|
|
|
|
|
||||
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
KL = |
a1p2 − a2p1 |
= |
a1 · 9 · p1 − 5 · a1 · p1 |
= |
1 |
= |
|
1 |
= 0,0046. |
|||||||||||
|
|
|
|
· 24 |
||||||||||||||||
|
p1p2(a2 − a1) |
|
|
|
|
9p12 · 4a1 |
|
|
|
9p1 |
9 |
|
|
|||||||
При p = 100 Торр степень заполнения θ = |
|
KLp |
|
= |
0,0046 · 100 |
= 0,315. |
||||||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
1 |
+ KLp 1 + 0,0046 · 100 |
|
||||||||||
Пример 10-2. При исследовании адсорбции азота на 1 г активированного угля при 273 К получены следующие результаты (объем поглощенного газа пересчитан к н. у.):
p, Торр |
4,5 |
9,2 |
18,6 |
40,2 |
|
|
|
|
|
V , см3 · г−1 |
1,12 |
2,22 |
4,22 |
8,02 |
Выясните, описываются ли эти данные изотермой Ленгмюра, и определите площадь поверхности адсорбента, если в плотном монослое молекула азота занимает площадь 0,162 нм2.
Решение. Воспользуемся линейной формой уравнения Ленгмюра в виде
|
|
p |
= |
1 |
+ |
|
1 |
p. |
|
|
|
|
|
|
VmKL |
|
|
|
|||||
|
|
V |
|
|
Vm |
|
|
||||
Составляем вспомогательную таблицу: |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||
p, Торр |
4,5 |
|
|
|
9,2 |
|
18,6 |
40,2 |
|||
|
|
|
|
|
|
|
|||||
p/V , Торр · см−3 · г |
4,0155 |
|
|
4,1464 |
4,4084 |
5,0104 |
|||||
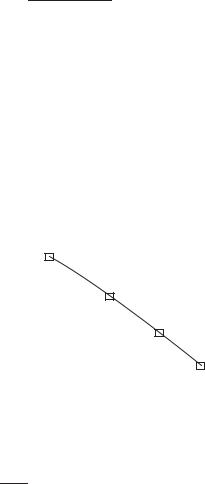
Данные таблицы можно представить в виде графика; угловой коэффициент равен 1/Vm, а по отрезку, отсекаемому на оси ординат, рассчитывается величина 1/VmKL. Более точные значения параметров Vm и KL получаются при статистической обработке данных, например, методом наименьших квадратов:
p |
= 3,89 + 2,787 · 10−2p, |
т. е. |
1 |
= 2,787 · 10−2, Vm = 35,9 см3 · г−1. |
V |
Vm |
70 |
Вопросы и задачи к главе 2 |
При н. у. объем, занимаемый 1 моль газа, V0 = 22,4 л; площадь, занимаемая 1 молекулой, равна 16,2 · 10−20 м2. Тогда
s= S · NA · Vm/V0 =
=16,2 · 10−20 м2 · 6,02 · 1023 моль−1 · 35,9 · 10−3 л · г−1/22,4 л · моль−1 =
=156,3 м2 · г−1.
Пример 10-3. При 312 К и давлении 1,21 Торр на поверхности микропористого глинистого адсорбента сорбируется 1,37 моль · кг−1 паров метилового спирта. Такая же адсорбция достигается при повышении температуры до 320 К и увеличении давления до 3,16 Торр. Вычислите энтальпию адсорбции метилового спирта при данной степени заполнения поверхности.
Решение. Энтальпия адсорбции равна
H |
= |
|
RT1T2 |
ln |
p2 |
= |
8,314 · 312 · 320 |
ln |
3,16 |
= |
− |
99603 Дж |
· |
моль−1. |
||
T1 |
|
T2 |
p1 |
1,21 |
||||||||||||
адс |
|
− |
|
|
8 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
||
Пример 10-4. Для водных растворов фенола при 20 ◦C измерены значения поверхностного натяжения (см. таблицу). Рассчитайте адсорбцию фенола ( 2) при концентрации 0,2 моль · л−1.
c, моль · л−1 |
0,05 |
0,127 |
0,268 |
0,496 |
σ · 103, Н · м−1 |
67,88 |
60,10 |
54,58 |
44,97 |
Решение. Для определения адсорбции нам понадобятся вспомогательные данные для ln c:
ln c |
−2,9957 |
−2,0636 |
−1,3168 |
−0,7012 |
σ · 103, Н · м−1 |
67,88 |
60,10 |
54,58 |
44,97 |
Строим график зависимости σ = f(ln c).
σ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
7 · 10−2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 · 10−2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 · 10−2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
||||||||||||
4 · 10−2 |
|
|
|
σ = −0,0009(ln c)2 − 0,0136 ln c + 0,0357 |
||||||||||||||
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−3,5 |
|
|
|
−2,5 |
−1,5 |
|
−0,5 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln c |
||
Графическим или аналитическим дифференцированием находим
|
∂σ |
T ,c=0,2 |
= −0,0107 Н · м−1. |
∂ ln c |

|
|
|
|
|
|
|
|
|
Вопросы и задачи к главе 2 |
|
|
|
|
71 |
||||
Соответственно, |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
= |
|
1 |
|
∂σ |
T |
= |
|
−0,0107 |
= 4,39 |
|
10−6 моль м−2 = |
|
|
|
||
|
− RT |
|
− |
· |
|
|
|
|||||||||||
|
2 |
|
∂ ln p2 |
|
8,314 · 293 |
|
=·4,39 |
· |
10−10 |
моль |
· |
cм−2. |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ЗАДАЧИ
10-1. Сколько литров аммиака при 273 К и 1 атм может адсорбироваться на поверхности 25 г активированного угля, если образуется мономолекулярный слой. Поверхность 1 г угля примите равной 950 м2. Диаметр молекулы аммиака
˚
3 A.
10-2. Вычислить площадь поверхности катализатора, 1 г которого при образовании монослоя адсорбирует при н. у. 83 см3 азота. Примите, что эффективная площадь, занятая молекулой азота, равна 16,2 · 10−20 м2.
3 |
· |
г−1. Плотность |
10-3. Удельная поверхность активированного угля 400 м2 |
|
метанола при 288 К 0,7958 г · см− . Определите максимальное количество метанола, которое может адсорбировать 1 г угля при 288 К при образовании мономолекулярного слоя.
10-4. Объем бутадиена, адсорбированного на 1 г катализатора при 15 ◦C, зависит от давления следующим образом:
p, Торр |
50 |
150 |
250 |
350 |
450 |
|
|
|
|
|
|
Va, см3 |
9,6 |
25,6 |
40,3 |
54,4 |
68,1 |
Какое уравнение — Ленгмюра или Фрейндлиха — позволяет получить адекватное описание экспериментальных данных? Определите параметры уравнения.
10-5. При адсорбции доксициклина на высокодисперсном кремнеземе при pH 6 (фосфатный буфер, навеска кремнезема 0,2 г, объем 20 мл) получены следующие значения адсорбции:
c · 104, моль · л−1 |
0,5 |
1 |
2 |
4 |
8 |
a · 105, моль · г−1 |
0,68 |
1,08 |
1,53 |
1,9 |
2,26 |
С помощью какого уравнения лучше описывать экспериментальные данные? Определите параметры этого уравнения.
10-6. В результате исследования сорбции натриевой соли бензилпенициллина из водных растворов на поверхности высокодисперсного пирогенного аминокремнезема ([NH2] = 0,3 ммоль · г−1) получены следующие значения адсорбции:
c · 103, моль · л−1 |
0,25 |
0,5 |
2 |
6 |
a · 102, моль · г−1 |
1,88 |
2,80 |
4,98 |
6,20 |
Рассчитайте константу адсорбционного равновесия и предельную величину адсорбции, если процесс сорбции описывается уравнением Ленгмюра.
10-7. Найдите степень заполнения поверхности аэросила при адсорбции натриевой соли бензилпенициллина из растворов концентрации 0,004, 0,0075
72 |
Вопросы и задачи к главе 2 |
и 0,011 моль · л−1, если адсорбция описывается уравнением Ленгмюра с константой адсорбционного равновесия 790 л · моль−1.
10-8. Оцените изменение степени заполнения поверхности кальцита при адсорбции комплексона-А из 0,00002 М раствора при разных значениях pH. Концентрация фонового электролита 0,02 М NaCl. Константы адсорбционного равновесия приведены в таблице:
pH |
8,7 |
9,5 |
10,5 |
|
|
|
|
K · 10−5, л · моль−1 |
3,5 |
3,4 |
3,3 |
10-9. |
При |
15 ◦C |
из |
водно-спиртового раствора (0,6 : |
0,4) |
концентра- |
|||||||||||||||||||
ции 5 мкмоль |
1 |
л−1 |
на |
поверхности |
сорбента |
Separon BD адсорбируется |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
44,1 мкмоль |
· |
г− |
· |
антрацена и 22,0 мкмоль |
· |
г− |
|
пирена. При увеличении их со- |
|||||||||||||||||
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
· |
л− |
1 |
|
|
|
|
|
|
|
|
|
|
|
|||
держания в растворе до 10 мкмоль |
|
количество адсорбированных веществ |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
соответственно. Рассчитайте степень |
|||||||||||
увеличивается до 54,7 и 46,8 мкмоль · г− |
|
||||||||||||||||||||||||
заполнения поверхности в каждом случае. |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
10-10. |
При адсорбции паров метилового спирта на микропористом глини- |
||||||||||||||||||||||||
стом адсорбенте получены следующие величины адсорбции: |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
p/ps |
|
|
|
|
|
0,01 |
|
0,07 |
|
|
|
|
|
0,25 |
|
|
|
0,44 |
|
0,64 |
|
0,90 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
a, моль · кг−1 |
|
|
0,70 |
|
1,00 |
|
|
|
|
|
1,28 |
|
|
|
1,55 |
|
1,85 |
|
2,55 |
||||||
Постройте изотерму адсорбции, предложите ее аналитическое описание и рассчитайте значение am.
10-11. Давление при адсорбции некоторого количества СH4 на 1 г древесного угля равно 42 Торр при 313 К и 261 Торр при 363 К. Вычислите теплоту адсорбции при данной степени заполнения.
10-12. При адсорбции этана на поверхности графитированной сажи степень заполнения θ = 0,5 достигается при следующих значениях температуры и давления: 173 К, 2,15 Торр и 188 К, 7,49 Торр. Найдите изостерическую теплоту адсорбции.
10-13. Определите энтальпию адсорбции оксида азота на фториде бария, если для адсорбции 4 см3 газа при 233 К необходимо создать давление 40,7 Торр, а при 273 К — 206,5 Торр.
10-14. Исследуя адсорбцию СО на древесном угле, обнаружили, что для того чтобы при разных температурах адсорбировалось 10 см3 газа (объемы приведены к н. у.), необходимо задать следующие равновесные давления:
T , K |
200 |
220 |
230 |
250 |
|
|
|
|
|
p, Торр |
30,0 |
45,2 |
54,0 |
73,9 |
|
|
|
|
|
Определите изостерическую теплоту, соответствующую данной величине адсорбции.
10-15. Для адсорбции N2 на 1 г кремнеземных материалов при 77 К получены приведенные в таблице зависимости объемов адсорбированного газа (Vадс, измерены в см3) от давления. Объемы приведены к стандартному давлению.

Вопросы и задачи к главе 2 |
73 |
Одна молекула N2 занимает площадь s(N2) = 0,16 нм2. Рассчитайте удельные поверхности Ω (м2 · г−1) материалов.
№p |
1,30·105 Па |
2,60·105 Па |
4,00·105 Па |
5,30·105 Па |
6,60·105 Па |
8,00·105 Па |
1 |
4,6 |
8,2 |
11,9 |
14,5 |
16,7 |
19,0 |
|
|
|
|
|
|
|
2 |
6,0 |
11,5 |
16,0 |
19,0 |
23,1 |
25,5 |
|
|
|
|
|
|
|
3 |
7,8 |
14,0 |
19,0 |
24,0 |
28,0 |
31,3 |
|
|
|
|
|
|
|
4 |
8,1 |
14,7 |
20,8 |
25,5 |
29,0 |
34,0 |
|
|
|
|
|
|
|
10-16. Определите величину поверхности TiO2 по данным, полученным при измерении адсорбции криптона на рутиле при температуре жидкого азота. Примите, что площадь, занимаемая одним атомом криптона на поверхности
˚
TiO2, равна 19,5 A.
a, мкмоль · г−1 |
14,1 |
20,9 |
32,3 |
35,5 |
36,6 |
39,3 |
45,6 |
p/ps |
0,00214 |
0,00846 |
0,0922 |
0,1586 |
0,1850 |
0,2342 |
0,3932 |
|
|
|
|
|
|
|
|
10-17. В таблице приведены значения поверхностного натяжения разбавленных растворов фенола в воде при 30 ◦C.
Мас.% фенола |
0,024 |
0,047 |
0,118 |
0,471 |
|
|
|
|
|
σ, дин · см−1 |
72,6 |
72,2 |
71,3 |
66,5 |
Рассчитайте адсорбцию фенола при концентрациях 0,1 и 0,3 мас.%.
10-18. Получены следующие данные для растворов н-бутанола в воде при 20 ◦C:
Активность |
0,0258 |
0,0518 |
0,0989 |
0,1928 |
|
|
|
|
|
σ, дин · см−1 |
68,0 |
63,14 |
56,31 |
48,08 |
Рассчитайте адсорбцию н-бутанола при активностях 0,05 и 0,1.
