
- •ВВЕДЕНИЕ
- •1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1. Химическая термодинамика и учение о равновесии
- •1.2.1. Внутренняя энергия, теплота и работа
- •1.2.4. Термохимия. Способы вычисления тепловых
- •1.2.7. Понятие о квантовой теории теплоемкости
- •1.2.10. Интегрирование уравнения Кирхгофа
- •1.3. Второе начало термодинамики, его применение
- •1.3.2. Превращение теплоты в работу. Формулировки
- •1.3.3. Изменение энтропии изолированной системы
- •1.3.5. Изменение энтропии при нагревании
- •1.3.6. Изменение энтропии в химическом процессе
- •1.4. Химическое равновесие
- •1.4.2. Уравнения Гиббса-Гельмгольца
- •1.4.3. Химический потенциал
- •1.4.4. Химический потенциал идеального газа
- •1.4.9. Уравнение изотермы химической реакции
- •1.4.12. Тепловая теорема Нернста. Постулат
- •1.5. Литература

Химическая термодинамика
Низшей теплотой сгорания называется теплота, выделившаяся при сгорании органического вещества, если образовавшаяся при этом вода находится в парообразном состоянии. Высшей теплотой сгорания называется сумма теплоты, выделившейся при сгорании органического вещества, и теплоты конденсации образовавшихся при этом паров воды.
В справочниках теплоты сгорания относятся к стандартным условиям (∆Hсг0 .,298 ).
Контрольные вопросы.
1. Сформулируйте закон Гесса. Рассчитайте на основании этого закона количество тепла, выделяющегося при переходе H2Oпар → H2Oлед и
H2Oж. → H2Oлед .
2.Что такое теплота образования и теплота сгорания?
3.Дайте определение энтальпии.
1.2.4.Термохимия. Способы вычисления тепловых
эффектов
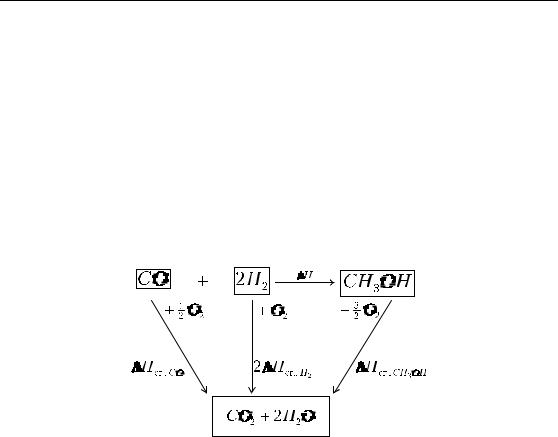
Способы расчета тепловых эффектов основаны на законе Гесса и применении термохимического цикла.
Расчет тепловых эффектов с помощью теплот образования Определим тепловой эффект гомогенной газовой реакции син-
теза метанола
COг. + 2H2,г. =CH3OHг.; ∆H =?
Эту реакцию мысленно можно осуществить, получая метанол взаимодействием простых веществ: графита, кислорода и водорода.
Составим термодинамический цикл, включающий получение метанола из простых веществ (H2 – простое вещество).
Согласно закону Гесса,
∆H f , CO + 2∆H f , H2 + ∆H = ∆H f , CH3OH ,
15
Химическая термодинамика
∆H = ∆H f , CH3OH +(∆H f , CO + 2∆H f , H2 ).
В общем случае для любой реакции:
∆H = ∑(ν j∆H f , j ) |
кон. |
−∑(νi∆H f , i ) |
, |
j |
i |
нач. |
|
|
|
где νi и ν j — стехиометрические коэффициенты для конечных и ис-
ходных веществ.
Расчет тепловых эффектов с помощью теплот сгорания Составим цикл, включающий стадии сгорания исходных ве-
ществ и продуктов, для реакции синтеза метанола:
Согласно закону Гесса,
∆Hсг., CO + 2∆Hсг., H2 = ∆H + ∆Hсг., CH3OH ,
∆H =(∆Hсг., CO + 2∆Hсг., H2 )−∆Hсг., CH3OH .
В общем случае для любой реакции:
∆H = ∑(νi∆Hсг.,i ) |
нач. |
−∑(ν j∆Hсг.,j ) |
. |
i |
j |
нач. |
|
|
|
Расчет теплоты нейтрализации сильных и слабых кислот Определим теплоту нейтрализации сильной кислоты щелочью
в водном растворе при стандартных условиях.
HCl + NaOH = NaCl + H2O
или в ионной форме:
H + +OH − = H2O; ∆H =?
Очевидно, что при нейтрализации эквивалентных количеств любых сильных кислот сильными основаниями тепловой эффект будет одинаков.
16

Химическая термодинамика
Из справочника находим теплоты образования для ионов H+ и OH − , участвующих в этой реакции:
Теплоты образования веществ |
|
Таблица 1.1 |
||||
|
|
|
||||
|
Вещества |
0 |
кДж |
∑(ν∆H of , 298 ) |
|
|
|
|
|
∆H f , 298 |
моль |
|
|
|
|
|
|
|
|
|
|
Конечные |
H2Oж. |
–285,83 |
|
–285,83 |
|
|
Исходные |
H + |
0 |
|
–230,02 |
|
|
|
OH − |
–230,02 |
|
|
|
|
На реакцию |
|
–55,81 |
|
|
|
Определим теплоту нейтрализации слабой кислоты щелочью в водном растворе при стандартных условиях.
CH3COOH + NaOH =CH3COONa + H2O; ∆H =?
или в ионной форме
CH3COOH +OH − =CH3COO− + H2O; ∆H =?
Из справочника находим теплоты образования для молекул H2O и CH3COOH, а также ионов CH3COO− и OH − , участвующих в этой реакции:
Таблица 1.2
Теплоты образования компонентов реакции
|
|
|
|
|
Вещества |
0 |
кДж |
∑(∆H 0f ,298 ) |
|
|
|
∆H f , 298 |
моль |
|
|
|
|
|
|
конечные |
H2Oж |
–285,83 |
|
–771,47 |
|
CH3COO− |
–485,64 |
|
|
исходные |
СH3COOH |
–484,84 |
|
–714,86 |
|
OH − |
–230,02 |
|
|
На реакцию |
|
–56,61 |
|
|
В этом случае теплота нейтрализации будет зависеть от аниона кислоты.
17
Химическая термодинамика
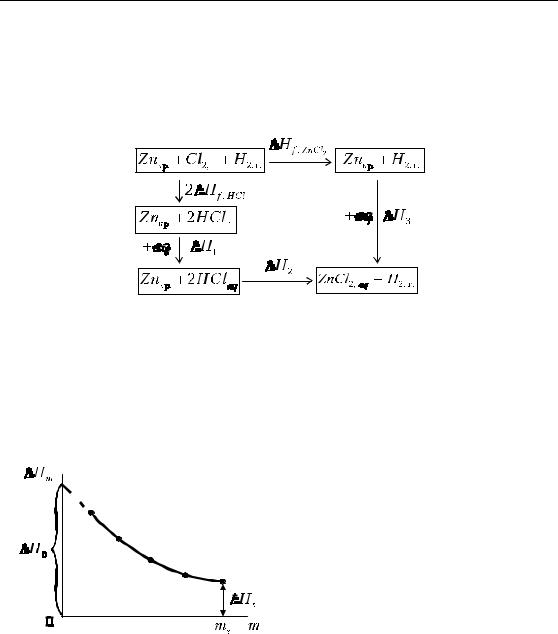
Определение тепловых эффектов с помощью теплот растворения Рассмотрим этот метод на примере расчета теплоты образования неорганической соли ZnCl 2. Составим цикл, включающий стадии образования и растворения хлорида водорода и
цинка:
2∆H f , HCl + ∆H1 |
+ ∆H2 = ∆H f , ZnCl |
+ ∆H3 |
|
|
|
2 |
|
|
|
∆H f , ZnCl = 2∆H f , HCl + ∆H1 + ∆H2 |
−∆H3 |
|
|
|
2 |
|
|
|
|
Значком aq обозначается бесконечно большое количество во- |
||||
ды и, следовательно, ∆H1 и ∆H3 — изменения энтальпии при рас- |
||||
творении HClг. и ZnCl2,кр. соответственно в бесконечно большом ко- |
||||
|
личестве растворителя (т.е. при |
|||
|
образовании |
бесконечно |
разбав- |
|
|
ленного раствора). Эти величины |
|||
|
(так называемые первые теплоты |
|||
|
растворения) определяются экст- |
|||
|
раполяцией концентрационных за- |
|||
|
висимостей интегральных теплот |
|||
|
растворения к концентрации рас- |
|||
Рис. 1.5. Зависимость теплот |
твора, равной нулю. |
|
|
|
Интегральной |
теплотой |
|||
растворения от концентрации |
растворения ( ∆Hm ) называется те- |
|||
пловой эффект при растворении одного моля вещества в таком ко- |
||||
личестве растворителя, чтобы получить раствор заданной концен- |
||||
трации. Чаще всего используют моляльные концентрации (m), т. е. |
||||
число молей растворенного вещества на 1 кг растворителя. Инте- |
||||
гральная теплота растворения зависит от природы растворяемого |
||||
вещества, растворителя и концентрации раствора (при T=const). |
||||
Первая теплота растворения (∆H0 ) (рис. 1.5) равна алгеб- |
||||
раической сумме теплот разрушения решетки и сольватации обра- |
||||
зующихся частиц. Так как при разрушении кристаллической решет- |
||||
18

Химическая термодинамика
ки тепло поглощается, а при сольватации — выделяется, ∆H0 (и ∆Hm ) может быть как положительной, так и отрицательной величиной. Экстраполяция зависимости ∆Hm = f (m) к концентрации насыщенного раствора (ms) позволяет получить последнюю теплоту растворения (∆Hg ), равную теплоте растворения 1 моля вещества в та-
ком количестве растворителя, чтобы образовался насыщенный раствор.
Упражнение 1.1
1.1.1. Найти тепловой эффект реакции между оксидом углерода (CO) и оксидом серы (SO2) по теплотам образования веществ.
4COг. +2SO2 = S2 ,г. +4CO2 ,г. .
Для нахождения теплот образования веществ используем справочные величины в кДж/моль (1 кал = 4,184 Дж):
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.3 |
|
|
|
|
|
|
Теплоты образования веществ |
|||||||
|
Вещества |
|
|
o |
кДж |
|
∑(ν∆H of , 298 ) |
|
||||
|
|
|
|
|
|
∆H f , 298 моль |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
конечные |
|
S2 ,г. |
|
|
7,14 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
–82,78 |
|
||
|
|
|
|
|
4CO2,г. |
4·(–22,48) |
|
|
||||
|
исходные |
|
4COг. |
4·(–31,30) |
|
|
–159,20 |
|
||||
|
|
|
|
|
2SO2,г. |
2·(–17,00) |
|
|
|
|||
|
На реакцию |
|
|
|
76,42 |
|
|
|
|
|||
1.1.2. По теплоте сгорания газообразного пентана найти тепло- |
||||||||||||
ту его образования. |
|
|
|
|
|
|
|
|
||||
|
C H |
12,г. |
+8O =5CO +6H O |
; |
∆H 0 |
|
=? |
|
||||
5 |
2 |
2 |
2 г. |
|
f ,C H |
12 |
|
|
|
|||
|
|
|
|
|
|
|
|
5 |
|
|
|
|
19

Химическая термодинамика
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.4 |
|||||
|
|
|
Теплоты образования веществ |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вещества |
|
|
|
|
0 |
|
кДж |
∑(ν∆H 0f ,298 ) |
|
|
|
||||
|
|
|
|
|
|
∆H f ,298 |
моль |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Конечные |
5СO2 |
|
|
5·(–393,51) |
–3682,53 |
|
|
|
|||||||
|
|
6H2Oж. |
|
|
6·(–285,83) |
|
|
|
||||||||
|
Исходные |
С5H12, г. |
|
|
∆Hf,Co |
H |
12 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
||
|
|
8O2 |
|
|
|
|
0 |
∆Hx0 = ∆H 0f ,C H |
12 |
|
|
|||||
|
|
|
|
|
|
|
|
|
5 |
|
|
|||||
|
На реакцию ( ∆Hсг.,C H |
) |
|
–3536,15 |
|
|
|
|
|
|
|
|||||
|
|
|
5 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
5∆Hсг.,CO +6∆H 0f ,H O −∆Hx |
= −368,53 −∆Hxo = −3536,15 |
|
кДж |
; |
||||||||||||
моль K |
||||||||||||||||
2 |
2 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
∆H of ,C H |
= −3536,15 |
+3682,53 = −146,44 |
кДж |
. |
|
|
|
||||||||
|
|
|
|
|
||||||||||||
5 |
2 |
|
|
|
|
|
|
|
моль K |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Контрольные вопросы.
1. Составьте цикл и рассчитайте тепловой эффект реакции
2Al + Fe2O3 = 2Fe + Al2O3 .
2. Составьте цикл и рассчитайте тепловой эффект реакции
NH4OH + HCl = NH4Cl + H2O .
3. Что такое интегральная теплота растворения?
1.2.5. Теплоемкость: изохорная и изобарная, истинная и средняя. Связь между ними
Тепловые эффекты процессов зависят от температуры, при которой они проводятся, поэтому для их вычисления при произвольных температурах необходимо знать зависимость теплоемкостей реагирующих веществ от температуры. Теплоемкость вещества — это количество теплоты, необходимое для нагревания определенного количества вещества на один кельвин. Если теплоемкость отно-
сится к 1 молю вещества, она называется молярной и измеряется в
Дж/(моль·К), а если к 1 кг – удельной и измеряется в Дж/(кг·К).
Теплоемкостью системы называется отношение количества сообщенной ей теплоты к вызванному этим повышению температуры.
Различают истинную и среднюю теплоемкость.
20
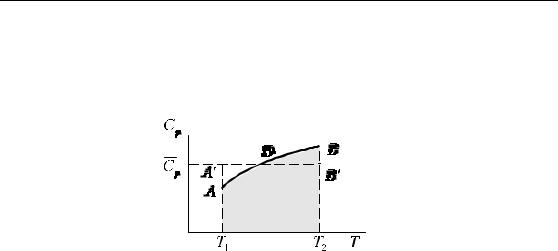
Химическая термодинамика
Истинной теплоемкостью называют теплоемкость системы, соответствующую бесконечно малому изменению температуры:
C = lim C = δQ .
∆T →0 dT
Рис. 1.6. Взаимосвязь величин средней и истинной теплоемкостей
Поскольку dQv = dU , а dQp = dH , истинная теплоемкость при постоянном объеме:
|
|
|
|
|
|
|
|
∂U |
|
|||||||
Cv |
|
= |
|
|
|
|
|
, |
(1.8) |
|||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
∂T v |
|
||||||
а при постоянном давлении: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
∂ H |
|
|||||||
Cp |
= |
|
|
|
|
|
. |
(1.9) |
||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
∂T p |
|
||||||
Средней теплоемкостью называют теплоемкость системы, со- |
||||||||||||||||
ответствующую конечному изменению температуры: |
|
|||||||||||||||
|
|
|
|
|
= |
|
|
Q |
. |
|
||||||
|
C |
|
||||||||||||||
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
∆T |
|
||||||
Средняя теплоемкость при постоянном объеме: |
|
|||||||||||||||
|
|
|
= |
|
|
∆U |
, |
(1.10) |
||||||||
C |
|
|||||||||||||||
|
|
|
||||||||||||||
|
|
|
|
v |
|
|
|
∆T |
|
|||||||
а при постоянном давлении: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
= |
|
|
∆H |
. |
(1.11) |
||||||
C |
p |
|
|
|||||||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
∆T |
|
||||||||
Для 1 моля идеального газа, для которого при p=const, согласно уравнениям (1.7) и (1.1), ∂H =∂U + p∂v и p∂v = R∂T ,
21
Химическая термодинамика
C |
p |
= |
∂ H |
= |
∂U + p∂v |
= |
∂U |
+ |
R∂T |
=C |
+ R . |
|
∂T |
∂T |
∂T |
∂T |
|||||||||
|
|
|
|
|
v |
|
На рис. 1.6 показана зависимость теплоемкости вещества от
Cp, Дж/(моль·K)
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
тв. |
|
ж. |
|
газ |
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
20 |
|
|
|
|||
|
|
|
||||
|
|
|
|
|||
|
|
|
||||
|
|
|
||||
|
|
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
100 |
200 |
300 |
400 |
500 T, K |
Рис. 1.7. Зависимость теплоемкости от температуры с учетом фазовых переходов хлора
температуры (кривая AB). Аналитически эту зависимость обычно представляют в виде интерполяционных уравнений типа:
Cp = a +bT +cT 2 + dT 3 |
(1.12) |
|||
или |
|
|
|
|
Cp = a +bT + |
c′ |
, |
(1.13) |
|
T 2 |
||||
|
|
|
||
где a, b, c, d и c′ — эмпирические коэффициенты, пригодные только для того интервала температур, в котором они получены.
Теплота, полученная системой при нагревании ее от T1 до T2, равна площади заштрихованной фигуры T1ABT2 и, в соответствии с уравнением (1.9),
∆H = ∫TT12 dH =∫TT12 CpdT .
Для упрощения расчетов часто используют не истинную, а среднюю теплоемкостьCp , величина которой в данном интервале
температур ( ∆T =T2 −T1 ) считается постоянной и выбирается таким образом, чтобы площадь прямоугольника T1 A′B′T2 (равная теплоте,
22

Химическая термодинамика
полученной системой, ∆H =Cp∆T ) была равновеликой площади фигуры T1ABT2:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p (T2 −T1 )= ∫TT2 CpdT , |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
||||||||||||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p = |
|
|
|
|
|
|
T2 CpdT |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
−T |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∫T1 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|||
или, в соответствии с уравнениями (1.12) и (1.13), |
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
T2 |
(a +bT +cT 2 + dT 3 ) |
dT = a + b (T +T )+ |
||||||||||||||||||||
C |
|
= |
|
|
|
|
|||||||||||||||||||||||||
p |
|
|
|
|
∫T |
||||||||||||||||||||||||||
|
|
|
|
T2 |
−T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
2 |
|
|||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1.14) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
+c |
(T 2 |
|
|
+T 2 )+ d |
(T |
|
+T ) |
(T 2 |
+T 2 ) |
|
|
|
|
||||||||||||||||||
+TT |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
3 |
|
1 |
|
1 |
2 |
|
2 |
4 |
1 |
|
|
2 |
1 |
2 |
|
|
|
|
|
|
|||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
T2 a +bT + |
|
c′ |
dT = a + b (T |
+T )− |
c′ |
|
. (1.15) |
|||||||||||||||
|
C |
p |
= |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
T −T |
|
|
|
|
|
|
|
|
|
|
T |
2 |
|
|
|
2 |
1 |
|
2 |
TT |
||||||
|
|
|
|
|
|
∫T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
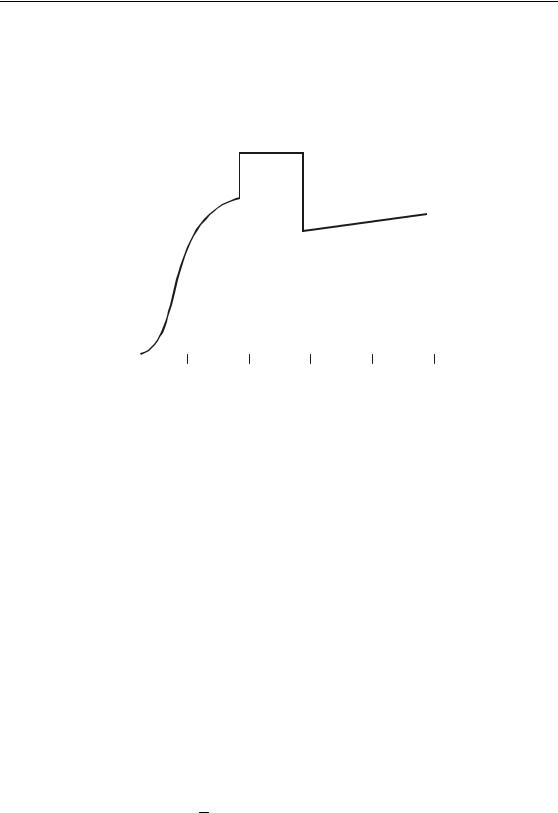
Для определения количества теплоты, необходимого для нагревания вещества в широком интервале температур, следует учитывать различия в теплоемкостях твердого, жидкого и газообразного состояний этого вещества, а также принимать во внимание теплоты агрегатных превращений ( ∆Hпл. . и ∆Hисп. .). На рис. 1.7 показана зависимость теплоемкости хлора от температуры в диапазоне от 0 до 500 K. При температуре фазовых переходов Tпл. и Tкип. наблюдается скачкообразное изменение теплоемкости. Количество тепла, необходимое для нагревания 1 моля хлора от температуры 100 до 500 K, может быть рассчитано следующим образом:
∆H100→500 = ∫100Tпл. Cp0 |
,тв.dT + ∆Hпл0 |
. + ∫TTкип. Cp0 |
,ж.dT + ∆Hкип0 |
. + ∫T500 Cpo,г.dT . |
|
|
пл. |
|
кип. |
Контрольные вопросы.
1.Дайте определение средней и истинной теплоемкостей.
2.Определите истинную и среднюю теплоемкости 1 моля Fe2O3 при 1000 K.
3.Определите количество теплоты, необходимое для нагревания 1 моля воды от
200до 500 K.
23

Химическая термодинамика
1.2.6. Классическая теория теплоемкости идеальных газов
Теплоемкость при постоянном объеме идеального газа может быть разбита на три слагаемых, соответствующих поступательному (Cп.), вращательному (Cв.) и колебательному (Cк.) движениям.
Cv =Cп. +Cвр. +Cк. |
(1.16) |
Согласно молекулярно-кинетической теории, теплоемкость, приходящаяся на одну степень свободы поступательного или вращательного движения, одинакова и равна для одного моля газа
Cv′ |
|
∂U |
|
|
R |
|
Дж |
|
= |
|
T |
= |
|
≈ 4,153 |
|
(1.17) |
|
|
2 |
моль K |
||||||
|
|
∂T |
|
|
|
|||
Под степенью свободы в молекулярно-кинетической теории понимается число независимых видов движения, на которые может быть разложено сложное движение молекулы.
Молекулы газа имеют три поступательные степени свободы в соответствии с тремя направлениями по трем осям координат, по которым может быть разложено поступательное движение молекулы. Поэтому часть молярной теплоемкости газа, связанная с поступательным движением молекул, равна 3R/2.
Нелинейные многоатомные молекулы имеют, кроме трех поступательных, еще три вращательные степени свободы. Вращательное движение молекулы также может быть разложено на три составляющих по трем осям координат. Поэтому часть молярной теплоемкости газа, связанная с вращательным движением, для такого типа молекул равна 3R/2.
Двухатомные и линейные трехатомные молекулы имеют лишь две вращательные степени свободы, так как момент инерции вращения молекулы вокруг оси, проходящей через центры атомов, незначителен и им можно пренебречь. Поэтому для газа, состоящего из линейных молекул, часть теплоемкости, обусловленная вращательным движением, равна 2R/2.
Общее число степеней свободы любой молекулы, состоящей из n атомов, равно 3n. Число колебательных степеней свободы определяется как разность между 3n и суммой числа поступательных и вращательных степеней свободы (табл. 1.5). Но при температурах, близких к 298 К, энергия колебательного движения значительно меньше, чем энергия поступательного и вращательного движений, и поэтому в классической теории теплоемкости газов не учитывается.
24
