
- •Охарактеризуйте поняття: атом, молекула, хімічний елемент. Наведіть приклади простих та складних сполук. Охарактеризуйте основні положення атомно-молекулярного вчення.
- •В перекладі з грецької мови атом – неподільний. В якій мірі це відповідає сучасному погляду на атом?
- •Чи є закон збереження маси універсальним законом природи? Аргументуйте межі його застосування при хімічних розрахунках?
- •Наведіть приклади речовин, що не мають сталого складу? Як їх називають?
- •За якою ознакою можна віднести ту чи іншу сполуку до дальтонідів або до бертолідів? у чому суть закону сталості складу?
- •Сформулюйте закон кратних співвідношень. Наведіть приклад, що пояснює смисл закону.
- •Що таке еквівалент елемента? Як можна його визначити? Чи завжди еквівалент даного елемента має однакове значення? Наведіть приклади.
- •Як визначити еквівалентну масу кислоти, оксиду, солі? Запропонуйте два способи визначення еквівалентної маси для сполук: р2о5 ,н2so4 , Fe2(so4)3.
- •Число Авогадро
- •Дивись 11
- •17.Постулати Бора
- •18.Рівняння Луї де Бройля
- •19.Двоїста природа електрона
18.Рівняння Луї де Бройля
Він розробив теорію електронних хвиль ("хвиль матерії"). Вона базувалася на працях Альберта Ейнштейна та Макса Планка і висловлювала корпускулярно-хвильовий дуалізм як теорію матерії.
λ = h/mv, де λ – довжина хвилі, h – постійна Планка, m – маса, v – швидкысть руху
19.Двоїста природа електрона
Електрон має двоїсту (корпускулярно хвильову) природу. Він може
поводитися і як частка, і як хвиля: подібно частці, електрон має
визначену масу і зарядом; у той же час потік електронів, що рухається,
виявляє хвильові властивості, наприклад характеризується здатністю до
дифракції. Довжина хвилі електрона , і його швидкість зв'язані
співвідношенням де Бройля
20. А́томною орбіта́ллю у квантовій механіці й хімії називають базисну хвильову функцію електрона в атомі.
Електронні орбіталі класифікують за орбітальними квантовими числами.
Бор ввів припущення, суть якого полягає в тому, що електрони в атомі можуть рухатися тільки по певних (стаціонарним) орбітах, перебуваючи на яких вони не випромінюють, а випромінювання або поглинання відбувається тільки в момент переходу з однієї орбіти на іншу.
21 Рівняння Шредінгера — основне рівняння нерелятивістської квантової механіки, яке визначає закон еволюції квантової системи з часом.
Хвильова
функція,
або псі-функція
![]() —
комплекснозначна функція, що
використовується в квантовій механіці
для опису стану квантовомеханічної
системи. Є
коефіцієнтом розкладу вектору стану
за базисом (за звичай координатному).
Хвильова
функція означена з точністю до довільного
множника у формі
—
комплекснозначна функція, що
використовується в квантовій механіці
для опису стану квантовомеханічної
системи. Є
коефіцієнтом розкладу вектору стану
за базисом (за звичай координатному).
Хвильова
функція означена з точністю до довільного
множника у формі
![]() ,
де
,
де
![]() -
будь-яке дійсне число. Підстановка
функції
не міняє
середніх значень спостережуваних
фізичних величин.
-
будь-яке дійсне число. Підстановка
функції
не міняє
середніх значень спостережуваних
фізичних величин.
22. Головне квантове число n характ. заг рів енерг електрона в атомі, розміри електронної хмарини. Приймає значення 1 2 3 і т.д. по номеру періода в періодичній таблиці.
Орбітальне квантове число L характ. рівень енергії електрона на енергетичному підрівні та форму електронної хмарини. Приймає значення від 0 до n-1 , де n – головне квант. число. 0 – s. 1 – p. 2 – d
23. ml - магнітне квантове число; визначає просторову орієнтацію атомних орбіталей
Приймає значення 0, -1;0;1 і т.д.
ms - спінове квантове число; визначає власний механічний і магнітний момент електрона.
Приймає значення -1/2 або +1/2
24. Принцип Паулі: в атомі не може бути 2 електронів з однаковим набором усіх чотирьох квантових чисел.
1. Максимальна к – ть електронів на енергетичному підрівні (L) max=2(2L+1)
2. Максимальна к-ть електронів на енерг. рівні (n) maxe = 2n2
3. На 1 орбіталі може бути 2 електрони з антипаралельними ms
25. 1 правило Клечковского: послідовність заповнення ел. орбіталей відбувається від орбіталей з меншим значенням суми головного й орбітального квантових чисел (n+L) до орбіталей з більшим значенням цієї суми.
2 правило: при однаковому значенні суми (n+L) відбувається заповнення тієї орбіталі, у якої головне квантове число має менше значення. 2p, 3p, 3d, 4s, 4p, 5d
26. Існує певний набір станів, кожен із яких має певне значення енергії. Стан із найменшою енергією називається основним станом. Інші стани називаються збудженими. Атом Фосфору має подібну електронну будову зовнішнього електронного шару:
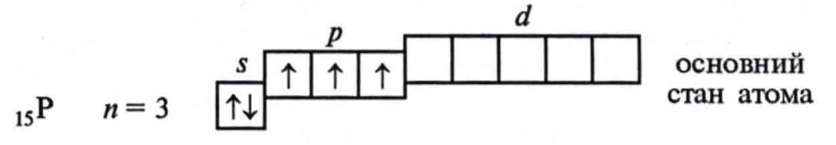

Відмінність полягає у тому, що в атомі Фосфору на зовнішньому електронному шарі є вільні d-орбіталі, це дає можливість йому переходити у збуджений стан (порівняйте з Сульфуром): Згідно з кількістю неспарених електронів у основному і збудженому станах атом Фосфору в сполуках може виявляти ступені окиснення -3, +3,+5.
27.Провал електрона У атомів Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au має місце "провал" електрона з s-підрівня зовнішнього шару на d-підрівень попереднього шару, що призводить до енергетично більш стійкого стану атома. Наприклад, електронна формула атома міді має вигляд: Cu 1s2 2s2 2p6 3s2 3p6 3d10 4s1, тобто один з двох 4s-електронів "провалюється" на 3d-підрівень.
28.
29. Ковалентність (спінвалентність) – к-ть ковалентних зв’язків яка визначається числом неспарених електронів як в основному, так і в збудженому стані.. Максимальна ковалентність всіх елементів другого періоду від Li до F рівна 4. Валентність - здатність атома даного елемента утворювати хімічні зв'язки або певного складу сполуки. Стехіометрична валентність елемента — число, яке показує, скільки атомів Гідрогену може приєднати або замінити у сполуках один атом даного елемента.
30. Гібридизація атомних орбіталей – процес вирівнювання валентних атомних орбіталей за формою і енергією, внаслідок чого виникає такаж к-ть рівноцінних орбіталей, що забезпечує утвор більш міцних зв’язків. Тип гібридизації визначається типом і кількістю вихідних орбіталей; він обумовлює розмір валентного кута. А також просторову конфігурацію молекули. (тип sp2 ;форма трикутна; кут 120).
31.
32. 1. Сігма-зв'язок – здійснюється при перекриванні хмар уздовж вісі зв’язку(умовної лінії між ядрами атомів). 2. Пі-зв'язок – виникає при перекриванні електронних хмар з обох боків від вісі зв’язку(бічне перекривання). Пі-зв'язок менш міцний, ніж сігма-зв'язок. s – електрони не здатні утворювати - зв’язок (при p, p i d, d i dорбіталей) (при s не виникає пі-зв'язок)
33. Кратність зв’язку – к-ть спільних електронних пар, що утворюють зв'язок між атомами. Підвищення кратності зв'язку приводить до зміцнення міжатомного зв'язку і зменшення між'ядерної відстані (довжини зв'язку).
34. Ковалентний неполярний зв'язок існує в молекулах наступних простих речовин: H2, F2, Cl2, O2, N2. Ковалентний полярний зв'язок утворюється в складних речовинах, утворених атомами неметалів : HF, H2O, NH3, CH4, CO2. Полярність молекул - це несиметричний розподіл електронної щільності, що виникає через різної електронегативності елементів, що входять до складу молекули. Диполь-це молекула з різними зарядами на кінцях.
35.
36. Іонний зв'язок – зв'язок утвор. силами електростатичного притяжіння між позитивно зарядженими йонами. Ненаправленість – здатність йона притягати йони протилежного знаку. Ненаправленість – здатність йона приєднувати йони протилежного знака.
37. Поляризованість – здатність деформувати електронну оболонку. Поляризувальна здатність – здатність йонів спричинювати деформуючу дію на інші йони.
38. багатоцентровість – в утворенні зв‘язку беруть участь всі позитивно заряджені йони, які містяться в кристалі; багатоелектронність - здійснення зв’язку за рахунок узагальнювання всіх валентних електронів, що знаходяться у кристалі металу; багатоелектронність зумовлює електропровідність металів.
39. Водне́вий зв'язо́к — різновид хімічного зв'язку, що реалізується за донорно-акцепторним механізмом між двома ковалентно зв'язаними атомами з великим значенням електронегативності за посередництвом атома Гідрогену Н. З деякими елементами Гідроген утворює водневий зв’язок, який зумовлює властивості багатьох органічних та неорганічних сполук. Гідроген утворює внутрішньомолекулярні водневі зв’язки у білках, нуклеїнових кислотах. У молекулах білка виникає багато сотень водневих зв’язків, які скручують молекули і надають їм значної міцності.
40. Енергія іонізації – найменша енергія потрібна для відрива електрона від нейтрального атома. Чим далі розташований елемент в періоді, тим більше потрібно енергії щоб відірвати електрон. Спорідненість до електрона – енергія, що виділяється при захопленні електрона нейтральним атомом. Приєднання двох і більше електронів енергетично не вигідно. Електронегативність – фундаментальна хімічна властивість атома, кількісна характеристика здатності атома в молекулі притягати до себе спільні електронні пари. Електронегативність в періодах зростає при збільшенні заряду ядра атома. В групах із збільшенням заряду ядра атома електронегативність зменшується.
41. Метод молекулярних орбіталей, найважливіший метод квантовій хімії . В основі методу лежить уявлення про те, що кожен електрон молекули описується своєю хвилевою функцією — молекулярною орбіталью (МО). Унаслідок неможливості точно вирішити Шредінгера рівняння для систем з двома і більш електронами, спосіб здобуття вираження для МО неоднозначний. В загальному випадку метод МО розглядає утворення хімічних зв'язків як результат руху всіх електронів в сумарному полі, створеному всіма електронами і всіма ядрами вихідних атомів.
42.
43.
44.
