
- •Министерство образования и науки рф
- •Основы химической термодинамики
- •Введение
- •Первый закон термодинамики
- •Термохимия
- •Второй закон термодинамики
- •Термодинамика агрегатных превращений
- •Термодинамические потенциалы
- •Статистический характер второго закона термодинамики
- •Контрольные вопросы
- •Библиографический список
- •Содержание
- •Учебное издание
- •644099, Омск, ул. П.Некрасова, 10
- •644099, Омск, ул. П.Некрасова, 10
Термодинамические потенциалы
План лекции: Термодинамический потенциал. Изохорно-изотермический потенциал или свободная энергия Гельмгольца. Применение энергии Гельмгольца в качестве критерия направления самопроизвольного процесса и равновесия в закрытых системах. Изобарно-изотермический потенциал или свободная энергия Гиббса. Применение энергии Гиббса в качестве критерия направления самопроизвольного процесса и равновесия в закрытых системах. Характеристические функции: внутренняя энергия, энтальпия, свободная энергия Гельмгольца, свободная энергия Гиббса. Уравнения Гиббса-Гельмгольца. Химический потенциал.
Термодинамический потенциал – это функция состояния системы, убыль которой в процессе, протекающем при постоянстве двух параметров, равна максимальной полезной работе.
Энергия Гельмгольца как изохорно-изотермический потенциал.
Для
изохорно-изотермических условий V
= const,
T
= const.
Вспомним, что объединенное уравнение,
выражающее первый и второй законы
термодинамики, имеет следующий вид:
![]() .
.
Так
как при V
= const,
![]() =
0, получим
=
0, получим
![]() .
(6.1)
.
(6.1)
Проинтегрируем данное уравнение:
![]()
![]() .
.
Введем обозначение F – это энергия Гельмгольца.
F = U - TS (6.2)
Тогда F2 = U2 - TS2 и F1 = U1 - TS1.
![]() ,
,
![]() или
или
![]()
То
есть энергия Гельмгольца – это
термодинамический потенциал, так как
его изменение равно полезной работе
при протекании обратимого процесса в
системе. Для необратимого процесса:
![]() В общем случае для обратимого и
необратимого процессов справедливо
выражение
В общем случае для обратимого и
необратимого процессов справедливо
выражение
![]() (6.3)
(6.3)
Энергия
Гельмгольца равна
![]() ,
отсюда
,
отсюда
U = F+TS. (6.4)
То есть F – это та часть внутренней энергии, которая может быть превращена в работу, поэтому она называется свободной энергией; произведение TS – это энергия, которая выделяется в виде тепла, поэтому она называется связанной энергией.
Энергия
Гельмгольца как критерий возможности
протекания процесса. Дифференцируя
выражение
![]() получим dF
= dU
– TdS
- SdT
. Подставляя вместо произведения TdS
его выражение из «объединенного»
уравнения TdS
≥ dU+pdV
получим
получим dF
= dU
– TdS
- SdT
. Подставляя вместо произведения TdS
его выражение из «объединенного»
уравнения TdS
≥ dU+pdV
получим
dF ≤ - SdT - pdV. (6.5)
Так как SdT = 0 и pdV= 0 (при Т = const и V= const), тогда для изохорно-изотермических условий
(dF)v,T ≤ 0. (6.6)
В закрытых (замкнутых) системах при изохорно-ихотермических условиях:
-
если dF < 0, то процесс протекает самопроизвольно;
-
если dF > 0, то процесс не протекает;
-
если dF = 0, то система находится в состоянии равновесия.
Энергия Гиббса как изобарно-изотермичесий потенциал. Для изобарно-изотермических условий р = const , T = const. Преобразуем объединенное уравнение первого и второго законов термодинамики:
![]() как
как
![]() (6.7)
(6.7)
Проинтегрируем это выражение:
![]() или
или
![]() .
.
Введем обозначение
![]() -
это энергия Гиббса. (6.8)
-
это энергия Гиббса. (6.8)
Тогда
![]()
![]()
![]() ,
,
![]() ,
,
![]()
То
есть энергия Гиббса G
– это термодинамический потенциал, так
как его изменение равно полезной работе
при протекании обратимого процесса в
системе. Для необратимого процесса
![]() В случае для обратимого и необратимого
процесса справедливо выражение
В случае для обратимого и необратимого
процесса справедливо выражение
![]() (6.9)
(6.9)
Энергия
Гиббса равна
![]() , но
, но
![]() Поэтому
Поэтому
![]() отсюда
отсюда
![]() .
(6.10)
.
(6.10)
Энергия Гиббса G – эта часть энтальпии, которая может быть превращена в работу; поэтому она называется свободной энергией.
В
выражение для энергии Гиббса
![]() подставим энергию Гельмгольца, которая
определяется как F=
U
- TS.
Тогда получим, что
подставим энергию Гельмгольца, которая
определяется как F=
U
- TS.
Тогда получим, что
![]() или
или
![]() .
(6.11)
.
(6.11)
Энергия Гиббса, как критерии возможности протекания процесса.
Продифференцируем
выражение
![]() ,
получим
,
получим
![]()
Вместо
TdS
подставим его значение из объединенного
уравнения первого и второго законов
термодинамики
![]() Тогда
Тогда
![]() или
или
![]() (6.12)
(6.12)
В
изобарно-изотермических условиях
![]() и
и
![]() .
(6.13)
.
(6.13)
То есть dG является критерием возможности протекания процесса в замкнутой (закрытой) системе в изобарно-изотермических условиях. При этом
-
если dG < 0, то процесс протекает самопроизвольно;
-
если dG > 0, то процесс самопроизвольно не протекает;
-
если dG = 0, то система находится в состоянии равновесия.
Характеристической функцией называется такая функция состояния системы, посредством которой или ее производных могут быть выражены в явной форме термодинамические свойства системы. Характеристическими функциями являются:
-
внутренняя энергия U ,
-
энтальпия H,
-
изохорно-изотермический потенциал F,
-
изобарно-изотермический потенциал G,
-
энтропия S.
Определим значение частных производных основных характеристических функций.
Известно,
что для любой функции
![]() от переменных
от переменных
![]() её полный дифференциал может быть
представлен выражением
её полный дифференциал может быть
представлен выражением
![]() ,
,
где
![]() -
частные производные этой функции по
соответствующей переменной при сохранении
постоянного значения остальных
переменных.
-
частные производные этой функции по
соответствующей переменной при сохранении
постоянного значения остальных
переменных.
Из
объединенного уравнения первого и
второго закона термодинамики:
![]() выводим выражение для изменения
внутренней энергии:
выводим выражение для изменения
внутренней энергии:
![]() .
(6.14)
.
(6.14)
Дифференцируем выражение
Н
= U
+ pV:
![]() .
.
Вместо
![]() подставляем
выражение (6.14), получаем
подставляем
выражение (6.14), получаем
![]() (6.15)
(6.15)
Таким
образом, из уравнения (6.14) следует, что
![]() а
из уравнения (6.15) -
а
из уравнения (6.15) -
![]() .
.
Запишем выражение полных дифференциалов dU и dH.
![]() (6.16)
(6.16)
![]() .
(6.17)
.
(6.17)
Сопоставляя уравнение (6.16) с уравнением (6.14) и уравнение (6.17) с уравнением (6.15) можно заключить, что
![]() ,
,
![]() (6.18, 6.19)
(6.18, 6.19)
![]() ,
,
![]() .
(6.20, 6.21)
.
(6.20, 6.21)
Эти соотношения показывают физический смысл частных производных внутренней энергии и энтальпии.
Запишем
выражения для полных дифференциалов
энергии Гельмгольца и энергии Гиббса:
![]() ,
,
![]() .
.
Рассмотрим F как функцию от T и V, а G как функцию T и р. Их полные дифференциалы равны:
![]() ,
(6.22)
,
(6.22)
![]() .
(6.23)
.
(6.23)
Сопоставляя
эти выражения с уравнениями (6.5):
![]() и (6.12):
и (6.12):
![]() приходим к выводу, что
приходим к выводу, что
![]() ,
,
![]() ,
(6.24, 6.25)
,
(6.24, 6.25)
![]() ,
,
![]() .
(6.26, 6.27)
.
(6.26, 6.27)
Изменение изохорного потенциала с изменением температуры при постоянном объеме определяется энтропией. Изменение изохорного потенциала с изменением объема при постоянной температуре определяется давлением.
Изменение изобарного потенциала с температурой при постоянном давлении определяется энтропией. Изменение изобарного потенциала с изменением давления при постоянной температуре определяется объемом.
Уравнения Гиббса-Гельмгольца. Запишем выражения для энергии Гельмгольца и энергии Гиббса:
 .
.
Подставим в эти уравнения, вместо энтропии равные ей производные потенциалов, получаем соотношения:
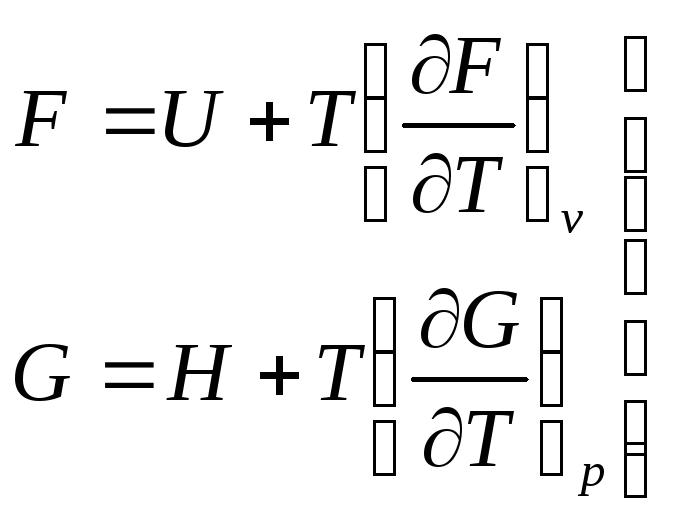 .
.
Для
изменения
![]() этих функций в результате процесса
получим:
этих функций в результате процесса
получим:
 .
(6.28, 6.29)
.
(6.28, 6.29)
Уравнения (6.28 и 6.29) - это уравнения Гиббса-Гельмгольца.
Химический потенциал. Для изучения растворов и гетерогенных систем, состоящих из 2-х и более веществ необходимо рассматривать системы, где состав и масса могут быть непостоянными вследствие химической реакции, испарения, кристаллизации и т.д. Изобарный потенциал является функцией не только Т и р, но и количества n1, n2, n3,…, nj молей компонентов.
![]() ,
,
![]()
![]() (6.30)
(6.30)
Химический
потенциал
![]() вещества в смешанной фазе равен его
парциальному изобарному потенциалу.
Он численно равен приращению изобарного
потенциала раствора, происходящему при
добавлении одного моль данного компонента
к такому количеству раствора, при котором
(при
вещества в смешанной фазе равен его
парциальному изобарному потенциалу.
Он численно равен приращению изобарного
потенциала раствора, происходящему при
добавлении одного моль данного компонента
к такому количеству раствора, при котором
(при
![]() )
его состав не меняется.
)
его состав не меняется.
![]()
или
![]()
При
![]() :
:
![]() .
.
Математическое
выражение условия
равновесия системы с переменным числом
молей компонентов:
![]() … (6.31)
… (6.31)
Представим , что из фазы α в фазу β, переходит dn1 молей 1-го компонента.
|
α |
|
β |
Условие фазового равновесия для 1-го компонента:
![]() ,
,
![]() ,
,
![]() .
(6.32)
.
(6.32)
При фазовом равновесии химический потенциал каждого компонента во всех фазах одинаков.
Л е к ц и я 7

