
- •Лечение нарушений ритма сердца
- •Часть 2
- •Оглавление
- •Методические указания
- •Глава 1. Определение понятия мерцательная аритмия
- •Глава 2. Распространенность и заболеваемость мерцательной аритмии
- •2.1 Патогенез фибрилляции предсердий
- •2.3 Факторы, предрасполагающие к развитию фибрилляции предсердий
- •2.4 Классификация фп
- •Глава 3. Гемодинамические последствия фибрилляции предсердий
- •3.1 Тромбоэмболии, патофизиология и клиническое значение
- •Глава 4. Клинические проявения фибрилляции пред-сердий
- •Глава 5. Методические рекомендации по лечению мерцательной аритмии
- •6.1 Фармакологическая кардиоверсия
- •6.2 Электрическая кардиоверсия
- •6.5 Противопоказания для восстановления синусового ритма
- •6.6 Профилактика рецидивов мерцательной аритмии
- •Глава 7. Общий подход к антиаритмической терапии
- •7.1 Постоянная мерцательная аритмия. Контроль за сердечным ритмом
- •Рекомендации акк/аас/еко по профилактической фармакотерапии для поддержания синусового ритма.
- •Глава 8. Антитромботическая терапия у больных с фибрилляцией предсердий
- •Антитромботическая терапия у больных с фибрилляцией предсердий
- •Глава 9. Рекомендуемые стратегии лечения
- •Глава 10. Непрямые антикоагулянты
- •Глава 11. Правила назначения антитромботической терапии
- •Глава 12. Немедикаментозное лечение
- •12.1 Рекомендации по радиочастотной аблации трепетания и фибрилляции предсердий
- •12.2 Хирургическое лечение ма
- •Рекомендуемые дозы антиаритмических препаратов для поддержания синусового ритма у больных с ма
- •Алгоритм стартового лечения варфарином
- •Антиаритмические препараты для контроля чсс у больных с фп
Глава 2. Распространенность и заболеваемость мерцательной аритмии
ФП часто встречается в клинической практике. Доля ее среди причин госпитализаций по поводу НРС составляет примерно 1/3. Распространен-ность ФП в общей популяции составляет 1-2%. С возрастом (старше 80 лет) частота встречаемости увеличивается до 8%. В проспективных исследова-ниях заболеваемость ФП увеличивалась с менее 0,5% в год у людей в воз-расте до 40 лет до более 5% - 15% в год в возрасте старше 80 лет. За пос-ледние 20 лет частота госпитализаций по поводу ФП возросла на 66% в результате старения населения, увеличения распространенности хронических заболеваний сердца. Проблему раннего распознавания ФП значительно осложняют бессимптомные формы, которые встречаются примерно у 1/3 пациентов. В Европе распространенность ФП за следующие 50 лет на фоне постарения населения удвоится.
У мужчин распространенность ФП, скорректированная по возрасту, значительно выше, чем у женщин. Медиана возраста больных ФП составляет около 75 лет. Примерно 60% больных в возрасте старше 75 лет женщины.
ФП ассоциируется с увеличением риска развития инсульта, хрони-ческой сердечной недостаточности (ХСН) и общей смертности, особенно у женщин. По данным Фремингемского исследования, МА повышает относи-тельный риск смерти от сердечнососудистых причин у мужчин в 2 раза, а у женщин - в 2,7 раза. ФП часто развивается на фоне органических заболе-ваний сердца, хотя у значительной части больных признаки поражения сердца выявить не удается. В эпидемиологических исследованиях доля паци-ентов без заболеваний сердца в анамнезе среди больных ФП не превышает 12%. Однако в некоторых исследованиях доля пациентов с изолированной ФП превышала 30%. ФП увеличивает риск инсульта в 5 раз, а каждый пятый инсульт развивается на ее фоне. У больных с ФП летальность примерно в 2 раза выше, чем у пациентов с синусовым ритмом, и зависит от тяжести заболевания сердца.
2.1 Патогенез фибрилляции предсердий
ФП - это наджелудочковая тахикардия (НЖТ), которая характеризуется нескоординированной активацией предсердий и в последующем нарушением их механической функции. У больных ФП чаще всего обнаруживают фиброз и уменьшение мышечной массы предсердий. Однако фиброз может предшествовать аритмии и развиться в результате апоптоза (структурное ре-моделирование предсердий на фоне органических заболеваний), который приводит к замещению миоцитов предсердий. Это приводит к электрической диссоциации мышечных пучков и неоднородности проведения, которые спо-собствуют развитию и сохранению ФП. Дилатация предсердий активирует различные сигнальные пути, включая РААС. Активация ангиотензина II происходит в ответ на растяжение, и в ткани предсердий больных с персистирующей ФП отмечается повышенная экспрессия АПФ. Подавление ангиотензина II может препятствовать развитию ФП за счет уменьшения фиброза. Полагают, что фиброз способствует развитию персистирующей ФП. Накапливаются данные, подтверждающие важность РААС в патогенезе ФП и лечение антагонистами ангиотензина II снижает частоту ФП после кате-терной абляции в клинических исследованиях.
Механизмы развития фибрилляции предсердий.
Имеющиеся данные свидетельствуют о наличии очаговых триггеров ФП (повышенный автоматизм или множественные очаги циркуляции возбуждения re-entry), которые не исключают друг друга и могут сочетаться.
Электро-анатомические изменения обуславливают появление множест-венных очагов циркуляции возбуждения, которые стабилизируют аритмию. Идентификация и аблация эктопических очагов позволяют ликви-дировать ФП, что подтверждает их роль в развитии аритмии. Источником ФП чаще всего являются изменения легочных вен, хотя очаговые изменения находили также в верхней полой вене, связке Маршалла, задней стенке левого предсердия, пограничном гребне (crista terminalis) и коронарном синусе. При гистологических исследованиях ткань мышцы сердца с неизмененной электрической активностью обнаруживали в легочных венах. Роль легочных вен как триггера ФП послужила основанием для изучения их анатомических и электрофизиологических свойств. Ткань предсердий в легочных венах у больных с ФП характеризуется более коротким рефрактерным периодом по сравнению с таковым у пациентов контрольной группы и по сравнению с тканью в других участках предсердий у больных с ФП. Неоднородность проведения может способствовать возникновению циркуляции возбуждения и является субстратом для развития постоянной ФП. В случае циркуляции возбуждения мелкие волны беспорядочно повторно входят в миокард, в кото-ром ранее уже вызвали возбуждение эти и другие мелкие волны. Число волн в определенный момент времени зависит от рефрактерного периода, массы и скорости проведения в различных частях предсердий.
Большая масса предсердия в сочетании с коротким рефрактерным периодом и замедленным проведением приводит к увеличению числа мелких волн и способствует развитию стойкой ФП. Существование этого механизма подтверждается результатами одновременной регистрации электрической активности с помощью нескольких электродов. Хотя циркуляцию возбуж-дения долгое время считали основным механизмом развития ФП, результаты экспериментальных и клинических исследований позволили подвергнуть сомнению эту точку зрения. У больных с идиопатической пароксизмальной ФП распространенные изменения электрокардиограмм правого предсердия предшествуют развитию ФП, что указывает на роль патологического субстрата в сохранении аритмии. Более того, у больных персистирующей ФП, у которых восстанавливается синусовый ритм, внутрипредсердное проведение замедлено по сравнению с контролем, особенно у пациентов с персистирующей ФП. Многие из этих изменений обнаруживали до появ-ления ФП, поэтому их нельзя связать с ремоделированием предсердий, происходящим вследствие ФП. Вопрос о том, какой вклад вносят изменения архитектуры предсердий в развитие и сохранение ФП, остается нерешенным.
Частота желудочкового ритма зависит от электрофизиологических свойств атриоветрикулярного узла (АВУ) и других проводящих тканей, то-нуса симпатической и парасимпатической систем, наличия дополнительных путей проведения (ДПП) и действия лекарственных средств. При наличии атриовентрикулчрной блокады (АВБ) желудочковые комплексы могут возникать регулярно (одинаковые интервалы RR). Стойкая тахикардия с не-регулярно возникающими широкими комплексами QRS характерна для ФП, возникающей на фоне наличия ДПП или блокады ножек пучка Гиса. Проведение возбуждения по ДПП может вызвать опасное увеличение часто--ты желудочкового ритма у больных с ФП и привести к выраженной тахика-рдии, переходящей в фибрилляцию желудочков (ФЖ). Очень высокая ЧСС (200 в мин и более) свидетельствует о наличии ДПП. Препараты, увеличи-вающие рефрактерный период и замедляющие проведение через АВУ (сердечные гликозиды, верапамил, дилтиазем) не влияют на проведение по ДПП и могут вызвать увеличение частоты желудочкового ритма, со-ответственно в данной ситуации эти препараты противопоказаны.
ФП может сочетаться с ТП или предсердной тахикардией. При ТП наЭКГ определяются пилообразные регулярные зубцы F, которые лучше видны в отведениях II, III, aVF и VI. Частота предсердных зубцов составляет 240-320 в мин. В отведениях II, III, aVF зубцы F являются инвертированными, а вVI - положительными. ТП может перейти в ФП и наоборот. Очаговые предсердные тахикардии и узловые тахикардии по типу re-entry могут индуцировать развитие ФП. В этих случаях обычно опреде-ляются зубцы Р, морфология которых позволяет определить происхождение аритмии.
Патофизиологические изменения, развивающиеся вследствие ФП.
Фармакологическая или электрическая кардиоверсия болееэффективна, если ФП сохраняется менее 24 ч., в то время как длительное сохранение аритмии снижает вероятность восстановления синусового ритма. На этом основании был сделан вывод о том, что «фибрилляция предсердий, сохраняет фибрилляцию предсердий». В эксперименте на овцах, когда использовали автоматическую электростимуляцию предсердий, которая вызывала развитие ФП при спонтанном восстановлении ритма, то первоначально пароксизмы проходили самостоятельно. Однако повторные эпизоды аритмии становились все более продолжительными. В конечном итоге ФП персистировала и сопровождалась более высокой активацией предсердий. Увеличение длитель-ности эпизодов ассоциировалось с нарастающим укорочением эффективного рефрактерного периода. Этот феномен называют электрофизиологическим ремоделированием. В первые несколько дней после развития ФП отмечаются изменения электрофизиологических свойств предсердий, происходит укоро-чение эффективного рефрактерного периода. Электрическое ремоделирова-ние способствует сохранению ФП в течение первых дней.
Нарушается также и сократительная функция предсердий. Основными клеточными механизмами сократительной дисфункции считают снижение поступления ионов кальция в клетки, нарушение выделения ионов кальция из внутриклеточных депо и нарушение обмена энергии в миофибриллах. Для нормализации сократимости предсердий может потребоваться от нескольких дней до нескольких недель после восстановления ритма.
Рисунок 3
Основные электрофизиологические механизмы развития ФП.

ФП. (А) Эктопическая активация. Триггер (обозначен звездочкой)часто находится в области легочных вен. (В) Циркуляция возбуждения (re-entry). LA - левое предсердие
RA - правое предсердие, PVs - легочная вена, ICV - нижняя полая вена, SCV -верхняя полая вена
Рисунок 4
С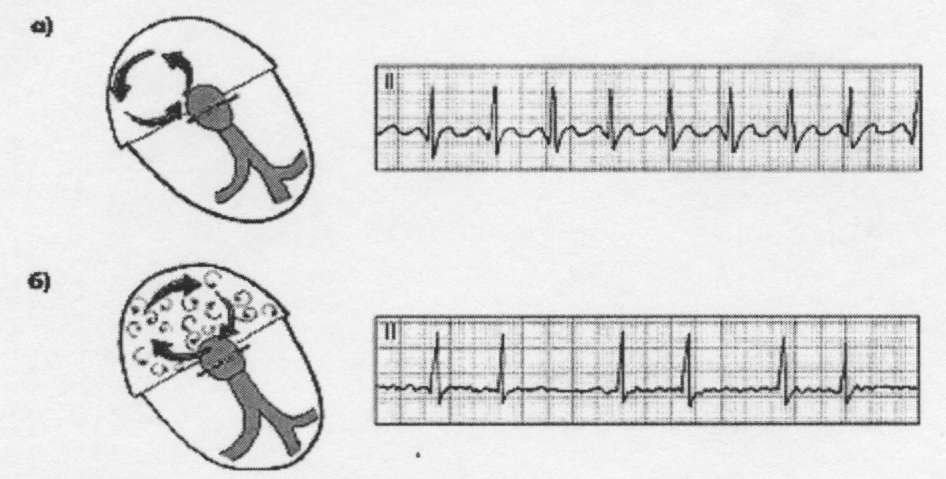 хема
возникновения круговой волны возбуждения
(re-entry)при
трепетинаа и фибрилляции предсердий
хема
возникновения круговой волны возбуждения
(re-entry)при
трепетинаа и фибрилляции предсердий
Возникновение круговой волны re-entry при трепетании (а) и фибрилляции (б) предсердий. Справа — ЭКГ, типичные для этих нарушений ритма.
