
- •Міністерство освіти і науки україни
- •Кафедра інфекційних хвороб і епідеміології
- •Методичні вказівки до засвоєння практичних навичок з діагностики та лікування інфекційних хвороб
- •Для лікарів, лікарів-інтернів, студентів старших курсів вищих медичних закладів освіти ііі-іv рівнів акредитації
- •Проведення алергічних проб
- •Шкірна алергічна проба з алергеном токсоплазми (для діагностики токсоплазмозу)
- •Шкірна алергічна проба з туберкуліном (при туберкульозі)
- •Шкірна алергічна проба з тулярином (при туляремії)
- •Шкірна алергічна проба з антраксином (при сибірці)
- •Методика введення лікувальних сироваток
- •Забір крові на гемокультуру
- •Забір крові на стерильність
- •Забір крові для серологічних досліджень
- •Забір крові для біохімічного дослідження
- •Дослідження крові на малярійний плазмодій
- •Забір матеріалу (сеча, випорожнення, жовч) для бактеріологічного дослідження
- •Забір матеріалу для дослідження на віруси
- •Люмбальна пункція
- •Промивання шлунка
- •Фракційне дуоденальне зондування
- •Промивання кишечника
- •Катетеризація сечового міхура
- •Визначення жовчних пігментів у сечі (проба розіна)
- •Ректороманоскопія
- •Овоскопія калу
- •Швидкі лабораторні тести для експрес-діагностики інфекційних хвороб
- •3 Краплі сироватки або плазми додати у кожну лунку
- •Методика визначення групи крові
- •Методика Визначення резус-фактора
- •Показання до госпіталізації хворих у стаціонар
- •Непрямий (закритий) масаж серця Показання:
- •Протипоказання:
- •Техніка проведення:
- •Критерії ефективності.
- •Ускладнення.
- •Інтубація трахеї
- •Штучна вентиляція легень
- •1. Закидання голови
- •Ускладнення та їх усунення
- •Вентиляція приладом “маска-мішок”
- •Пункція плевральної порожнини
- •Пункція бубонУ
- •Список літератури
Забір крові для біохімічного дослідження
Мета: дослідження вмісту білірубіну і його фракцій, активності ферментів, флокулярних проб та інших біохімічних показників, які мають вирішальне значення в діагностиці вірусного гепатиту, а також для оцінки функціонального стану печінки, нирок та інших органів при різноманітній патології.
Оснащення: гумові рукавички, захисні окуляри, спирт, вата, голки, хімічно чистий посуд.
Методика: забір крові для біохімічного дослідження проводиться натще із вени в кількості 5-10 мл (у хімічно чисті пробірки, стерильність не потрібна). Забір може здійснюватися шприцом. При цьому кров повинна стікати по стінці посудини, а не капати, тому що при поштовхах можливе руйнування еритроцитів з подальшою зміною показників. Голки та шприци повинні бути сухими, тому що можливий гемоліз. Подальше дослідження проводиться в біохімічній лабораторії.
Дослідження крові на малярійний плазмодій
Мета: визначення малярійного плазмодія в крові (в «товстій» краплі чи мазку) дозволяє підтвердити діагноз малярії та визначити вид збудника.
Оснащення: гумові рукавички, захисні окуляри, спирт, ефір, вата, одноразові голки або голки-скарифікатори, предметні скельця, реактиви для забарвлення за Романовським.
Методика: перед забором крові палець обробляють спиртом та ефіром. Після проколу пальця першу краплю крові витирають сухою марлевою серветкою. Для отримання «товстої» краплі до знов виступаючої краплі крові торкаються сухим знежиреним склом у 2-3 місцях та розмазують кожен з утворених відбитків коловими рухами до діаметру 1-1,5 см (можна кутом іншого скла). “Товсту” краплю перед забарвленням не фіксують, висушувати потрібно поступово (без дії сонця та підігріву). Забарвлюють протягом 20-25 хв 4-5 % водним розчином фарби Романовського. Тонкі мазки перед забарвленням обов’язково фіксують протягом 3-5 хв в етиловому або метиловому спирті. Цитоплазма плазмодія забарвлюється в блакитний колір, ядро у вишнево-червоний. У препаратах можна побачити малярійні плазмодії на різних стадіях розвитку, при цьому в «товстій» краплі виявляється значно більша кількість паразитів, що полегшує їх знаходження. Уточнення виду плазмодія можливе тільки за мазком, для цього необхідно знати форму та розміри еритроцитів, кількість паразитів у еритроцитах.
В
А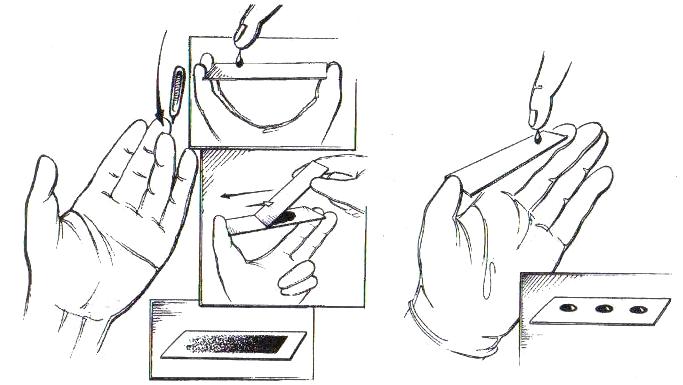
Забір матеріалу (сеча, випорожнення, жовч) для бактеріологічного дослідження
Мета: виявлення збудника та виділення його в чистій культурі з різних біосубстратів від хворого є підтвердженням діагнозу цілої низки інфекційних захворювань. При черевному тифі збудник може бути знайдений у крові, сечі, випорожненнях, жовчі; при шигельозі, ешерихіозі, сальмонельозі, холері – з випорожнень, блювотиння і т.п.
Оснащення: гумові рукавички, захисні окуляри, стерильний посуд для забору матеріалу, ватні тампони, металеві петлі, консерванти, спиртівка та живильні середовища для вирощування збудника.
Методика: для отримання вірогідних результатів бактеріологічного дослідження необхідно дотримуватися таких правил:
забір матеріалу проводити до початку етіотропної терапії або після її закінчення (не раніше ніж через 48 годин);
у посуді для збору матеріалу не повинно бути навіть слідів дезінфікуючих речовин (з цією метою судна, горщики, банки і т.п. обробляють кип’ятінням або сухим жаром);
посів на живильні середовища бажано проводити біля ліжка хворого;
за неможливості доставки матеріалу в бактеріологічну лабораторію в перші три години після забору необхідно використовувати консерванти (наприклад, для випорожнень суміш гліцерину та фізіологічного розчину в співвідношенні 3:7) чи зберігати матеріал у холодильнику (+4 °С).
Випорожнення для бактеріологічного дослідження збирають після акту дефекації в чисте судно або горщик, звідки за допомогою стерильного шпателя в кількості 3-5 г переносять у стерильну пробірку. Забір матеріалу може бути здійснений під час ректороманоскопії. В усіх випадках необхідно направляти для дослідження не лише випорожнення, а також патологічні домішки (слиз, гній) у них.
Сечу для бактеріологічного дослідження забирають у стерильну пробірку в кількості 10-20 мл після попередньої обробки зовнішніх статевих органів. У чоловіків можливий забір сечі під час природного сечовипускання, у жінок – за допомогою стерильного катетера.
Жовч збирають під час дуоденального зондування в окремі стерильні пробірки всі порції жовчі (А, В, С) по 10-20 мл. Кінець зонда попередньо обробляють спиртом, наповнюють пробірки безпосередньо через зонд або шляхом відсмоктування жовчі з зонда стерильним шприцом. Залежно від передбаченого захворювання матеріал від хворого сіють на різні живильні середовища – прості (м’ясо-пептонний бульйон та агар), середовища збагачення (лужна пептонна вода для холерного вібріона), елективні (жовчний бульйон для сальмонел), диференційні (Ендо, Левіна, Плоскірева для кишкових бактерій).
