
3.2. Механизмы образования на поверхности кремния диэлектрических пленок
3.2.1. Этапы роста окисной пленки
Изучение кинетики возникновения и роста окисных пленок металлов и полупроводников имеет важное значение для решения ряда задач микроэлектроники, в первую очередь для создания рациональной технологии изготовления микроэлектронных активных и пассивных элементов. Диэлектрические пленки в микросхемах выполняют различные функции. Они широко применяются в качестве подзатворных диэлектриков, межслойной и межкомпонентной изоляции, пассивирующих слоев. Высокие изолирующие и стабилизирующие качества слоев двуокиси кремния определили широкое применение в полупроводниковой технологии.
Различают два этапа роста окисной пленки: начальный этап при низкой температуре и диффузионнный этап (высокотемпературное окисление). Начальный этап образования пленки связан с процессом перехода электронов от поверхностных атомов кристалла к адсорбированным на этой поверхности атомам кислорода. Со стороны кристалла возникает слой положительных ионов (слой, обедненный электронами), а со стороны газа - слой отрицательных ионов. В этом двойном слое появляется сильное электрическое поле, которое вызывает направленное к внешней поверхности пленки движения положительно заряженных атомов основного вещества (катионов). Катионы на поверхности пленки связываются с отрицательно заряженными атомами кислорода (анионами) и достраивают следующий слой пленки. На пленке вновь адсорбируются атомы кислорода, к которым из металла благодаря туннельному эффекту поступают электроны. Стадия формирования окисной пленки прекращается при достижении толщины пленки порядка десятка атомных слоев, что вызвано резким спадом вероятности туннельного эффекта.
В отличие от первого этапа второй этап окисления полностью определяется процессами диффузии. При высокой температуре происходит процесс диффузионного перемещения либо окисляемого вещества и электронов к поверхности раздела “окисел-газ”, либо атомов кислорода в объем основного вещества. Соответственно реакция окисления протекает либо на границе раздела “окисел-газ”, либо на границе раздела “окисел - окисляемое вещество”. В каждом конкретном случае проявляется тот или иной процесс диффузионного перемещения либо их сочетание.
3.2.2. Механизм термического окисления кремния
В настоящее время не существует законченной теории термического окисления полупроводников. Исторически сложилось так, что первые кинетические модели в этой области основывались на существовавших моделях окисления металлов.
Одной из первых кинетических моделей, успешно примененных для описания процесса окисления кремниевых пластин в температурном диапазоне 973-1573 К, при давлениях окислителя (0,2-1,0)108 Па и толщине окисных пленок >50 нм, явилась модель Дила-Гроува. Она широко использовалась а теории и практике формирования пленок диоксида кремния, но при переходе к более тонким слоям SiO2 стал особенно очевидным ее ограниченный характер
Следует иметь в виду, что перед началом высокотемпературного окисления на поверхности кремния уже имеется слой окисла некоторой малой, но конечной толщины dок, возникший в результате низкотемпературного окисления.
Процесс
окисления кремния в установившемся
режиме слагается из следующих этапов.
Молекулы окислителя (молекулы кислорода
или пары воды) адсорбируются на поверхности
двуокиси кремния, создавая концентрацию
N1.
Величина концентрации адсорбированных
частиц окислителя прямо пропорциональна
давлению газа при условии отсутствия
диссоциации или ассоциации окислителя
на поверхности. Это условие обычно
выполняется при окислении кремния.
Далее частицы окислителя диффундируют
сквозь окисный слой к границе SiO2
- Si. На границе раздела сред "окисный
слой - кремний" атомы кислорода
вступают в реакцию с атомами кремния,
в результате чего увеличивается
толщина окисного слоя. При этом в процессе
установившегося окисления
предполагается, что в слое двуокиси
кремния и на границах раздела сред
отсутствует накопление атомов окислителя.
Очевидно, что поток окислителя из одной
среды в другую возникнет только в том
случае, если существует разность
концентраций на границах фаз. Пусть в
слое окисла на границе с окружающей
средой концентрация молекул окислителя
равна N2,
а на границе раздела SiO2
- Si со стороны двуокиси кремния составляет
N3
(см. рис.3.6).
Рис. 3.6. Распределение концентрации кислорода в установившемся процессе окисления
Следует иметь в виду, что в величины указанных концентраций окислителя в окисном слое N2 и N3 не входит концентрация кислорода, вступившего в реакцию с кремнием и образовавшего химическое соединение Si2O.
Модель Дила-Гроува исходит из наличия в системе кремний-диоксид кремния-газ трех кислородосодержащих потоков (рис.3.1): J1, J2, J3.
Первый из них связан с переносом кислородосодержащих частиц в газовой среде, второй - через окисную пленку, третий - непосредственно в реакционную зону. Поток частиц окислителя от газовой среды в слой двуокиси кремния равен
J1 = h(N1 - N2), (3.34)
где h - коэффициент массопереноса кислорода через поверхность.
Внутри слоя окисла окислитель будет диффундировать к границе SiO2 - Si. Учитывая, что процесс окисления является установившимся и накопления частиц окислителя в слое окисла нет, поток окислителя в любой точке слоя окисла одинаков и равен
 ,
(3.35)
,
(3.35)
где x - толщина слоя в любой момент времени, а D - эффективный коэффициент диффузии. Следует уточнить, что диффузия в слое двуокиси кремния происходит под действием двух причин: вследствие градиента концентрации частиц, а также вследствие дрейфа в электрическом поле, созданном объемным зарядом. Объемный заряд в свою очередь создан окислителем, который диффундирует в окисле в виде молекулярных ионов. Если толщина слоя окисла больше толщины слоя объемного заряда, то эффективный коэффициент диффузии примерно в два раза больше, чем истинный коэффициент диффузии. Поток диффузанта, вступающего в реакцию с кремнием, пропорционален концентрации окислителя в слое окисла на границе раздела с кремнием:
J3 = kN3, (3.36)
где к - константа скорости реакции окисления.
В условиях равновесия все рассмотренные потоки равны, т.е
J1 = J2 = J3 = J. (3.37)
Подставляя полученные выражения для потоков в (3.37), найдем формулы для концентраций N2 и N3:
 (3.38)
(3.38)
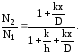 (3.39)
(3.39)
Если в уравнение (3.36) подставить выражение для N3 из (3.38), то получим формулу для потока частиц в установившемся процессе окисления:
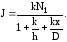 (3.40)
(3.40)
Пусть на образование единицы объема слоя двуокиси кремния идет N молекул окислителя, тогда поток J будет выражаться уравнением
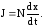 (3.41)
(3.41)
Подставляя в формулу (3.41) выражение для потока J найдем скорость роста окисного слоя
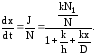 (3.42)
(3.42)
С помощью полученного уравнения можно найти зависимость толщины окисла от длительности процесса. Начальным условием для решения этой задачи является
х = х0 при t = 0. (3.43)
Для упрощения записей введем следующие обозначения:
 (3.44)
(3.44)
 (3.45)
(3.45)
Интегрирование уравнения (3.42) дает
 (3.46)
(3.46)
где t0 – смещение по оси времени, равное предполагаемой длительности роста начального слоя окисла х0 в условиях рассматриваемого процесса:
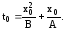 (3.47)
(3.47)
Решение уравнения (3.46) для x как функция времени записывается в виде:
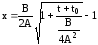 .
(3.48)
.
(3.48)
Рассмотрим предельные случаи:
1)
при больших временах окисления, когда
t>>B/(4A2) ,
в этом случае
,
в этом случае
х2 = Bt; (3.49)
уравнение (3.49) представляет собой параболический закон роста диоксида кремния, а B - параболическую константу скорости окисления;
2) другой предельный случай имеет место при малых временах окисления, когда справедливо соотношение (t + t)<< B/(4A2) и ограничиваясь первым членом разложения в ряд Тэйлора уравнения (3.48), получим
x = A ( t + t0). (3.50)
Таким образом, в начале процесса окисления рост пленки окисла описывается линейным законом, а скорость роста в этом случае, как видно из выражения (3.44), ограничивается скоростью переноса окислителя через поверхность в слой двуокиси кремния h и скоростью реакции окисления k на границе SiO2-Si. Экспериментальные исследования показывают, что величина h на несколько порядков больше величины k для реальных условий окисления. Следовательно, выражение (3.44) может быть переписано в виде Ak(N1/N).
В
промежуточном случае наблюдается
постепенный переход от линейного
закона к параболическому (рис.3.6).
Рис.3.6. Зависимость толщины слоя окисла от длительности процесса окисления: штриховыми линиями показаны параболическая и линейная зависимости
Характер линейной зависимости константы диффузии реагента В от давления паров подтверждают экспериментальные данные. В противном случае окислитель диссоциировал на поверхности. Если бы такая диссоциация на поверхности образца наблюдалась, то зависимость В от давления носила бы квадратичный характер.
Константа диффузии реагента В или соответственно параболического роста пленки окисла пропорциональна также коэффициенту диффузии D и, следовательно, должна зависеть от температуры.
Константа скорости химической реакции А на границе SiO2-Si (константа линейного роста) также зависит от температуры. Учитывая, что величины N и N1 практически не зависят от температуры, температурная зависимость константы А обусловлена зависимостью скорости реакции окисления k на границе SiO2-Si от температуры. Скорость реакции окисления определяется энергией, которую необходимо затратить для разрыва ковалентной связи атомов решетки Si-Si.
