
Решая (3.8) относительно d, находим
D = ns2/(6t). (3.9)
В выражении (3.9) величина n/t представляет собой число элементарных скачков частицы в единицу времени. Выразим ее через обратную величину:
t/n = , (3.10)
где - время между очередными скачками частицы (время ее оседлой жизни).
Подставив (3.10) в (3.9), найдем
D = s2/(6). (3.11)
Как видно из (3.11), коэффициент D представляет собой отношение квадрата длины элементарного скачка к времени оседлой жизни частицы, отнесенное к одному из шести возможных направлений ее хаотического блуждания. Если длину элементарного скачка частицы выразить в сантиметрах, а среднее время ее оседлой жизни - в секундах, то этот коэффициент приобретает размерность см2/с. Таким образом он показывает, как быстро со временем смещаются хаотически блуждающие частицы. Тем самым он служит фундаментальной характеристикой элементарного акта хаотической самодиффузии как события, отображающего динамику разупорядочения кристалла, связывая это событие со временем.
В разных по своей природе кристаллах вероятность таких событий, конечно, различна. Таким образом, коэффициент хаотической самодиффузии можно определить как величину, характеризующую способность атомов данного вещества к взаимному перемешиванию.
Среднее время нахождения атома в одном из положений равновесия
t = 1/W = t0 exp[E/(k T)]. (3.12)
Здесь t0 - постоянная, соизмеримая с периодом собственных колебаний атомов в узлах решетки (~ 10-13 с).
С учетом (3.12) выражение для коэффициента диффузии может быть представлено в виде
D = Do exp[-E/(kT)], (3.13)
где D0 = k0s2/t0; k0 - коэффициент, зависящий от структуры кристалла и механизма диффузии. Для объемно-центрированной кубической решетки при диффузии по вакансиям k0 = 1/8, a при диффузии по междоузлиям k0 = 1/24.
Выражение (3.13) справедливо для процессов самодиффузии и диффузии примесных атомов как по вакансиям, так и по междоузлиям кристаллической решетки и было получено шведским ученым Свенте Аррениусом. Поэтому его часто называют уравнением Аррениуса.
Механизмы диффузии различных элементов определяются главным образом типом твердого раствора, который они образуют в кристаллической решетке, т.е. тем, располагаются ли примесные атомы в узлах или междоузлиях кристаллической решетки (твердые растворы замещения или внедрения соответственно) или образуют растворы смешанного типа (атомы размещаются по узлам и междоузлиям).
При диффузии примесных атомов по вакансиям одновременно протекает процесс самодиффузии. Однако этот процесс идет значительно медленнее, так как химическая связь между атомами вещества сильнее связи примесных атомов с решеткой.
Механизмы диффузии примесных атомов в кристаллической решетке при изменении температуры и концентрации примеси может изменяться. В промежуточной переходной области возможна диффузия по обеим механизмам. При изменении механизма диффузии изменяются и параметры k0, D0, E, D.
Существенное влияние на скорость диффузии оказывают атомы примеси и другие дефекты, присутствующие в кристалле. Локальная деформация решетки вблизи примесного атома приводит к уменьшению энергии связи между соседними атомами, что увеличивает вероятность образования вакансий. При вакансионном механизме диффузии это приводит к увеличению скорости диффузии. Энергия активации процесса диффузии может изменяться также вследствие кулоновского взаимодействия между атомами диффузанта и присутствующей в решетке примеси. Так, в германии и кремнии наличие акцепторной примеси ускоряет, а наличие донорной примеси замедляет процесс диффузии атомов донора.
Скорость диффузии примесей в полупроводниках обратно пропорциональна их предельной растворимости. Высокая растворимость примесей наблюдается в случае образования твердых растворов замещения. В случае когда атомы примесей в силу их слабой связи с решеткой не могут замещать узлы, образуются твердые растворы внедрения, область растворимости сужается, так как в междоузельном пространстве может разместиться меньшее количество атомов. Скорость же диффузии примесей по междоузлиям значительно выше скорости диффузии по вакансиям решетки.
Однако во многих случаях введение инородных атомов приводит к возникновению в диффузионной области новой фазы (химического соединения) с другой структурой и другими физическими свойствами, чем основное вещество. Такой процесс получил название “реактивная диффузия”. Возникновение новой фазы приводит к замедлению процесса диффузии по следующим причинам. Поскольку диффундирующие атомы связываются с атомами основного вещества, то происходит постепенное уменьшение диффузионного потока. Кроме того, с ростом толщины слоя новой фазы увеличивается путь, по которому должны проходить диффундирующие атомы, чтобы проникнуть в объем основного вещества.
3.1.2. Физико-математические основы процессов диффузии
Законы фика. При диффузии в изотропной среде, обусловленной только градиентом концентрации и при условии независимости коэффициента диффузии от концентрации, выражение для потока диффундирующего вещества (примеси) имеет следующий вид:
J = - D grad N, (3.14)
где J - вектор плотности потока диффундирующего вещества, т.е. количество вещества, проходящего за единицу времени через единичную площадь поверхности, перпендикулярной направлению перемещения вещества; D - коэффициент диффузии; N - концентрация атомов диффундирующего вещества.
Знак минус в выражении (3.14) указывает, что диффузионный перенос вещества происходит в направлении уменьшения концентрации примеси.
Когда концентрация вещества изменяется лишь в направлении оси Х, поток
J(x) = - D (dN/Dx). (3.15)
Здесь dN/dx - градиент концентрации диффундирующего вещества. Выражение для скорости накопления диффундирующего вещества может быть получено из (3.15) и принципа сохранения, согласно которому изменение концентрации вещества в определенном объеме должно быть равно соответствующему потоку его в данный объем:
dN/dt = - dJ/dx . (3.16)
При подстановке (3.15) в (3.16) получаем для одномерного случая
 (3.17)
(3.17)
Когда коэффициент диффузии можно считать постоянным, выражение (3.17) может быть записано как
 .
(3.18)
.
(3.18)
Выражения (3.14) - (3.18) впервые были получены в 1885 г. швейцарским ученым Фиком для описания диффузионных процессов в идеальных газах и растворах. В дальнейшем была показана применимость установленных законов для описания процессов диффузии в твердых телах. Уравнения (3.14) и (3.18) носят названия первого и второго законов Фика соответственно.
На основании этих законов при заданных начальных и граничных условиях, а также при известном коэффициенте диффузии могут быть решены задачи нахождения: распределения примеси; потока вещества через заданную поверхность, количества продиффундировавшего вещества и др.
Решение уравнения диффузии (3.18) для неограниченного тела при заданном в общем виде начальном распределении примесей
N(x,0) = f(x) (3.19)
находят методом разделения переменных. Если концентрацию N(x,t) представить как произведение двух функций, каждая из которых зависит только от одной переменной N(x,t) = T(t)X(x), то выражение (3.18) принимает вид
 (3.20)
(3.20)
или
 .
(3.21)
.
(3.21)
Так как левая часть равенства (3.21) не зависит от х, а правая - от t , то они должны быть тождественно равны некоторой постоянной отрицательной величине, которую обозначим -2.
В результате получим дифференциальные уравнения
dT/T = - 2Ddt ,
(3.22)
d2X/dx2 = - 2 X ,
общее решение которых имеют вид
 (3.23)
(3.23)
где - текущая координата интегрирования.
Наиболее часто при расчете распределения концентрации примеси приходится решать уравнения диффузии в тело, ограниченное плоскостью Х = 0.
Диффузия в полуограниченное тело из постоянного источника. Важное практическое значение имеет случай, когда на границе полубесконечного кристалла поддерживается постоянная концентрация диффундирующей примеси. Начальная концентрация во всем полуограниченном теле равна нулю. Граничные условия для этого случая
N(0,t) = N0. (3.24)
Решение уравнения диффузии для этого случая имеет вид
 ,
(3.25)
,
(3.25)
где символ erfc означает дополнение (до единицы) функции ошибок
 ,
(3.26)
,
(3.26)
а erfc z обозначает интеграл функции ошибок Гаусса
 .
(3.27)
.
(3.27)
Величину ,
имеющую размерность длины, называют
диффузионной длиной.
,
имеющую размерность длины, называют
диффузионной длиной.
Из выражения (3.25) следует, что заданное распределение примеси можно получить при различных сочетаниях значений D (т.е. температуры) и времени. Кроме того, величина температурно-временного воздействия (Dt) определяет при постоянной концентрации количество примеси, введенное в кристалл, т.е. дозу легирования (рис. 3.3).
Во многих практических случаях важно знать количество диффузанта (дозу легирования), проникшего в тело за время проведения диффузии. Эта величина может быть определена по формуле
 ,
(3.28)
,
(3.28)
где J(0,t) – поток диффузанта в объем тела через плоскость х=0, равный
 .
(3.29)
.
(3.29)
Подставляя (3.25) в (3.29), получим
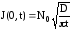 .
(3.30)
.
(3.30)
Интегрируя полученное выражение по времени, найдем
 .
(3.31)
.
(3.31)

Рис.3.3. Распределение примеси при диффузии из постоянного источника в полуограниченное тело при различных значениях Dt: 1 – Dt=0; 2 – Dt=1; 3 – Dt=4; 4 – Dt=16; 5 – Dt=
Диффузия из слоя конечной толщины в полуограниченное тело. Допустим, что в слое толщиной h, примыкающей к границе полуограниченного тела, имеется равномерно распределенная примесь с концентрацией N0, а во всей остальной части тела при x>h концентрация примеси равна нулю. Будем считать, что поток примеси через границу х=0 отсутствует. Такие границы принято называть отражающими. Примером отражающей границы может служить поверхность кристалла кремния, покрытого слоем двуокиси кремния. Поскольку коэффициент диффузии большинства диффузантов в двуокиси кремния на несколько порядков меньше, чем в кристалле кремния, то проникновением примеси в слой двуокиси кремния практически можно пренебречь.
Распределение примеси в любой момент времени для этого случая выражается формулой
 .
(3.32)
.
(3.32)
Графики этого распределения приведены на рис.3.4. В отличие от предыдущих случаев в данном случае диффузия ведется из ограниченного источника диффузанта. Количество диффузанта, равное Q=N0h, в процессе диффузии остается неизменным. Происходит лишь перераспределение этого диффузанта по объему тела.
Диффузия из бесконечно тонкого слоя (ограниченный источник) в полуограниченное тело. Если в предыдущем случае устремить толщину слоя h к нулю, то получим распределение примеси при диффузии из бесконечно тонкого слоя в полуограниченное тело с отражающей границей. Если полагать, что с устремлением h0 количество диффузанта Q в слое остается неизменным (за счет соответствующего роста N0), то распределение примеси запишется так:
 .
(3.33)
.
(3.33)
Полученная функция известна под названием “распределение Гаусса”. На рис. 3.5 приведены кривые этого распределения для нескольких значений Dt.
Двухстадийная диффузия. Диффузия из постоянного источника является реальным случаем в производстве интегральных схем и представляет собой первый этап диффузии, задачей которого является введение в кристалл определенного количества примеси. Для уменьшения температурного воздействия (уменьшения фактора Dt) поверхностную концентрацию выбирают максимально возможной, т.е. соответствующей предельной растворимости примеси при выбранной температуре диффузии. В результате образуется тонкий приповерхностный слой, насыщенный примесью. В производстве этот этап нередко называют загонкой примеси.

Рис.3.4. Распределение примеси при диффузии из слоя конечной толщины h при различных значениях Dt: 1 – Dt=0; 2 – Dt=1/16; 3 – Dt=1/4; 4 – Dt=1; 5 – Dt=4

Рис.3.5. Распределение примеси при диффузии из бесконечно тонкого слоя в полуограниченное тело при различных значениях Dt: 1 – Dt=1/16; 2 – Dt=1/4; 3 – Dt=1
Для окончательного формирования диффузионной области введенную на первом этапе примесь подвергают перераспределению. Этот второй этап диффузии, называемый разгонкой примеси, соответствует диффузии из ограниченного источника примеси.
В этом случае примесь диффундирует из поверхностного слоя кремния вглубь, тогда как поступление примеси из окружающей среды отсутствует. При этом поверхностная концентрация No с течением времени убывает.
Следует иметь в виду, что последующие операции обработки ИС, связанные с нагревом (диффузия, окисление и т.п.), влекут за собой продолжение диффузии примеси. Поэтому в выражение для распределения Гаусса вместо Dt должна входить сумма Diti, где Di - коэффициент диффузии примеси для температуры, при которой выполняется i-я операция; ti - время выполнения i-ой операции (i=1,2,..n); n - число операций, связанных с последующим нагревом пластины (включая рассматриваемый этап разгонки примеси).
