
- •Министерство образования и науки рф
- •Иркутский государственный технический университет
- •Введение
- •Краткие методические указания к выполнению лабораторных работ
- •Термохимия Теоретическое введение
- •Определение константы калориметра и теплоты нейтрализации
- •Теоретические основы второй части работы
- •Определение средней теплоемкости вещества
- •Теоретические основы работы
- •Равновесие жидкость-пар: давление насыщенного пара жидкостей Теоретическое введение
- •Определение давления насыщенного пара индивидуальной жидкости
- •Порядок выполнения работы
- •Физико-химический анализ Теоретическое введение
- •Визуально-политермический метод
- •Термографический метод
- •Контрольные вопросы
- •Построение диаграммы плавкости бинарной системы фенол −нафталин термографическим методом
- •Теоретические основы работы
- •Порядок выполнения работы
- •Методика экспериментального определения электрической проводимости растворов
- •Удельная электрическая проводимость растворов хлорида калия при различных температурах, См∙см-1
- •Определение постоянной электролитической ячейки
- •Экспериментальные данные по измерению сопротивления стандартных растворов хлорида калия
- •Определение удельной электропроводности, константы и степени электролитической диссоциации слабого электролита
- •Результаты опыта и расчетные величины
- •Электродное равновесие Теоретическое введение
- •Методика измерения эдс
- •Определение стандартного потенциала ферри-ферро электрода
- •Порядок выполнения работы
- •Формальная кинетика химических реакций Краткое теоретическое введение
- •Изучение зависимости скорости химической реакции от температуры
- •Этилацетата щелочью
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Изменения относительного количества реагентов
- •Порядок выполнения работы
- •Соотношения объемов растворов в опытах и экспериментальные данные
- •Контрольные вопросы
- •Определение константы скорости гетерогенной реакции
- •Экспериментальные и расчетные данные
- •Не забывать после каждого отбора пробы опускать брусок мрамора в раствор так, чтобы площадь контакта его с раствором оставалась постоянной
- •Краткое описание метода
- •Краткое описание методов
- •Термодинамика поверхностных явлений. Адсорбция Теоретическое введение
- •Поверхности и в глубине фазы
- •Определение поверхностного натяжения и расчёт характеристик адсорбционного мономолекулярного слоя
- •(См. Теоретическое введение)
- •Метод максимального давления пузырька
- •Методом максимального давления пузырьков
- •Порядок выполнения работы
- •Работа 11 определение величины адсорбции
- •Теоретические основы работы
- •П орядок выполнения работы
- •Дисперсные системы Теоретическое введение
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •Получение дисперсных систем
- •Р ис. 33. Строение мицеллы золя AgI
- •Порядок выполнения работы
- •Зависимость показателя степени п при длине волны λ от размера частиц r
- •Порядок выполнения работы
- •Седиментационный анализ грубодисперсных систем
- •Теоретические основы работы
- •Порядок выполнения работы
- •Электрокинетические явления Теоретическое введение
- •Электрического напряжения
- •Электрофорез в золе гидроксида железа
- •Теоретические основы работы См. Теоретическое введение – Электрокинетические явления
- •Порядок выполнения работы
- •Мицеллярнорастворимые поверхностно-активные вещества Теоретическое введение
- •Определение критической концентрации мицеллообразования в растворах поверхностно-активных веществ
- •Библиографический список
Э
Рис. 39. а – схема установки для электрофореза; б – схема движения отрицательно заряженных частиц глины в жидкости под действием постоянного
Электрического напряжения
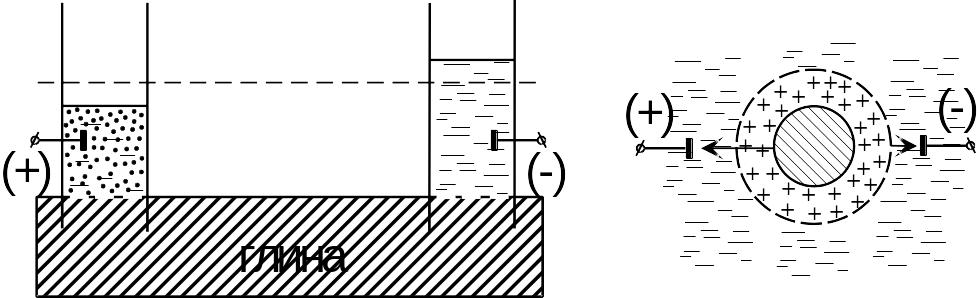 лектрофорез.
Во влажную глину помещаются две стеклянные
трубки с электродами и заливается вода
(Рис. 39, а). При подведении постоянного
электрического напряжения в трубке с
анодом вода постепенно мутнеет, в то
время как в трубке с катодом вода остаётся
прозрачной. Это объясняется тем, что
частицы глины в контакте с водой
заряжаются отрицательно и под действием
постоянного электрического поля в
жидкости перемещаются к положительному
электроду (Рис. 39, б).
лектрофорез.
Во влажную глину помещаются две стеклянные
трубки с электродами и заливается вода
(Рис. 39, а). При подведении постоянного
электрического напряжения в трубке с
анодом вода постепенно мутнеет, в то
время как в трубке с катодом вода остаётся
прозрачной. Это объясняется тем, что
частицы глины в контакте с водой
заряжаются отрицательно и под действием
постоянного электрического поля в
жидкости перемещаются к положительному
электроду (Рис. 39, б).
Следует отметить, что положительно заряженные ионы диффузного слоя будут двигаться в противоположном направлении и создавать электрофоретическое торможение. Следовательно, электрофорез - это явление перемещения частиц дисперсной фазы в жидкости под действием постоянного электрического напряжения.
Потенциалы течения и седиментации по причинно-следственной связи являются противоположными по отношению к электроосмосу и электрофорезу. Потенциал течения – это явление возникновения разности потенциалов при движении жидкости через пористое тело. Потенциалом седиментации называют явление появления разности потенциалов при движении твердых частиц в жидкости.
РАБОТА 15
Электрофорез в золе гидроксида железа
Цель работы: исследование электрофореза в золе гидроксида железа и расчёт электрокинетического потенциала.
Теоретические основы работы См. Теоретическое введение – Электрокинетические явления
О дна
из возможных записей строения мицеллы
золя Fe(OH)3
представляется
дна
из возможных записей строения мицеллы
золя Fe(OH)3
представляется
М
 ицелла
является образованием сферическим.
Коллоидная частица, представляющая
собой микрокристаллик, заряжена
положительно, а диффузный слой несёт
избыточный отрицательный заряд (Рис.
40, а).
ицелла
является образованием сферическим.
Коллоидная частица, представляющая
собой микрокристаллик, заряжена
положительно, а диффузный слой несёт
избыточный отрицательный заряд (Рис.
40, а).
Изменение скачка потенциала в двойном электрическом слое мицеллы с расстоянием х показано на рис. 40, б. Суммарный электрический потенциал ψ0 складывается из скачка потенциала в плотной части ДЭС толщиной, равной диаметру иона di ; величина этого потенциала обозначена ψq. В диффузной области ДЭС толщиной δ имеет место скачок потенциала ψδ, называемый диффузным потенциалом. Поэтому суммарный скачок потенциала запишется ψ0 = ψq.+ ψδ.
Однако ионы, находящиеся на некотором расстоянии от плотного слоя di в сторону диффузного слоя δ, ещё сохраняют неподвижность до так называемой границы скольжения фаз. За пределами границы скольжения фаз противоионы коллоидной частицы находятся в подвижном состоянии. Скачок потенциала, возникающий в диффузной области ДЭС на границе скольжения фаз, называют электрокинетическим, или ζ– потенциалом. Электрокинетический потенциал играет важнейшую роль при рассмотрении вопроса об устойчивости и коагуляции гидрофобных золей. На практике ζ– потенциал определяют по скорости перемещения частиц дисперсной фазы в электрическом поле.
Приборы и материалы: Прибор для проведения электрофореза, выпрямитель постоянного тока с вольтметром , золь Fe(OH)3, 0,01М КСl.
Порядок выполнения работы
Электрофорез золя гидроксида железа проводится на приборе, изображённом на рис. 41.
1. U –образную трубку 1 для проведения электрофореза промыть дистиллированной водой.
2. При закрытом кране 3 в сосуд 2 залить золь Fe(OH)3.,
3
Рис. 41. Схема прибора для проведения электрофореза
 .
Приоткрыв кран впустить золь до его
появления в просвете нижней части U
- образной трубки. Кран 3 закрыть
.
Приоткрыв кран впустить золь до его
появления в просвете нижней части U
- образной трубки. Кран 3 закрыть
.4. В U - образную трубку залить раствор 0,01 М КСl примерно на половину её высоты. Электроды 4 зачистить наждачной бумагой и поместить их в колена трубки. Электроды подсоединить к источнику постоянного тока.
5. Снова открывая кран 3 , медленно впустить золь Fe(OH)3 в U - образную трубку столько, чтобы электроды погрузились в раствор КСl примерно на один сантиметр. Между окрашенным золем и раствором хлорида калия должна быть чёткая граница раздела.
По шкале 5 записать положение границы раздела фаз.
6. Включить на 10-15 минут прибор постоянного тока. Напряжение отметить по вольтметру. Оно должно находиться в пределах 110-130 В.
7. По окончанию электрофореза отключить прибор. По шкале 5 отметить смещение границы раздела фаз в левом и правом коленах. Измерить расстояние между электродами по всей длине U –образной трубки.
Открыв краны 3 и 6, слить растворы. Результаты опыта показать преподавателю по форме:
Время τ, сек. |
Расстояние S, пройденное золем, м |
Напряжение на электродах V, В |
Расстояние между электродами L, м |
|
|
|
|
8 .
Рассчитать следующие величины:
.
Рассчитать следующие величины:
а) градиент потенциала
б )
электрофоретическую скорость
)
электрофоретическую скорость
в) электрокинетический потенциал
г
В
де η – вязкость воды (η = 0,001); D – диэлектрическая проницаемость (D = 81); Е0 – электрическая постоянная (Е0 = 8,85·10-12 Ф/м).