
- •Министерство образования и науки рф
- •Иркутский государственный технический университет
- •Введение
- •Краткие методические указания к выполнению лабораторных работ
- •Термохимия Теоретическое введение
- •Определение константы калориметра и теплоты нейтрализации
- •Теоретические основы второй части работы
- •Определение средней теплоемкости вещества
- •Теоретические основы работы
- •Равновесие жидкость-пар: давление насыщенного пара жидкостей Теоретическое введение
- •Определение давления насыщенного пара индивидуальной жидкости
- •Порядок выполнения работы
- •Физико-химический анализ Теоретическое введение
- •Визуально-политермический метод
- •Термографический метод
- •Контрольные вопросы
- •Построение диаграммы плавкости бинарной системы фенол −нафталин термографическим методом
- •Теоретические основы работы
- •Порядок выполнения работы
- •Методика экспериментального определения электрической проводимости растворов
- •Удельная электрическая проводимость растворов хлорида калия при различных температурах, См∙см-1
- •Определение постоянной электролитической ячейки
- •Экспериментальные данные по измерению сопротивления стандартных растворов хлорида калия
- •Определение удельной электропроводности, константы и степени электролитической диссоциации слабого электролита
- •Результаты опыта и расчетные величины
- •Электродное равновесие Теоретическое введение
- •Методика измерения эдс
- •Определение стандартного потенциала ферри-ферро электрода
- •Порядок выполнения работы
- •Формальная кинетика химических реакций Краткое теоретическое введение
- •Изучение зависимости скорости химической реакции от температуры
- •Этилацетата щелочью
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Изменения относительного количества реагентов
- •Порядок выполнения работы
- •Соотношения объемов растворов в опытах и экспериментальные данные
- •Контрольные вопросы
- •Определение константы скорости гетерогенной реакции
- •Экспериментальные и расчетные данные
- •Не забывать после каждого отбора пробы опускать брусок мрамора в раствор так, чтобы площадь контакта его с раствором оставалась постоянной
- •Краткое описание метода
- •Краткое описание методов
- •Термодинамика поверхностных явлений. Адсорбция Теоретическое введение
- •Поверхности и в глубине фазы
- •Определение поверхностного натяжения и расчёт характеристик адсорбционного мономолекулярного слоя
- •(См. Теоретическое введение)
- •Метод максимального давления пузырька
- •Методом максимального давления пузырьков
- •Порядок выполнения работы
- •Работа 11 определение величины адсорбции
- •Теоретические основы работы
- •П орядок выполнения работы
- •Дисперсные системы Теоретическое введение
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •Получение дисперсных систем
- •Р ис. 33. Строение мицеллы золя AgI
- •Порядок выполнения работы
- •Зависимость показателя степени п при длине волны λ от размера частиц r
- •Порядок выполнения работы
- •Седиментационный анализ грубодисперсных систем
- •Теоретические основы работы
- •Порядок выполнения работы
- •Электрокинетические явления Теоретическое введение
- •Электрического напряжения
- •Электрофорез в золе гидроксида железа
- •Теоретические основы работы См. Теоретическое введение – Электрокинетические явления
- •Порядок выполнения работы
- •Мицеллярнорастворимые поверхностно-активные вещества Теоретическое введение
- •Определение критической концентрации мицеллообразования в растворах поверхностно-активных веществ
- •Библиографический список
Определение поверхностного натяжения и расчёт характеристик адсорбционного мономолекулярного слоя
Цель работы: Определение поверхностного натяжения методом максимального давления пузырьков. Расчет величины адсорбции и основных характеристик адсорбционного мономолекулярного слоя изоамилового спирта на границе раздела раствор-воздух.
Т еоретические
основы работы
еоретические
основы работы
(См. Теоретическое введение)
Если известна экспериментальная зависимость поверхностного натяжения от концентрации раствора, выражаемая изотермой поверхностного натяжения, то применяя уравнение адсорбции Гиббса (64), можно рассчитать величину адсорбции. Это делают следующим образом. Берут точку на изотерме поверхностного натяжения и проводят через неё касательную (Рис. 27).
Угол наклона касательной α. согласно геометрическому смыслу производной
П одставляя
отношение (-z/с)
в уравнение адсорбции Гиббса
одставляя
отношение (-z/с)
в уравнение адсорбции Гиббса
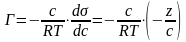
и сокращая, получим

г де
Г
– величина адсорбции, моль/м2;
R
–универсальная газовая постоянная R
= 8,314 Дж/моль·К; Т
– абсолютная температура, К.
де
Г
– величина адсорбции, моль/м2;
R
–универсальная газовая постоянная R
= 8,314 Дж/моль·К; Т
– абсолютная температура, К.
Отрезок z определяется на оси ординат с учетом масштаба. Взяв несколько точек на изотерме поверхностного натяжения (не менее 5), указанным способом по уравнению (65) находят адсорбцию при различных концентрациях раствора Г1 ~c1, Г2 ~c2 и т.д. Затем строят график зависимости адсорбции от концентрации раствора, который называют изотермой адсорбции (Рис. 28). Данный график описывается уравнением изотермы адсорбции Ленгмюра

или

где A – величина адсорбции, моль/г; Г∞ и А∞ - предельные величины адсорбции;
с – концентрация раствора, моль/л; К – константа адсорбционного равновесия.
Поделив единицу на левую и правую часть выражения (66), получим уравнение

 прямой
линии в координатах 1/Г = f
(1/с) которое позволяет графическим
способом находить постоянные Г∞
и К
в уравнении Лeнгмюра (Рис. 29).
прямой
линии в координатах 1/Г = f
(1/с) которое позволяет графическим
способом находить постоянные Г∞
и К
в уравнении Лeнгмюра (Рис. 29).
Отрезок, отсекаемый на оси ординат, равен 1/Г∞. По тангенсу угла наклона прямой находят константу адсорбционного равновесия К:

Адсорбционный мономолекулярный слой характеризуется площадью, занимаемой молекулой ПАВ в поверхностном слое S0 и длиной молекулы l, которая определяет толщину адсорбционного слоя где N – число Авогадро, N = 6,02·1023; M –молекулярная масса; ρ − плотность исследуемого вещества (для изоамилового спирта М = 86,1 кг/кмоль; ρ = 0,8·103 кг/м3).
 (68),
(68),
 (69)
(69)
Наиболее доступными для экспериментального измерения поверхностного натяжения являются системы жидкость-газ и жидкость-жидкость. Известно несколько методов определения поверхностного натяжения: капиллярного поднятия, сталагмометрический (метод счета капель), отрыва кольца, максимального давления пузырьков и другие. Наиболее простым из них (хотя менее точным) является последний из указанных методов.
Метод максимального давления пузырька
Основой
метода служит зависимость давления P
со стороны жидкости на п узырек
газа радиусом r
и поверхностным натяжением σ.
Это
давление стремится
уменьшить поверхность пузырька в
соответствии с уравнением Лапласа
узырек
газа радиусом r
и поверхностным натяжением σ.
Это
давление стремится
уменьшить поверхность пузырька в
соответствии с уравнением Лапласа
где ΔP – капиллярное давление.
Из уравнения Лапласа следует, что поверхностное натяжение жидкости можно определить, измерив давление, которое необходимо приложить для образования пузырька воздуха в поверхностном слое из капилляра радиусом r. Схема установки для измерения поверхностного натяжения показана на рис. 30, а. В рабочий сосуд 1 наливают дистиллированную воду до уровня, при котором кончик капилляра 2 погружён в неё менее чем на 1 мм. Избыток жидкости сливают. Шлангами соединяют рабочий сосуд с аспиратором 3, который заполняется водой, и манометром 4. Осторожно начинают сливать воду из аспиратора, что приводит к созданию вакуума в системе. При этом увеличивается разность давлений внутри измерительной пробирки и в капилляре, что обусловливает образование на конце капилляра пузырька воздуха в поверхностном слое жидкости. Форма и размер пузырька меняются последовательно (Рис. 30, б) при непрерыв-
ном увеличении давления до его максимального значения.
