
- •Министерство образования и науки рф
- •Иркутский государственный технический университет
- •Введение
- •Краткие методические указания к выполнению лабораторных работ
- •Термохимия Теоретическое введение
- •Определение константы калориметра и теплоты нейтрализации
- •Теоретические основы второй части работы
- •Определение средней теплоемкости вещества
- •Теоретические основы работы
- •Равновесие жидкость-пар: давление насыщенного пара жидкостей Теоретическое введение
- •Определение давления насыщенного пара индивидуальной жидкости
- •Порядок выполнения работы
- •Физико-химический анализ Теоретическое введение
- •Визуально-политермический метод
- •Термографический метод
- •Контрольные вопросы
- •Построение диаграммы плавкости бинарной системы фенол −нафталин термографическим методом
- •Теоретические основы работы
- •Порядок выполнения работы
- •Методика экспериментального определения электрической проводимости растворов
- •Удельная электрическая проводимость растворов хлорида калия при различных температурах, См∙см-1
- •Определение постоянной электролитической ячейки
- •Экспериментальные данные по измерению сопротивления стандартных растворов хлорида калия
- •Определение удельной электропроводности, константы и степени электролитической диссоциации слабого электролита
- •Результаты опыта и расчетные величины
- •Электродное равновесие Теоретическое введение
- •Методика измерения эдс
- •Определение стандартного потенциала ферри-ферро электрода
- •Порядок выполнения работы
- •Формальная кинетика химических реакций Краткое теоретическое введение
- •Изучение зависимости скорости химической реакции от температуры
- •Этилацетата щелочью
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные вопросы
- •Изменения относительного количества реагентов
- •Порядок выполнения работы
- •Соотношения объемов растворов в опытах и экспериментальные данные
- •Контрольные вопросы
- •Определение константы скорости гетерогенной реакции
- •Экспериментальные и расчетные данные
- •Не забывать после каждого отбора пробы опускать брусок мрамора в раствор так, чтобы площадь контакта его с раствором оставалась постоянной
- •Краткое описание метода
- •Краткое описание методов
- •Термодинамика поверхностных явлений. Адсорбция Теоретическое введение
- •Поверхности и в глубине фазы
- •Определение поверхностного натяжения и расчёт характеристик адсорбционного мономолекулярного слоя
- •(См. Теоретическое введение)
- •Метод максимального давления пузырька
- •Методом максимального давления пузырьков
- •Порядок выполнения работы
- •Работа 11 определение величины адсорбции
- •Теоретические основы работы
- •П орядок выполнения работы
- •Дисперсные системы Теоретическое введение
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •Получение дисперсных систем
- •Р ис. 33. Строение мицеллы золя AgI
- •Порядок выполнения работы
- •Зависимость показателя степени п при длине волны λ от размера частиц r
- •Порядок выполнения работы
- •Седиментационный анализ грубодисперсных систем
- •Теоретические основы работы
- •Порядок выполнения работы
- •Электрокинетические явления Теоретическое введение
- •Электрического напряжения
- •Электрофорез в золе гидроксида железа
- •Теоретические основы работы См. Теоретическое введение – Электрокинетические явления
- •Порядок выполнения работы
- •Мицеллярнорастворимые поверхностно-активные вещества Теоретическое введение
- •Определение критической концентрации мицеллообразования в растворах поверхностно-активных веществ
- •Библиографический список
Изменения относительного количества реагентов
Цель работы: ознакомление с закономерностями протекания гомогенных реакций и одним из методов определения частных и общего порядков реакции.
Исследуемая реакция протекает по уравнению
 .
………….(а)
.
………….(а)
Выделяющийся йод мгновенно вступает во взаимодействие
 .
(б)
.
(б)
Кроме того, в смеси протекает медленная реакция, практически не влияющая на исследуемую реакцию
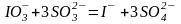 .
.
Скорость
реакции (а) можно выразить уравнением
 ,
,
где
 ,
,
 и
и
 - частные порядки реакции.
- частные порядки реакции.
Общий
порядок реакции равен
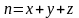 .
.
Для
контроля скорости изучаемого взаимодействия
удобна сопровождающаяся посинением
реакция (б), по ней скорость равна:
 .
.
Очевидно, что
 =
=
 .
.
Поэтому для константы скорости реакции можно записать соотношение
 .
(31)
.
(31)
Если
изменять последовательно относительные
количества
 ,
,
 и
и
 ,
сохраняя концентрации оставшихся двух
видов ионов постоянными, то скорость
изучаемой реакции будет изменяться в
том же соотношении, в каком изменяется
концентрация в соответствии с кинетическим
уравнением (с учетом показателя степени).
,
сохраняя концентрации оставшихся двух
видов ионов постоянными, то скорость
изучаемой реакции будет изменяться в
том же соотношении, в каком изменяется
концентрация в соответствии с кинетическим
уравнением (с учетом показателя степени).
Приборы
и материалы:
секундомер, 2 химических стакана, мерный
цилиндр на 100 см3
для дистиллированной воды, пипетки на
20, 10 и 5 см3.
Растворы: 0,05М
 ;
0,5М
;
0,01М
;
0,5М
;
0,01М
 ;
0,5М
;
0,5М
 ;
0,05 М
;
0,05 М
 ,
крахмал.
,
крахмал.
Порядок выполнения работы
В меньший стакан налить растворы , , и воду, в больший – растворы , , крахмал и воду в количествах, указанных в первой строчке табл. 7.
Быстро влить первую смесь растворов во вторую и включить секундомер. В тот момент, когда раствор приобретет синюю окраску, секундомер отключить и записать его показания в табл. 7.
Таблица 7
Соотношения объемов растворов в опытах и экспериментальные данные
Объемы растворов, см3 |
, с |
с-1 |
||||||||
Малый стакан |
Большой стакан |
|||||||||
|
|
|
Во- да |
|
|
Во-да |
крахмал |
|
|
|
10 |
20 |
10 |
60 |
20 |
10 |
65 |
5 |
|
|
|
20 |
20 |
10 |
50 |
20 |
10 |
65 |
5 |
|
|
|
10 |
40 |
10 |
40 |
20 |
10 |
65 |
5 |
|
|
|
10 |
20 |
10 |
60 |
40 |
10 |
45 |
5 |
|
|
|
Повторить то же самое, изменяя объемы растворов в соответствии со второй, третьей и четвертой строками таблицы, всякий раз записывая показания секундомера в момент посинения раствора.
Считая первый опыт стандартным, определить частные порядки реакции относительно ионов , и , суммированием найти общий порядок реакции. Для определения частных порядков необходимо сравнивать время протекания реакции. Двукратное увеличение концентрации того или иного компонента приводит к сокращению времени реакции, при этом уменьшение времени реакции в два раза свидетельствует о первом порядке по данному компоненту, а уменьшение времени в четыре раза – о втором порядке.
Рассчитать константу скорости реакции для всех случаев по уравнению (31). При расчете ионных концентраций необходимо учитывать разведение растворов по формуле (10), не забывая, что общее количества раствора получилось равным 200 см3. Концентрацию ионов водорода вычислять по формуле буферной смеси (см. ниже пример расчета).
По уравнению (3) определить среднее значение константы скорость реакции .
Дать оценку погрешности опытов, используя критерий Стьюдента.
Пример расчета ионных концентраций
Для первого опыта концентрации ионов будут равны:
для
иона
 ;
;
для
иона
 ;
;
для
иона

 ,
,
для
иона
 .
.

 ,
,