
- •Ферменты
- •1. История открытия и изучения ферментов
- •2. Особенности ферментов как биокатализаторов
- •3. Классификации ферментов и номенклатура.
- •3.1. Классификация ферментов по строению ферменты
- •3.2. Ферменты по уровню организации белковых молекул
- •3.3. Классификация ферментов по типу катализируемой реакции и номенклатура ферментов
- •3.4. Принципы построения рабочего названия фермента
- •3.5. Список ферментов
- •4. Механизм действия ферментов.
- •4.1 Активный центр ферментов
- •4.2. Механизм действия ферментов (на примере фермента холинэстеразы)
- •4.3. Причины высокой каталитической активности.
- •5. Специфичность ферментов
- •5.1. Субстратная специфичность
- •5.2. Специфичность пути превращения
4.3. Причины высокой каталитической активности.
Фермент поддерживает микроокружение субстрата в активном центре в состоянии отличном от его состояния в водной среде.
Располагает реагирующие атомы в правильной ориентации и на необходимом расстоянии друг от друга, чтобы обеспечить оптимальное протекание реакции.
За счет кооперативного взаимодействия субстрата и нескольких остатков аминокислот в активном центре фермент снижает энергию активации данной реакции.
5. Специфичность ферментов
5.1. Субстратная специфичность
Структура активного центра фермента комплементарна структуре субстрата, т.е. соответствует ему по 1) форме, 2) размерам и 3) способности взаимодействовать. Это является причинами высокой специфичности ферментов.
Первоначально модель активного центра, предложенная Э.Фишером, трактовала взаимодействие субстрата и фермента по аналогии с системой «ключ-замок» – модель «жесткой матрицы». Однако эта модель объясняла лишь абсолютную субстратную специфичность. Фермент с абсолютной специфичностью катализирует превращение какого-либо одного субстрата. Например, фумараза катализирует только реакцию фумаровой кислоты с водой:
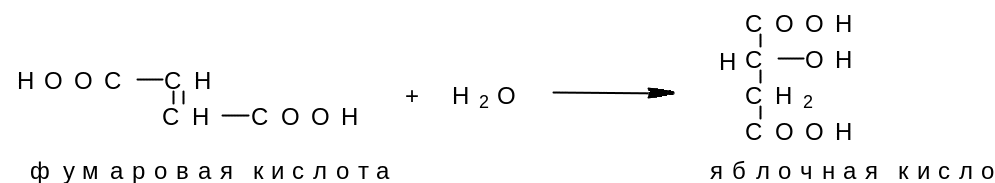
Кошланд предложил модель индуцированного соответствия. Главная черта этой модели – гибкость каталитического центра. В модели Фишера каталитический центр считается заранее подготовленным под форму молекулы-субстрата. В модели Кошланда субстрат индуцирует конформационные изменения фермента, и лишь в результате этих аминокислотные остатки и другие группы фермента принимают пространственную ориентацию, необходимую для связи с субстратом и катализа. Эта модель позволяет объяснить относительную специфичность фермента.
Активный центр фермента имеет трехмерную структуру, поэтому ферменты проявляют в большинстве случаев абсолютную оптическую специфичность за исключением эпимераз (рацемаз), которые катализируют взаимопревращение оптических изомеров.
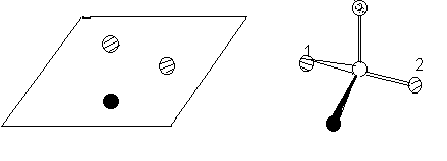
Кроме того, большинство субстратов образуют, как правило, не меньше трех связей с ферментом. Благодаря такой «трехточечной фиксации» симметричная молекула может проявлять асимметрию.
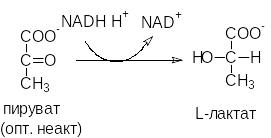
Химические изменения могут происходить только с группой 1, но не 2.
5.2. Специфичность пути превращения
Каждый фермент катализирует не любые из всех возможных путей превращения субстрата, а какое-либо одно. Это свойство называется специфичностью пути превращения. Например, у ферментов гистидазы и гистидиндекарбоксилазы один субстрат – гистидин, но катализируют эти ферменты разные превращения гистидина
