- •Тема 3. Поняття геохімічної системи. Основи хімічної термодинаміки
- •Основні поняття і закони хімічної термодинаміки.
- •Опис геохімічної системи
- •Відмінності між реальними та термодинамічними системами
- •Термодинамічні системи
- •Поняття рівноваги. Рівноважний та нерівноважний стани системи
- •Локальна рівновага
- •Другий закон термодинаміки
- •Теплоємність
- •Вільна енергія Ґібса
- •Розрахунок вільної енергії Ґібса мінералів та мінералоутворюючих реакцій для любих температур та тисків
- •Хімічні реакції і вільна енергія Ґібса Константа рiвноваги реакцiї мiнералоутворення, її залежнiсть вiд температури I тиску.
- •Використання константи рівноваги
- •Зміна вільної енергії в хімічних реакціях
- •Зміна вільної енергії Гібса реакцій при зміні тиску
- •Розрахунок рівноваг для реакцій мінералоутворення у водних розчинах.
- •Основні рушійні сили геохімічних процесів
- •Принцип мінімізації вільної енергії – в стані рівноваги досягається мінімальна вільна енергія, можлива в цій системі. Люба мінеральна система прагне максимально зменшити свою вільну енергію.
- •Ключові терміни
- •Екзаменаційні запитання
- •Додаткові запитання
Теплоємність
Теплоємність – кількість теплоти, потрібна для того, щоб збільшити температуру речовини на 1 градус. Ця теплота визначається при постійному об’ємі CV або ж при постійному тиску CP.
Теплоємність для ізобарного процесу
![]() або
або
![]() ,
тоді
,
тоді
 (3.3)
(3.3)
для ізохорного процесу
![]()
Зміна внутрішньої енергії речовини dU=q – PdV. Якщо V є постійним,
dUV = q = CVdT – збільшення енергії із температурою акумулюється в теплових коливаннях атомів у речовині. У кристалі такі коливання можуть бути описані трьома координатами, тобто можуть відбуватися в шести напрямках. Максимальна енергія коливань в кожному напрямку складає 1/2RT на моль-атом. Максимальна енергія коливань складатиме 3RT на моль-атом.
Наприклад, у мінералу кальциті CaCO3 є 5 моль-атомів (5 атомів у формулі). При R = 8,31424 Дж/(моль·K) CV 25 Дж/(моль·K).
Теплоємність звичайно визначається при постійному тиску і показується як CP.
![]() , де α – коефіцієнт ізобаричного
термального розширення, а β – ізотермічного
стискування.
, де α – коефіцієнт ізобаричного
термального розширення, а β – ізотермічного
стискування.
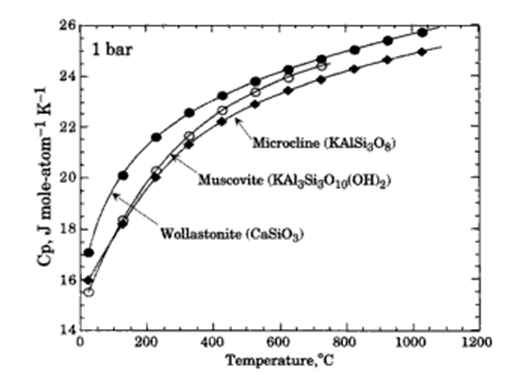
Як видно із рис.4.2 , така лінійна залежність CP для вказаних мінералів спостерігається при температурах вище 700°C. При нижчих температурах не всі можливі напрями коливань реалізуються, тому теплоємність прогресивно зменшується порівняно із лінійним трендом аж до досягнення нуля при 0K.
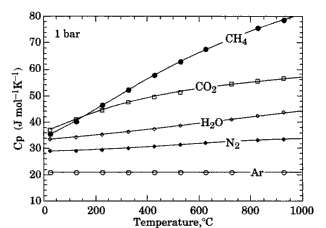
Для газів, що мають три напрямки коливань (три незалежних трансляційних моди) CV=3/2R=12.5 Дж/(моль-атом·K). CP ідеального газу складає 5/2R або 20,8 Дж/(моль-атом·K). Для реальних поліатомних газів потрібно враховувати додаткові коливні , а також ротаційні рухи. Чим більше атомів входить в молекулу газу, тим більша молярна теплоємність при даній температурі (порівняйте криві теплоємності на рис. 4.3).
CP звичайно дається в Дж/(моль·K) і його зміна із температурою може бути описана розширеним рівнянням Maier–Kelley (1932)
![]() де
a, b, c, d, e – коефіцієнти рівняння
теплоємності, що є специфічними для
кожної речовини; Т в ° Кельвіна. Перших
два члени рівняння описують лінійну
залежність CP-T при високих
температурах, тоді як решта – при низьких
температурах.
де
a, b, c, d, e – коефіцієнти рівняння
теплоємності, що є специфічними для
кожної речовини; Т в ° Кельвіна. Перших
два члени рівняння описують лінійну
залежність CP-T при високих
температурах, тоді як решта – при низьких
температурах.
|
|
Рис. 4.2. Зміна теплоємності деяких мінералів у перерахунку на Дж/(моль-атом·K) із температурою при 1 бар |
Рис. 4.3. Зміна молярної теплоємності деяких газів із температурою при 1 бар
|
Коефіцієнти рівняння Maier–Kelley для більшості мінералів і сполук у водному розчині наводяться у довідниках термодинамічних даних. Приклад таких даних показаний в таблиці 4.1.
Відповідно для одного моля речовини зміна ентропії при переході системи із стану з температурою T1 (°K) в стан T2 отримаємо відповідно
 для P = const
для P = const
 для V = const
для V = const
Ці ж вирази визначають не тільки відносне, як видно із рівнянь, але й абсолютне значення ентропії при даній температурі. Точка відліку для визначення абсолютного значення ентропії задається третім законом термодинаміки.
Третій закон термодинаміки (постулат Планка): ентропія правильно утвореного кристалу чистої речовини при абсолютному нулі (-273.15°С) дорівнює нулю.
У визначенні Д.В.Ґібса третій закон термодинаміки формулюється наступним чином:
Абсолютна ентропія любої речовини складається із двох частин:
Конфігуративна ентропія (Sc), що залежить від кількості атомів в системі та їх взаємного розміщення в просторі. Чим складніша система, тим більша невизначеність її стану, тим більша ентропія. Збільшення сортів атомів веде до зростання ентропії. Зростання варіантів взаємного розміщення різних атомів (зростання невпорядкованості системи) також призводить до зростання ентропії. Конфігуративна ентропія – ентропія невпорядкованості.
Теплова (калориметрична) ентропія (ST). Атом, що знаходиться в вузлі гратки, безперервно коливається (осцилює) навколо свого рівноважного стану. Амплітуда та напрямок осциляцій залежить від температури та сорту атома; амплітуда осциляцій зростає із температурою. Збільшення температури призводить до зростання невизначеності стану системи – зростання ентропії.
При абсолютному нулі (0 K) теплові коливання атомів припиняються, то ST=0. Так як для чистої (із одним сортом атомів) ідеально впорядкованої речовини Sc=0, то Sабс =0 при 0° K. Всі інші речовини зі змішаним складом (Sконф>0) або при іншій температурі мають позитивну ентропію.
Ентропія мінералу, як любої речовини визначається за розрахунками їх конфігураційної ентропії і замірами Cp як функції температури при формуванні мінералу із чистих речовин.
 (3.4)
(3.4)