
- •Ток в металлах
- •§1. Природа носителей тока в металлах.
- •§2. Классическая теория электропроводности металлов Друде-Лоренца
- •§3. Зависимость удельного сопротивления металлов от температуры
- •Ток в полупроводниках
- •§1. Собственная проводимость полупроводников.
- •§2. Примесная проводимость полупроводников.
- •§3. Контактные явления в металлах и полупроводниках
- •1. Контактная разность потенциалов.
- •2. Термоэлектрические явления
- •2 .1. Эффект Зеебека
- •2.2. Эффект Пельтье.
- •3. Односторонняя проводимость р-n перехода
- •Демонстрации. 1. Вольт-амперная характеристика диода (на эо).
- •Ток в электролитах
- •Законы Фарадея для электролиза
- •Электропроводность электролитов
- •Химические источники тока
- •1. Гальванические элементы
- •Поляризация и деполяризация электродов
- •2. Аккумуляторы
- •Ток в вакууме
- •1. Работа выхода электронов из металла. Термоэлектронная эмиссия
- •2. Вакуумный диод
- •3. Электронно-лучевая трубка
- •Ток в газах
- •1. Несамостоятельный и самостоятельный разряды
- •2. Виды самостоятельных разрядов Тлеющий разряд
- •Коронный разряд
- •Искровой разряд
- •Дуговой разряд
- •Электричество в атмосфере
- •1. Электрическое поле Земли.
- •2. Электрические токи в атмосфере.
- •3 . Роль гроз в поддержании заряда Земли.
Законы Фарадея для электролиза
Экспериментально установлены Майклом Фарадеем в 1833 году.
Первый закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе: масса m вещества, выделившегося на электроде, прямо пропорциональна протекшему по цепи заряду q:
m = kq = kIt,
где k – электрохимический эквивалент вещества (кг/Кл):
Второй закон Фарадея: электрохимический эквивалент прямо пропорционален молярной массе М вещества и обратно пропорционален зарядовому числу Z иона вещества. Коэффициент пропорциональности принято обозначать 1\F:
![]() ,
,
![]() Кл/моль – постоянная
Фарадея.
Кл/моль – постоянная
Фарадея.
Объединенный
закон Фарадея:
![]() .
(1)
.
(1)
Покажем, что постоянная Фарадея равна
произведению двух фундаментальных
физических констант – элементарного
заряда е и постоянной Авогадро
(числа молекул в одном моле вещества)
![]() :
:
![]() .
.
Пусть
![]() - масса одного иона определенного
вещества,
- масса одного иона определенного
вещества,
![]() - число таких ионов, пришедших к электроду.
Тогда масса выделившегося на электроде
вещества
- число таких ионов, пришедших к электроду.
Тогда масса выделившегося на электроде
вещества
![]() .
Масса иона
.
Масса иона
![]() ,
заряд каждого иона равен
,
заряд каждого иона равен
![]() ,
а число ионов определяется протекшим
зарядом:
,
а число ионов определяется протекшим
зарядом:
![]() .
Итак, масса вещества
.
Итак, масса вещества
![]()
![]() .
Мы пришли к объединенному
закону Фарадея (1) с постоянной
.
.
Мы пришли к объединенному
закону Фарадея (1) с постоянной
.
Электропроводность электролитов
При движении в электролите ионы испытывают
силу сопротивления, пропорциональную
их скорости:
![]() .
В электрическом поле при установившемся
движении иона с постоянной скоростью
.
В электрическом поле при установившемся
движении иона с постоянной скоростью
![]() (q – заряд иона);
(q – заряд иона);
![]() ,
откуда
,
откуда
![]()
(![]() - подвижность ионов, при комнатной
температуре
порядка 10-7
– 10-8
- подвижность ионов, при комнатной
температуре
порядка 10-7
– 10-8
![]() ).
).
Плотность тока создается движением ионов обоего знака:
![]() .
.
Если
- коэффициент диссоциации, n
– концентрация растворенного вещества,
то
![]() ,
и плотность тока
,
и плотность тока
![]() ,
где
- удельная проводимость электролита:
,
где
- удельная проводимость электролита:
![]() . (2)
. (2)
Итак, для электролитов, как и для металлов, выполняется закон Ома.
Зависимость электропроводности электролита от температуры.
С ростом температуры: а) возрастает
степень диссоциации
молекул растворенного вещества, б)
возрастает подвижность ионов, т.к.
уменьшается вязкость жидкости; кроме
того, ионы окружены и движутся вместе
с «гидратной шубой» из молекул
![]() ,
а с ростом Т размер «шубы» уменьшается.
,
а с ростом Т размер «шубы» уменьшается.
Как видно из формулы (2), всё это приводит
к росту удельной проводимости
при нагревании, т.е. к уменьшению
удельного сопротивления
![]() .
.
Химические источники тока
1. Гальванические элементы
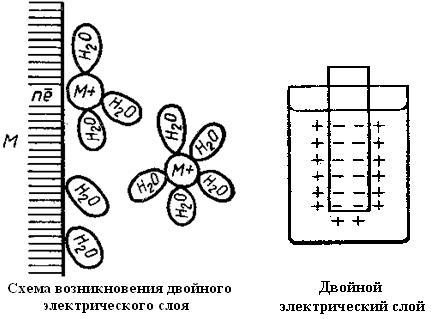
При погружении металла в воду или в раствор электролита на границе металл-раствор образуется двойной электрический слой и возникает разность потенциалов между металлом и раствором (так называемый электрохимический потенциал электрода по отношению к раствору, или электродный потенциал). Он зависит от концентрации ионов данного металла в растворе и от температуры.
Появление объясняется следующим образом. Полярные молекулы воды, поворачиваясь отрицательными полюсами к поверхности металла, притягивают положительные ионы кристаллической решетки металла и вытаскивают их в раствор. Металл заряжается отрицательно. Положительные ионы раствора притягиваются отрицательным зарядом металла и концентрируются у его поверхности - образуется двойной электрический слой.
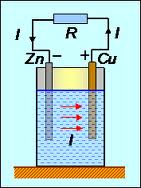
Если взять два металла с различной способностью посылать свои ионы в раствор, можно получить гальванический элемент – источник постоянного тока.
Мы знакомы с парой цинк – медь в растворе
серной кислоты (элемент Вольты).
Цинк обладает значительной способностью
посылать свои ионы в раствор, медь же
ионов практически не посылает, а отдает
электроны ионам Н+ раствора,
заряжаясь положительно. Электрохимический
потенциал цинка
![]() отрицательный, меди
отрицательный, меди
![]() –
положительный. ЭДС элемента равна
разности электрохимических потенциалов
электродов:
–
положительный. ЭДС элемента равна
разности электрохимических потенциалов
электродов:
![]() В.
В.
Обратите внимание: при электролизе положительные ионы электролита движутся к катоду (отрицательному электроду), отрицательные – к аноду. При работе источника тока, наоборот, внутри источника положительные ионы движутся к аноду (положительному электроду), отрицательные – к катоду.
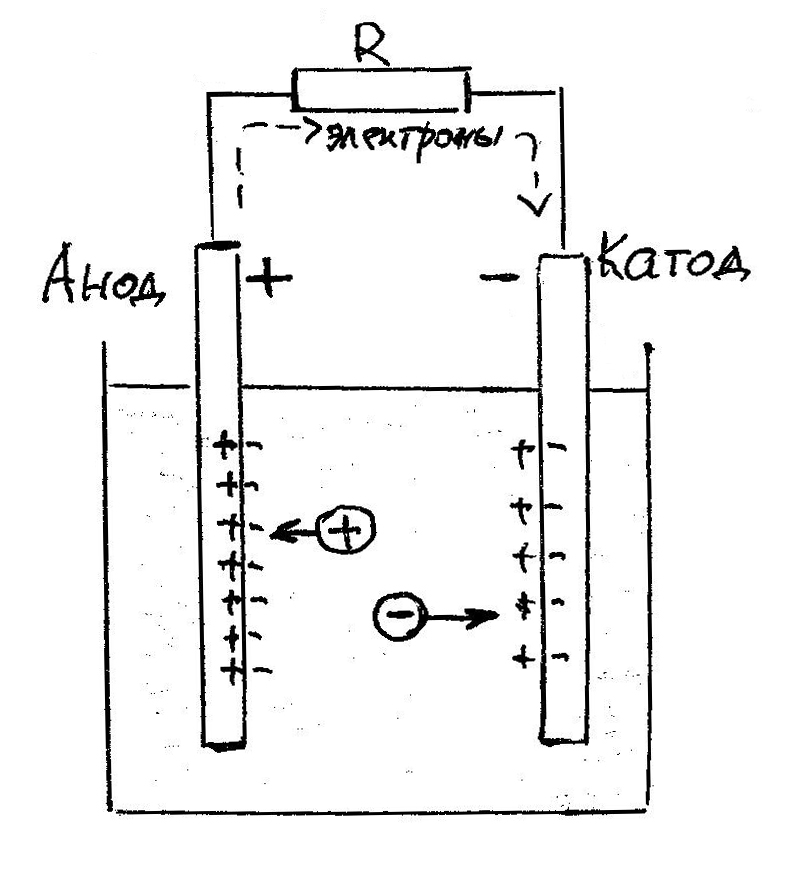
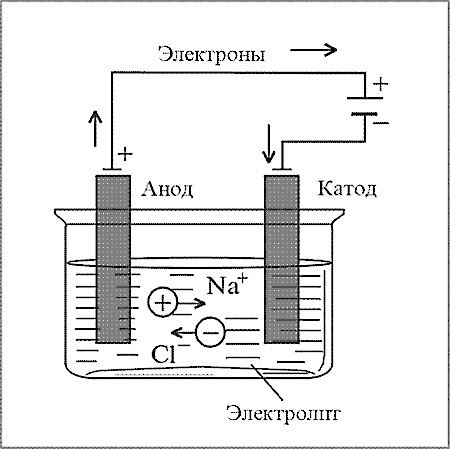
Движение ионов при электролизе и в гальваническом элементе
