
- •Тема: «Качественный анализ катионов и анионов»
- •2010-2011 Учебный год
- •Рекомендации для выполнения самостоятельной работы
- •Практическое занятие №2 Первая аналитическая группа катионов.
- •Реакции катиона натрия.
- •Реакции катиона калия.
- •Реакции катиона аммония.
- •Практическое занятие №3
- •II аналитическая группа катионов.
- •Действие группового реагента.
- •Реакции катиона серебра.
- •3. Реакции катиона свинца.
- •Реакции катиона ртути (I).
- •Практическое занятие №4
- •III Аналитическая группа катионов.
- •Действие группового реагента.
- •Реакции катиона бария.
- •Реакции катиона стронция.
- •Реакции катиона кальция.
- •Практическое занятие №5
- •IV группа катионов.
- •Действие группового реактива.
- •Реакции катиона алюминия.
- •Реакции катиона хрома (III).
- •Реакции катиона цинка.
- •Реакции катиона олова (II).
- •Реакция катиона олова (IV).
- •V Аналитическая группа катионов. Действие группового реагента.
- •Реакции катиона железа (II).
- •Реакции катиона железа (ш).
- •Реакции катиона марганца (п).
- •Реакции катиона магния (п).
- •Реакции катиона висмута (ш).
- •Реакции катиона сурьмы (ш).
- •Реакции катиона сурьмы (V).
- •Практическое занятие №6 Шестая аналитическая группа катионов. Действие группового реактива.
- •1. Реакции катиона меди (п).
- •2. Реакции катиона кадмия.
- •Реакции катиона ртути (п).
- •Реакции катиона кобальта.
- •Реакции катиона никеля.
- •Практическое занятие №7
- •I группа анионов.
- •Действие группового реагента.
- •Реакции сульфат иона.
- •Реакции сульфит иона.
- •Реакции карбонат иона.
- •Реакции силикат иона.
- •Реакции тетраборат иона.
- •Реакции фосфат иона.
- •II группа анионов.
- •Действие группового реагента.
- •Реакции хлорид иона.
- •Реакции бромид иона.
- •Реакции иодид иона.
- •Реакции сульфид иона.
- •III группа анионов.
- •Реакции нитрат иона.
- •Реакции нитрит иона.
- •Реакции ацетат иона.
- •Титриметрический анализ.
- •Приготовление и стандартизация 0,1n NaOh
- •Приготовление и стандартизация 0,1n hci
- •Определение щелочности молока.
- •Определение временной жесткости воды.
- •Приготовление и стандартизация 0,1n Трилона б.
- •Определение общей жесткости воды.
- •Приготовление и стандартизация 0,1 n раствора нитрата серебра.
- •Анализ порошка калия хлорида
- •Приготовление и стандартизация 0,1n раствора тиосульфата натрия.
- •Приготовление и стандартизация 0,1n раствора перманганата калия.
- •Анализ порошка меди сульфата.
- •Анализ раствора перекиси водорода 3%
- •Физико-химические методы анализа
- •Определение массовой доли раствора формалина неизвестной концентрации.
- •Вопросы для самоподготовки к занятиям по количественному анализу. Титриметрический анализ
- •Методы кислотно-основного титрования.
- •Методы осадительного титрования.
- •Методы комплексонометрического титрования.
- •Методы окислительно-восстановительного титрования.
- •Методы перманганатометрии.
- •Йодометрическое титрование.
- •Физико-химические методы анализа.
ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«СМОЛЕНСКИЙ БАЗОВЫЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Методическая разработка для студентов
по организации самостоятельной работы
на лабораторно-практическом занятии
Тема: «Качественный анализ катионов и анионов»
Дисциплина: Аналитическая химия
Специальность: 060301 «Фармация»
2010-2011 Учебный год
Одобрено цикловой комиссией Составлено в соответствии с
Общепрофессиональных требованиями к минимуму
Дисциплин содержания и уровню
подготовки
протокол №_________________ выпускников по специальности
Председатель________________ 060301 «Фармация»
Составила преподаватель Иванова Н.Л.
Содержание
Мотивация и цель самостоятельной работы
Рекомендации для выполнения самостоятельной работы
Мотивация и цель самостоятельной работы.
Изучение аналитической химии необходимо для понимания закономерностей фармацевтической химии, фармакологии и технологии изготовления лекарственных средств.
Основной задачей пособия является усвоение студентами аналитики, как науки, объясняющей связь свойств неорганических соединений с их строением, приобретение практических умений определения веществ, а также элементарных умений исследовательской работы и формирование представлений об Аналитической химии как фундаментальной дисциплине, на которой базируются профессиональные знания
Иметь представление: о фармакопейных методах анализа лекарственных средств.
Знать: 1)Методы качественного анализа веществ.
Уметь:
Определять ионы, в том числе в присутствии других ионов
Проводить количественный анализ веществ.
По химическим свойствам вещества, в том числе лекарственного, подбирать методы качественного анализа.
Рекомендации для выполнения самостоятельной работы
Выполнить задание по предложенному алгоритму.
Результаты записать в тетрадь.
Оформить результаты работы в форме таблицы.
№п/п |
Название и формула реактива |
Уравнение реакции |
Эффект реакции |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Практическое занятие №2 Первая аналитическая группа катионов.
Реакции катиона натрия.
Гексагидроксостибат (V) калия К[Sb(OH)6]
Осаждает из растворов солей натрия белый кристаллический осадок гексагидроксостибата (V) натрия:
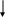 +
-
+
-
Na + [Sb(OH)6] = Na[Sb(OH)6]
При выполнении рассматриваемой реакции осаждение ведут из концентрированных растворов солей натрия, при рН=7, на холоду (можно охлаждать пробирку под струей холодной воды из крана). Необходимо потерание стеклянной палочкой, чтобы предотвратить образование пересыщенного раствора и ускорить выпадение осадка. Прежде чем делать вывод об отсутствии иона натрия, нужно дать содержимому пробирки постоять 10-15 минут. Разделите осадок на 3 части, испытайте его на растворимость в горячей воде, соляной кислоте, гидроксиде натрия. Открытию иона натрия мешает ионы аммония.
Проба на окрашивание пламени.
Все летучие соли натрия окрашивают пламя в интенсивно желтый цвет. Для выполнения пробы лучше взять хлорид натрия как наиболее летучее соединение.
Стеклянной палочкой с впаянной в нее медной проволокой погрузите в раствор хлорида натрия или захватите петлей немного сухой соли и внесите в пламя горелки. Пламя окрасится в характерный желтый цвет.
