
- •Компетенции,формируемые в результате освоения раздела
- •Основы нейроэндокринной регуляции обмена веществ введение
- •Теоретический материал 1 занятия Общая характеристика гормонов
- •Классификация и номенклатура гормонов
- •Общие представления о синтезе гормонов
- •Особенности биологического действия гормонов
- •Взаимодействие гормонов
- •Механизм действия гормонов
- •Теоретический материал 2 занятия Гормон роста (соматотропин)
- •Гормоны коры надпочечников
- •Синтез эйкозаноидов
- •Характеристика биологического действия основных типов эйкозаноидов
- •Возможные причины нарушений эндокринной регуляции.
- •Задания для самостоятельной работы
Теоретический материал 2 занятия Гормон роста (соматотропин)
Гормон роста синтезируется в соматотрофах, которые явля-ются наиболее представительной группой клеток в передней доле гипофиза. Концентрация гормона роста в аденогипофизе (5-15 мг/г) на несколько порядков превышает содержание других гипофизар-ных гормонов. Гормон роста представляет собой простой белок, содержащий 191 аминокислоту и имеющий молекулярную массу 22000Д. В организме человека активен только собственный гормон.
Секреция гормона роста носит пульсирующий характер, в течение нескольких минут его концентрация в крови может меняться в 10 раз. Наиболее высокое содержание соматотропина отмечается сразу после засыпания.
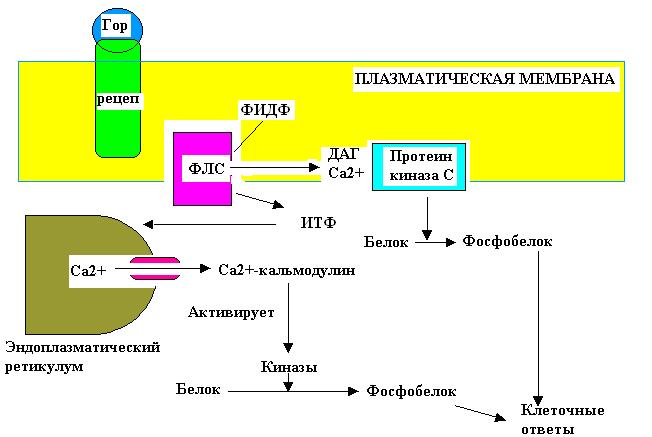
Рис.4 Мембранно-внутриклеточный механизм действия гормонов, использующий продукты гидролиза фосфоинозитидов в качестве внутриклеточных посредников.
К другим стимулам секреции относятся физический стресс (боль, физическая нагрузка), гипогликемия, холод, голодание, белковая пища (рис 5). Положительным регулятором секреции соматотропина является соматолиберин, а отрицательным регулятором секреции – соматостатин. Гормон роста оказывает свое влияние на клетки–мишени посредством инсулиноподобного фактора роста (ИФР-1), который образуется в печени. ИФР-1

Рис.5 Физиологическая регуляция секреции гормона роста
выступает в роли регулятора продукции соматолиберина по длинной обратной связи. Сам гормон роста регулирует секрецию соматолиберина по короткой обратной связи. Торможение секреции соматропина происходит под действием соматостатина.
Биохимические эффекты гормона роста, в частности ростостимулирующая активность, опосредована главным образом инсулиноподобным фактором роста (ИФР-1). По структуре он похож на проинсулин. У пациентов с недостаточным образованием ИФР-1 нарушена способность к нормальному росту. Действие гормона роста на белковый обмен заключается в стимулировании поступления аминокислот в клетки и усилении синтеза белка в костях, хрящах, мышцах, печени и других внутренних органах. Гормон роста усиливает образование мРНК, синтез ДНК, рост длинных костей в области эпифизарных пластинок у детей и аппозиционный рост костей у взрослых. Эффекты гормона роста на углеводный обмен противоположны действию инсулина. Гормон роста усиливает глюконеогенез из аминокислот, вызывает торможение превращения глюкозы по гликолитической цепи и транспорта глюкозы в клетки. Показано, что гормон роста стимулирует α-клетки поджелудочной железы и повышает активность ферментов, катализирующих катаболизм инсулина вызывает снижение количества рецепторов в инсулинозависимых клетках. При длительном введении гормона роста существует опасность развития сахарного диабета. Гормон роста стимулирует мобилизацию триацилглицеролов из жирового депо и увеличивает концентрацию жирных кислот в крови.
Избыточная секреция гормона роста у детей и подростков приводит к развитию гигантизма, при котором отмечается пропорциональный рост костей скелета и внутренних органов (гигантизмом называют рост выше 190 см.). Если избыточная секреция гормона роста имеет место у лиц с закончившимся процессом роста развивается акромегалия, которая характеризуется диспропорциональным ростом костей, мягких тканей, внутренних органов. Это приводит к характерным изменениям лица (выступающая челюсть, огромный нос), увеличиваются размеры кистей, стоп и черепа. Почти в 99% случаев акромегалия является следствием избыточной секреции соматотропного гормона аденомой гипофиза. Продолжительная повышенная секреция гормона роста приводит к изменению толерантности к глюкозе и в дальнейшем к сахарному диабету.
Причинами карликового роста (у мужчин ниже 130 см., у женщин ниже 120 см.) могут быть следующие:
1) гипофизарная недостаточность синтеза и секреции гормона роста;
2) образование дефектных рецепторов к гормону роста;
3) недостаточность инсулиноподобного фактора роста;
4) отсутствие рецепторов к ИФР-1;
5) нарушение пострецепторного механизма действия ИФР-1
Иодсодержащие гормоны щитовидной железы
В щитовидной железе синтезируются гормоны, которые объединены общим названием йодтиронины. К ним относят 3,5,3'-трийодтиронин (трийодтиронин, Т3) и 3,5,3',5'-тетрайодтиронин (Т4), или тироксин (рис. 6).
Биосинтез йодтиронинов Предшественником иодтиронинов служит тиреоглобулин. Это крупный гликопротеин с мол. массой 660 кД , в зависимости от количества поступающего в организм йода может содержать от 0,2 до 1% йодида. Содержит 115 остатков тирозина, которые служат потенциальными субстратами йодирования. Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, после гликозилирования доставляется в аппарат Гольджи, где включается в состав секреторных гранул и путем экзоцитоза выделяется во внеклеточный коллоид, в котором происходит йодирование остатков тирозина и образование йодтиронинов.
В среднем ежедневная секреция йода в составе гормонов щитовидной железы составляет 50 мкг. Учитывая то, что железа способна захватить 25-30% циркулирующего в крови йода суточная потребность в йоде составляет 150-200 мкг. Поступивший в составе пищи и воды при участии механизма активного транспорта йодид переносится в фолликулярные клетки. При этом преодолевается градиент концентрации составляющий 1:25.
Окисление I- , поступившего в железу, в I+ происходит в коллоиде под действием гемсодержащей тиреопероксидазы, использующей Н2О2 в качестве окислителя. Ингибиторами тиреопероксидазы, которые тормозят окисление, а следовательно и органификацию йодида являются соединения группы тиомочевины, которые используют в клинике в качестве анититиреоидных препаратов. Окисленный иодид реагирует с остатками тирозина в составе тиреоглобулина с образованием моноиодтирозина и дииодтирозина.
Окисленный йод взаимодействует с остатками тирозина в молекуле тиреоглобулина. Эта реакция также катализируется тиреопероксидазой. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием монойодтирозинов (МИТ) и дийодтирозинов (ДИТ). Конденсация двух молекул ДИТ приводит к образованию тетрайодтиронина (Т4), в результате конденсации МИТ и ДИТ образуется трийодтиронин (Т3). Тиреоглобулин, содержащий иодированные остатки тирозина транспортируется из коллоида в фолликулярную клетку, где гидролизуется ферментами лизосом с освобождением Т3 и Т4.
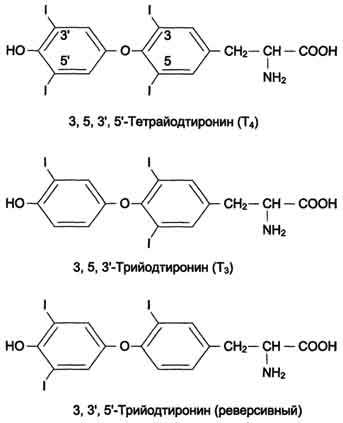
Рис. 6 Структура гормонов щитовидной железы.
Гидролиз тиреоглобулина стимулируется тиреотропином, но тормозится йодидом. В нормальных условиях щитовидная железа секретирует 80-100 мкг Т4 и 5 мкг Т3 в сутки. Ещё 22-25 мкг Т3 образуется в результате дейодирования Т4 в периферических тканях по 5'-углеродному атому и этот процесс служит главным источником трииодтиронина в плазме.
Транспорт и метаболизм йодтиронинов. Иодтиронины циркулирует в крови в связанной с тироксинсвязывающим глобулином (ТСГ) и тироксинсвязывающим преальбумином (ТСПА). Синтез ТСГ в печени стимулируется эстрогенами , но тормозится андрогенами и глюкокортикоидами. Салицилаты могут конкурировать с трииодтиронином за связывание с ТСГ, что приводит к снижению общего уровня гормонов без изменения их свободных форм. Это необходимо учитывать в случае терапевтического применения фармакологических аналогов этих гормонов. ТСГ обладает более высоким сродством к Т3 и Т4 и в нормальных условиях связывает почти всё количество этих гормонов. Только 0,03% Т4 и 0,3% Т3 находятся в крови в свободной форме, т.е. являются биологически активными.
Период полураспада тироксина в плазме составляет около 7 дней, а для Т3 он равен 1-1,5 дня. Трийодтиронин является основной биологически активной формой йодтиронинов; его сродство к рецептору клеток-мишеней в 10 раз выше, чем у тироксина. В периферических тканях за счет деиодирования образуется "реверсивная" форма Т3, которая почти полностью лишена биологической активности (Рис. 6).
Скорость синтеза и секреции йодтиронинов регулируются гипоталамо-гипофизарной системой. Тироксин и трииодтиронин тормозят свой собственный синтез по механизму обратной отрицательной связи, подавляя при этом высвобождение тиротропина гипофизом и тиролиберина гипоталамусом. Стимулом для повышение секреции тиролиберина и тиротропина является снижение содержания тиреоидных гормонов в крови. Однако, даже при полной блокаде синтеза и секреции тиреодидных гормонов не происходит немедленного повышения секреции тиролиберина и тиротропина.. Запас ранее синтезированного гормона в щитовидной железе, а также резервы в печени и в связанной с ТСГ форме позволяют поддерживать необходимый уровень тиреоидных гормонов в течение нескольких недель. Помимо этого йодтиронины усиливают высвобождение из гипоталмуса соматостатина, а тот в свою очередь подавляет секрецию тиротропина гипофизом. У детей, получающих гормон роста в соответствии с изложенным механизмом возможно развитие гипотиреоза.
Механизм действия гормонов щитовидной железы опосредуется связыванием их рецепторами, которые располагаются в ядре клетки. Помимо ядерных существуют также цитоплазматические рецепторы, которые не являются истинными и служат для связывания и удержания гормонов в клетке.
При физиологической концентрации йодтиронинов их действие проявляется в индукции синтеза белков путем ускорения транскрипции, что обеспечивает положительный азотистый баланс. Кроме того, Т3 увеличивает образование гормона роста, за счет стимуляции транскрипции гена этого гормона. Таким образом, при дефиците иодтиронинов гипофиз прекращает синтез и секрецию гормона роста. В то же время очень высокие концентрации иодтиронинов подавляют синтез белка и вызывают развитие отрицательного азотистого баланса.
Главным метаболическим эффектом гормонов щитовидной железы является увеличение потребления кислорода. Это наблюдается во всех клетках-мишенях за исключением мозга, клеток РЭС и гонад. Согласно гипотезе Эдельмана гормоны щитовидной железы повышают синтез молекул Nа+/К+ АТФазного насоса. Благодаря увеличению количества молекул этого насоса возрастает утилизация АТФ и связанное с нею увеличение потребления кислорода в процессе окислительного фосфорилирования.
В клетках-мишенях йодтиронины облегчают прохождение адреналового сигнала, благодаря чему ускоряют гликолиз, стимулирует липолиз в жировой ткани и мобилизацию гликогена в печени., синтез холестерола и синтез желчных кислот. Йодтиронины также участвуют в формировании ответной реакции на охлаждение увеличением теплопродукции, повышая чувствительность симпатической нервной системы к норадреналину и стимулируя секрецию норадреналина.
Заболевания щитовидной железы. Гипотиреоз развивается вследствие недостаточности йодтиронинов. Обычно гипотиреоз связан с недостаточностью функции щитовидной железы, но может возникать и при заболеваниях гипофиза и гипоталамуса.
Гипотиреоз у взрослых может быть эндогенного и экзогенного происхождения.
Эндогенный гипотиреоз связан с недостаточностью функции щитовидной железы, но может быть следствием заболевания гипофиза (вторичный гипотиреоз) или гипоталамуса (третичный гипотиреоз). В настоящее время у взрослых людей частой причиной гипотиреоза является хронический аутоиммунный тиреоидит, приводящий к нарушению синтеза йодтиронинов (зоб Хашимото).
Клиническая картина гипотиреоза характеризуется брадикардией, диастолической гипертензией, сонливостью, повышенной чувствительностью к холоду, сухостью кожи и волос. Наиболее тяжёлые формы гипотиреоза, обозначают термином "микседема" (от греч. туха – слизь, oedema – отёк). Один из признаков этого заболевания – отёчность тканей обусловлен избыточным накоплением гликозаминогликанов и воды в межклеточном матриксе. При этом кожа имеет вид апельсиновой корки.
Экзогенный гипотиреоз развивается в результате недостаточного поступления с пищей и водой йода. Пониженная продукция тиреоидных гормонов наблюдается если поступление йода в организм оказывается ниже 100 мкг/сут. Это приводит к ослаблению обратной связи, благодаря чему происходит увеличение синтеза и секреции тиреолиберина в гипоталамусе и тиреотропина в гипофизе. Усиление стимулирующего действия тиреотропина на щитовидную железу проявляется увеличением размеров щитовидной железы за счет увеличения количества фолликулов. Поскольку такая ситуация приурочена к йоддефицитным территориям развивающийся зоб является эндемичным с гипофункцией. Ханты-Мансийский автономный округ относится к территориям со средним йоддефицитом.
Гипертиреоз возникает вследствие повышенной продукции йодтиронинов. Диффузный токсический зоб (Базедова болезнь, болезнь Грейвса) – наиболее распространённое заболевание щитовидной железы. При этом заболевании отмечают увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов. Болезнь Грейвса возникает в результате образования тиреоидстимулирующего иммуноглобулина, который активирует рецептор тиротропина на мембранах клеток щитовидной железы. Непрерывная стимуляция железы приводит к ее увеличению, возрастанию продукции гормонов в 2-5 раз и развитию тиреотоксикоза. Высокие концентрации йодтиронинов усиливают обратную отрицательную связь, что приводит к снижению продукции тиротропного гормона.
Гипертиреоз может возникать в результате различных причин: развитие опухоли, тиреоидит, избыточное поступление йода и йодсодержащих препаратов, аутоиммунные реакции.
Характерные признаки тиреотоксикоза: повышенная температура тела, тахикардия, мышечная слабость, снижение массы тела (аппетит при этом заболевании не нарушен), потливость, тремор и экзофтальм (пучеглазие). Эти симптомы отражают одновременную стимуляцию йодтиронинами как анаболических (рост и дифференцировка тканей), так и, в большей степени, катаболических процессов.
Инсулин:строение, биологическия роль
Инсулин - полипептид, состоящий из двух полипептидных цепей, в совокупности включающие 51 аминокислотый остаток Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками. Наибольшее сходство первичной структуры обнаруживают инсулины быка (различается от инсулина человека по трем аминокислотным остаткам) и свиньи (отличается от инсулина человека по одному аминокислотному остатку), что позволяет использовать последний (является агонистом) в качестве препарата заместительной терапии при сахарном диабете.
Инсулин синтезируется в виде препроинсулина. Препоследовательность явялется сигнальной и обеспечивает направление молекулы в просвет эндоплазматического. После ее отщепления образуется проинсулин, который обладает 5% активностью инсулина. Проинсулин поступает в аппарат Гольджи, где происходит отщепление соединительного С-пептида. Образовавший зрелый инсулин сохраняется до секреции в форме цинксодержащего гексамера. Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы.
Период полураспада инсулина в плазме крови составляет 3-10 мин, С-пептида - около 30 мин. Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках.
Регуляция синтеза и секреции инсулина. Глюкоза –главный регулятор секреции инсулина, Пороговой для секреции инсулина является концентрация глюкозы 5,5 ммоль/л, максимальная секреция наблюдается при концентрации глюкозы 15-20 ммоль/л. Кроме глюкозы стимулирующим действием на синтез инсулина в β-клетках облдают аминокислота лейцин, глюкагон, гормон роста, кортизол, ингибирует синтез адреналин. Повышают секрецию инсулина секретин, холецистокинин и желудочный ингибирующий пептид (GIP). Секреция инсулина является Са2+-зависимым процессом и при дефиците Са2+ снижается даже в условиях высокой концентрации глюкозы.
Транспорт глюкозы в β-клетки осуществляется ГЛЮТ-1 и ГЛЮТ-2. Поступившая в клетки глюкоза фосфорилируется с образованием глюкозо-6-фосфата под действием глюкокиназы. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета.
В крови инсулин может быть в свободной форме, которая способствует утилизации глюкозы жировой и мышечной тканью. Связанная с белкми форма инсулина влияет только на жировую ткань.
Действие инсулина начинается со связывания с рецептором. Инсулиновые рецепторы постоянно синтезируются и разрушается. Период полураспада рецептора составляет 7-12 ч. Число инсулиновых рецепторов может изменяться. Так при избыточной массе тела количество рецепторов уменьшается и клетки-мишени становятся менее чувствительными к инсулину. Снижение сродства рецепторов к инсулину возможно вследствие их модификация путем фосфорилирования.
После связывания инсулина с рецептором гормон-рецепторный комплекс проникает внутрь клетки. В качестве внутриклеточных посредников выступают сам инсулин, ионы кальция, циклические нуклеотиды, продукты распада фосфатидилинозитолдифосфата. Внутриклеточные посредники обеспечивают перемещение из цитозольных везикул в плазматическую мембрану ГЛЮТ-4, которые осуществляют транспорт глюкозы в клетку. В клетках печени инсулин стимулирует активность глюкокиназы, благодаря которой образуется активный метаболит глюкозо-6-фосфат. Гипогликемические эффекты инсулина сявзаны с активацией ферментов фосфофруктокиназы, пируваткиназы, пируватдегидрогеназы, глюкозо-6-фосфат-дегидрогеназы, что способствует утилизации глюкозы по пути аэробного дихотомического распада и пентозного пути. Кроме того инсулин стимулирует образование гликогена путем активации гликогенсинтазы и ингибирования гликогенфосфорилазы. На синтез гликогена расходуется около 10% поступившей глюкозы. Инсулин подавляет образование глюкозы вследствие репрессии синтеза фосфоенолпируваткарбоксикиназы.
Инсулин стимулирует липогенез в печени и жировой ткани благодаря активации ацетил-КоА-карбоксилазы, катализирующей ключевую реакцию синтеза жирных кислот, увеличения притока глицерина, активации ферментного комплекса синтазы жирных кислот (на образование нейтрального жира расходуется до 40% поступившей глюкозы). В печени и жировой ткани инсулин ингибирует гормончувствительную триацилглицерол-липазу, таким образом подавляя мобилизацию триацилглицеролов. Благодаря активации метаболизма глюкозы инсулин подавляет кетогенез в печени.
Инсулин является одним из наиболее активных анаболических гормонов. Он влияет на процессы репликации и транскрипции, участвуя таким образом в регуляции клеточной дифференцировки и пролиферации, ограничивает использование аминокислот по пути ихглюконеогенеза.
Эффекты инсулина могут проявляться в течение секунд и минут (транспорт веществ, фосфорилирование и дефосфорилирование белков, активация и ингибирование ферментов, синтез РНК) или через несколько часов (синтез ДНК, белков, пролифирация клеток).
