
- •Расчет насадочного абсорбера
- •4.1 Определение условий равновесия процесса
- •Расчет материального баланса
- •4.2.1 Определение молярного расхода компонентов газовой смеси.
- •Определение расхода поглотителя со2 из газовой смеси.
- •4.2.3 Определение рабочей концентрации в поглотителе на выходе из абсорбера.
- •Построение рабочей линии абсорбции со2 и определение средней движущей силы
- •Определение рабочей скорости газа и диаметра аппарата
- •Определение высоты абсорбера
- •Определение гидравлического сопротивления абсорбера
- •Расчет диаметров штуцеров и труб
Расчет насадочного абсорбера

4.1 Определение условий равновесия процесса
Определяем равновесные концентрации диоксида углерода в воде. Если поглощается трудно растворимый газ, то расчет равновесных концентраций ведут по закону Генри [1]:
 , (4.1)
, (4.1)
где П – давление в абсорбере равное 1,6 МПа (из задания);
E – константа растворимости, Па;
x* –
мольная равновесная доля СО2 в
воде,
 ;
;
у – концентрация СО2 в воздухе,
 .
.
E = 1,24106 мм рт. ст. = 1,65108 Па, при температуре абсорбции 26 С (из задания) [4].
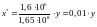 . (4.2)
. (4.2)
Начальная относительная мольная доля СО2 рассчитывается по формуле:
 , (4.3)
, (4.3)

Пересчет в массовую концентрацию производится по формуле:
 , (4.4)
, (4.4)
где М – молекулярные массы СО2 и воздуха, кг/кмоль.
 ,
,

Величины равновесных концентраций в жидкости достаточно рассчитать для диапазона значений концентраций в газовой фазе от нуля до величины, которая в 1,2–1,5 раз превышает начальную концентрацию абсорбтива [3].

Для упрощения расчетов материального баланса необходимо сделать пересчет абсолютных концентраций в относительные. Связь между относительной концентрацией и абсолютной выражается следующей формулой [1, стр. 385]:
 ,
(4.5)
,
(4.5)
 ,
(4.6)
,
(4.6)
где у ‑ абсолютная концентрация СО2 в газовой фазе, ;
Y – относительная
концентрация СО2 в газовой фазе,
 ;
;
x – абсолютная концентрация СО2 в жидкой фазе, ;
X – относительная
концентрация СО2 в жидкой фазе,
 .
.
х=

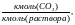


Расчет материального баланса
4.2.1 Определение молярного расхода компонентов газовой смеси.
Пересчитаем объемный расход при нормальных условиях (T0=273K, P0=1,013105 Па) в объемный расход при условиях абсорбции (Т=299К, Р=1,6106 Па):
 ,
(4.7)
,
(4.7)
где Vсм0 –
расход при нормальных условиях,
 .
.
 .
.
Для удобства дальнейших расчетов переведем объемный расход газовой смеси в молярный:
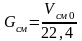 ,
(4.8)
,
(4.8)
где Vсм0 –
объемный расход газовой смеси,
 ;
;
Gсм – молярный
расход газовой смеси,
 .
.

Молярный расход инертного газа определяется по уравнению [4]:
 ,
(4.9)
,
(4.9)
где ун – исходная
концентрация
 в газовой смеси,
;
в газовой смеси,
;
G – молярный расход инертного газа, .
Из условия задания: ун=0,0291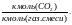
 .
.
Концентрацию СО2 на выходе из абсорбера yк, :
 ,
(4.10)
,
(4.10)
где – степень извлечения, =0,87 (из задания).
 .
.
Величины yк, yн пересчитаем в относительные по формуле (4.5):
Yк=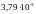 ,
,
Yн=0,03 .
Для определения молярного расхода M, который поглощается, служит следующее уравнение [4]:
 , (4.11)
, (4.11)
 .
.
Определение расхода поглотителя со2 из газовой смеси.
Для определения минимального молярного расхода чистого поглотителя Lмин служит следующее уравнение:
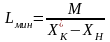 ,
(4.12)
,
(4.12)
где X*к – равновесная относительная концентрация СО2 в воде на выходе из аппарата, ;
Хн – исходная относительная концентрация СО2 в воде, .
Равновесную относительную концентрацию СО2 в воде на выходе из аппарата определим по линии равновесия (рис. 4.1). Для противоточных абсорберов X*к=f(Yн). По графику максимально возможная концентрация СО2 в воде при условиях абсорбции составляет:
X*к=2,91110-4

Т.к. в реальном процессе абсорбции используется не минимальный расход поглотителя, а несколько больший (для ускорения процесса), то необходимо пересчитать минимальный расход поглотителя на рабочий расход L с учетом коэффициента избытка поглотителя [4, стр. 390]:
 , (4.13)
, (4.13)
где – коэффициент избытка поглотителя, равный 1,5 (из условия задания)

