
- •Раздел I. Техническая термодинамика
- •Тема 1. Основные понятия и определения
- •1.1. Термодинамическая система и её состояние
- •1.2. Параметры состояния
- •1.3. Уравнение состояния
- •1.4 Уравнение состояния идеального газа
- •Тема 2 Энергетические характеристики термодинамических систем
- •2.1. Внутренняя энергия
- •2.2 Работа. Теплота
- •2.3 Теплоемкость
- •2.4. Энтропия
- •2.5 Энтальпия
- •2.6 Первый закон термодинамики
2.4. Энтропия
Одной из функций состояния термодинамической системы является энтропия.
Энтропией называется величина, определяемая выражением
![]() (2.13)
(2.13)
или для удельной энтропии
![]() .
(2.14)
.
(2.14)
Энтропия есть однозначная функция состояния тела, принимающая для каждого состояния вполне определенное значение.
Энтропия является экстенсивным (зависит от массы вещества) параметром состояния и в любом термодинамическом процессе полностью определяется начальным и конечным состоянием вещества и не зависит от пути протекания процесса.
Энтропию можно определить через основные параметры состояния термодинамической системы:
![]() (2.15)
(2.15)
или для удельной энтропии
![]() .
(2.16)
.
(2.16)
В термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо термодинамическом процессе
![]() (2.17)
(2.17)
поэтому энтропию часто отсчитывают от произвольно выбранного уровня.
Для вычисления энтропии идеального газа в различных термодинамических процессах используют следующие уравнения
![]() (2.18)
(2.18)
![]() ……
(2.19)
……
(2.19)
![]() (2.20)
(2.20)
Понятие энтропии
позволяет ввести чрезвычайно удобную
для термодинамических расчетов
![]() ─
диаграмму, на которой состояние
термодинамической системы изображается
точкой, а равновесный термодинамический
процесс линией (рисунок 2.2).
─
диаграмму, на которой состояние
термодинамической системы изображается
точкой, а равновесный термодинамический
процесс линией (рисунок 2.2).
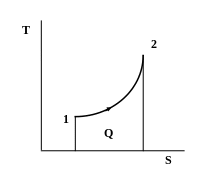
Рисунок 2.2 ─ Графическое изображение количества теплоты в виде
площади под кривой процесса в -диаграмме
По характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен.
Если энтропия
системы возрастает
![]() ,
то к системе подводится тепло.
,
то к системе подводится тепло.
Если
![]() ,
то
,
то
![]() ,
т. е. от системы отводится тепло.
,
т. е. от системы отводится тепло.
Если энтропия
системы не изменяется
![]()
![]() ,
то отсутствует теплообмен с окружающей
средой, т.е. процесс адиабатный.
,
то отсутствует теплообмен с окружающей
средой, т.е. процесс адиабатный.
2.5 Энтальпия
Одним из важнейших параметров в термодинамике является энтальпия.
Введение этого параметра упрощает рассмотрение процессов в тепловых двигателях, особенно при исследовании процессов, в которых рабочим телом является водяной пар.
Под энтальпией
![]() понимают энергию расширенной системы,
состоящей из макротела (газа) и поршня
с грузом, уравновешивающего давление
газа внутри сосуда, куда заключен газ.
понимают энергию расширенной системы,
состоящей из макротела (газа) и поршня
с грузом, уравновешивающего давление
газа внутри сосуда, куда заключен газ.
Энтальпия равна сумме внутренней энергии системы и потенциальной энергии поршня с грузом
![]() (2.21)
(2.21)
Физический смысл энтальпии поясним на следующем примере.
Рассмотрим
расширенную систему, включающую газ в
цилиндре и поршень с грузом общим весом
![]() (рисунок 2.3).
(рисунок 2.3).

Рисунок 3.
Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом:
![]()
В условиях равновесия
![]() эту систему можно выразить через
параметры состояния газа
эту систему можно выразить через
параметры состояния газа
![]()
Получаем, что
![]() ,
т.е. энтальпию можно трактовать как
энергию расширенной системы.
,
т.е. энтальпию можно трактовать как
энергию расширенной системы.
Так как входящие в уравнение (2.21) величины являются функциями состояния, то и сама энтальпия является функцией состояния.
Также как внутренняя энергия, работа и теплота энтальпия измеряется в джоулях.
![]() .
.
Удельная энтальпия
![]() представляет собой энтальпию системы,
содержащей 1 кг вещества
представляет собой энтальпию системы,
содержащей 1 кг вещества
![]() .
(2.22)
.
(2.22)
Энтальпия может быть представлена в виде функции двух любых параметров состояния
![]() .
(2.23)
.
(2.23)
Так как между
энтальпией и внутренней энергией
существует связь
![]() ,
то выбор начала отсчета одной из них не
произволен: в
точке, принятой за начало отсчета
внутренней энергии
,
то выбор начала отсчета одной из них не
произволен: в
точке, принятой за начало отсчета
внутренней энергии
![]() .
.
Например, для воды
при
![]() и
и
![]() ,
,
![]() ,
а
,
а
![]() .
.
