
- •Теплотехника, тепломассообменные процессы и оборудование
- •Содержание
- •2. Методические указания по решению типовых задач 5
- •2.1. Задачи по основам термодинамики 5
- •1.Общие методические указания
- •2. Методические указания по решению типовых задач
- •2.1. Задачи по основам термодинамики
- •Задачи по тепло- и массообмену
- •2.2 Задачи по тепловым аппаратам
- •Список литературы
- •Физические параметры для сухого воздуха при давлении 101325 Па
- •Физические параметры сухого воздуха
- •Мольные теплоемкости газов по данным молекулярно-кинетической теории, кдж/(кмоль·к)
- •Значения с и n в зависимости от произведения Сr·Рr
- •Средние изобарные мольные теплоемкости некоторых газов µСpm кДж/(кмоль·к)
- •Средние массовые теплоемкости газов при постоянном объеме Сvm, кДж/(кг∙к)
- •Интерполяционные формулы для средних массовых и объемных теплоемкостей газов
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
«РОССИЙСКИЙ ЗАОЧНЫЙ ИНСТИТУТ ТЕКСТИЛЬНОЙ И ЛЕГКОЙ ПРОМЫШЛЕННОСТИ»
Филиал ГОУ ВПО «РосЗИТЛП» в г. Омске
Кафедра Общетехнических наук
УТВЕРЖДАЮ Заведующий кафедрой _________________________ "______" ___________2008 г.
ТЕПЛОМАССООБМЕННЫЕ ПРОЦЕССЫ И ОБОРУДОВАНИЕ
Методические указания по решению типовых задач для студентов специальностей 220301,150406
Омск 2008 |
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
РОССИЙСКИЙ ЗАОЧНЫЙ ИНСТИТУТ ТЕКСТИЛЬНОЙ И ЛЕГКОЙ ПРОМЫШЛЕННОСТИ
Кафедра теплотехники
Теплотехника, тепломассообменные процессы и оборудование
Методические указания по решению типовых задач для студентов специальностей 170700, 210200
МОСКВА 2004
Составители: Б.С. Былинкин, С.А. Белов, И.А. Сафонова
Теплотехника, тепломассообменные процессы и оборудование: Метод, указания по решению типовых задач / Российск. заочн. ин-т текстил. и легк. пр-сти; Сост. Б.С.Былинкин и др. М., 2004, 31 с.
Предназначено для студентов специальностей:
170700 - «Машины и аппараты текстильной и легкой промышленности»
210200 -«Автоматизация технологических процессов и производств»
Содержание
2. Методические указания по решению типовых задач 5
2.1. Задачи по основам термодинамики 5
2.2 Задачи по тепловым аппаратам 18
П Р И Л О Ж Е Н И Е 23
1.Общие методические указания
Студенты заочники, руководствуясь программой курса и методическими указаниями, самостоятельно изучают теоретические основы курса и выполняют две письменные контрольные работы. Каждая из контрольных работ состоит из четырех задач.
К решению задач следует приступить после изучения соответствующего раздела курса. Перед выполнением контрольных работ рекомендуется ознакомиться с ходом решения аналогичных задач по учебной литературе,
Только сознательное (не «механическое») решение задач приносит пользу и помогает закреплению теоретических знаний Умение решать задачи, дать правильные ответы на вопросы для самопроверки является критерием усвоения учебного материала.
Исходные данные для каждой задачи выбираются из соответствующих таблиц по последней и предпоследней цифрам шифра, указанного в зачетной книжке. Работы, выполненные не по своему варианту, не рассматриваются.
При выполнении контрольных работ необходимо соблюдать следующие условия: а) выписывать полное условие задачи и исходные данные, б) асе расчеты прободать, используя только Международную систему единиц (СИ); в) решения всех задач должны содержать графические изображения процессов в термодинамических диаграммах и сопровождаться кратким анализом полученных результатов, г) в конце работы привести список использованной литературы и поставить свою подпись; д) для письменных замечаний рецензента оставить чистые поля в тетради и 1-2 страницы в конце работы.
2. Методические указания по решению типовых задач
2.1. Задачи по основам термодинамики
Задача 1
В резервуаре вместимостью V м3 газ находится под манометрическим (избыточным) давлением p1м и температуре t1. После медленного расходования из резервуара части газа манометрическое давление снизилось до p2, а температура осталась прежней (t1 = t2).
Определить массу газа М1 при его начальном состоянии и израсходованную массу газа ΔМ. Определить также при начальных параметрах плотность газа ρ1, внутреннюю энергию U1 и энтальпню J1.
Атмосферное давление принять равным 1 бар= 105 Па.
При решении задачи используются следующие термодинамические зависимости.
Уравнение состояния идеальных газов pV= MRT,
где р - абсолютное давление газа, Па;
V- объем газа, м3;
М - масса газа, кг;
Т - абсолютная температура газа, К;
R = 8314/μ- удельная газовая постоянная, Дж/кг∙град;
μ - молекулярная масса газа, кг/кмоль.
Внутренняя энергия газа U = М∙сv,Т, Дж,
где сv - удельная массовая теплоемкость газа при постоянном объеме, Дж/кг∙град.
Энтальпия газа J = Мср ·Т, Дж,
где сp = сv + R - удельная массовая теплоемкость газа при постоянном давлении.
Задача 2
Определить параметры газа в начальном и конечном состояниях, изменение внутренней энергии, теплоту, участвующую в заданном термодинамическом процессе, и работу, совершаемую газом, если заданы: масса газа М, начальные давление p1, температура t1 и температура t2 газа в начале и конце процесса.
Для решения задачи необходимо использовать основные термодинамические закономерности:
Уравнение состояния идеальных газов
pV=MRT, (1)
где р - давление газа, Па;
V-объем газа, м3;
Т - абсолютная температура газа, К;
R = 8314/ μ - газовая постоянная, Дж/кг∙град
μ - молекулярная масса.
Количество подведенной к М кг газа (отведенной) теплоты определяется по уравнению
Q=cуд. проц.(Т2-Т1), Дж (2)
где cуд. проц - удельная теплоемкость газа в заданном процессе, Дж/кг∙град.
- Изменение внутренней энергии газа: U2-U1 = Mcv(T2 – T1), Дж. (3)
- Механическая работа, совершаемая газом: L = p(V2 – V1), Дж. (4)
- Уравнение первого закона термодинамики; Q = (U2 - U1) + L. (5)
- Уравнения термодинамических процессов:
изохорный процесс (V = const)
p1/T1 = p2/T2, (6)
изобарный процесс (Р = const)
V1/T1 = V2/T2, (7)
адиабатный процесс (Q = 0)
p1V1k = p2V2k, (8)
где k = сp/сv - показатель адиабаты.
Зависимость между изобарной и изохорной теплоемкостям и даст формула Майера
cp = cv = + R. (9)
Пример 1. Определить параметры М кг газа в начальном и конечном состояниях, изменение внутренней энергии газа, отведенную теплоту и механическую работу при изменении температуры газа от t1 до t2 в изобарном процессе p1 = const.
Решение:
1) При известных значениях t1, t2 и p1 =р2 определяем объем газа в начальном и конечном состояниях, используя уравнение состояния (1):
V1 = MRT1/p1, м3, V2 = MRT2/p2, м3,
здесь Т, К = t0С+2730 - абсолютная температура газа.
2) Определяем изменение внутренней энергии газа, используя формулу (3):
U1 – U2 = Mcv(Т2 – Т1), Дж.
3) Теплота, отведенная от газа, вычисляется по формуле (2):
Q = Mcp(Т2 – Т1), Дж.
4) Для определения механической работы воспользуемся формулой (4):
L = p(V2 – V1), Дж.
Пример 2. Определить параметры М кг газа в начальном и конечном состояниях, изменение внутренней энергии газа и работу расширения при изменении температуры газа от t1 до t2 в адиабатном процессе (т.е. без подвода или отвода теплоты, Q = 0).
Решение:
1). При известных значениях t1, t2 и p1 определяем объем и давление газа в начальном и конечном состояниях, используя уравнения адиабаты (8) и состояния (1):
p2 = p1(T2/T1)k/k-1, Па; V1 = MRT1/p1, м3; V2 = MRT2/p2, м3.
2) Определяем изменение внутренней энергии газа, используя формулу (3):
U2 – U1 = Mcv(T2 – T1), Дж.
3) В соответствии с 1-м законом термодинамики (5) работа расширения газа в адиабатном процессе равна изменению внутренней энергии:
0 = - (U2 - U1) + Lад, отсюда Lад = U1 - U2…
Отметим, что идеальный (без трения) адиабатный процесс является изоэнтропным (S = const).
Задача 3
Газ (М кг) расширяется в цилиндре поршневого двигателя от начального давления p1 и температуры t1 0С до конечного давления р2;
Определить работу расширения газа для адиабатного политропного процессов, а также подводимую (отводимую) теплоту, изменение внутренней энергии и изменение энтропии.
При решении задачи используются следующие термодинамические зависимости:
Работа расширения газа при адиабатном процессе
Lад = МR(T1 – T2)/(k – 1), где T2 = T1(P2/P1)k-1/k;
k = cp/cv - показатель адиабаты,
cp = cv + R, Дж/кг∙град.
Работа расширения газа при политропном процессе
Lпол = МR(T1 – T2)/(n – 1), где T2 = T1(P2/P1)n-1/n;
n = (спол - cp)/( спол – cv) – показатель политропы.
- Количество теплоты, подводимой или отводимой в процессе политропного расширения газа
Qпол = Mcпол(Т2 – Т1), Дж
где спол =сv[(n - k)/(n - 1)].
- Изменение внутренней энергии газа
ΔU = U2 – U1 = Mcv(Т2 – Т1), Дж.
- Изменение энтропии газа
Saд = const., ΔSaд = S1 - S2 = 0
ΔSпол = Спол∙ln(T2/T1) Дж/град Спол = сv (n – k)/(n – 1)
Задача 4
Воздух с начальной температурой t1 сжимается в поршневом компрессоре, где его давление повышается от p1 до p2. Сжатие осуществляется по изотерме, адиабате и политропе. Определить для каждого из этих процессов конечную температуру воздуха, отводимую теплоту в мощность компрессора, если его производительность G, кг/с.
Решение задачи.
Температура воздуха в конце процесса сжатия для адиабатного процесса Т2 = Т1(р2/р1)(k – 1)/k,
для политропного процесса Т2 = Т1(р2/р1)(n – 1)/n,
Отводимая теплота в Вт:
для изотермического процесса Qиз = -GRT∙ln p2/p1,
для адиабатного процесса Qад = 0
для политропного процесса Qпол=G cпол(Т2 – Т1)=G∙cv[(n–k)/(n–1)](Т2 – Т1).
Мощность компрессора в Вт:
при изотермическом сжатии Nk = G∙lизотерм = -G∙R∙Tlnp2/p1,
при политропном сжатии Nk = G∙lполн = - G[n/(n – 1)]RT1[(p2/p1)(n-1)/n – 1],
при адиабатном сжатии
Nk = G∙lад = - G[k/(k – 1)]RT1[(p2/p1)(k-1)/k – 1].
Задача 5
Водяной дар с начальным давлением p1 и степенью сухости х1 поступает в пароперегреватель, где его температура повышается на Δt; после пароперегревателя пар изоэнтропно (по адиабате) расширяется в турбине до5давления p2. Определить по i-s-диаграмме количество теплоты, подведенной к пару в пароперегревателе qперегр, работу цикла Ренкина и степень сухости пара на выходе из турбины х4. Определить также термический КПД цикла.
Одним из термодинамических рабочих тел, которое широко используется в технологических машинах и аппаратах отрасли, является водяной пар. Образование пара и нагрев его до заданной температуры осуществляется в паровом котле и пароперегревателе, которые по существу являются теплообменными аппаратами. Для анализа процесса парообразования и определения параметров пара обычно используется i-s диаграмма водяного пара (рис. 1)

Рис. 1. Изображение процесса парообразования в i-s диаграмме.
1 - линия при постоянном рабочем давлении пара, соответствующая процессу парообразования.
2 - кривая насыщения.
В котле вода сначала нагревается от температуры t0 до температуры кипения t1 = tкип (отрезок 0-1), затем на отрезке 1-2 при постоянных значениях температуры t1 = tкип и рабочего давления p1 происходит превращение воды в пар и далее перегрев пара до t = t3 {отрезок 2-3).
Состав влажного насыщенного пара в области пол кривой насыщения 2 характеризуется степенью сухости влажного пара:
x = Mпар/Мвод + Мпар
Левая от критической точки ветвь кривой насыщения соответствует параметрам воды при температуре кипения и, следовательно, здесь х = 0, а правая ветвь - параметрам сухого насыщенного пара при х = 1.
Процессы нагрева воды, испарения воды в перегрева пара при p = const протекают в результате подвода соответствующих количеств теплоты: qводы, qпарообр и qперегр. Общее количество теплоты, требуемой для осуществления всего процесса 0-3, составляет:
q∑ = qводы + qпарообр + qперегр. = Δi воды +Δiпарообр + Δi перегр. = i3 – i0, Дж∙кг
и может быть определено по i-s диаграмме.
Цикл Ренкина осуществляется в паросиловой установке (рис 2), где в качестве рабочего тела используется перегретый пар, который после расширения в турбине (Т) направляется в конденсатор (К) и полностью конденсируется в воду Вода с помощью насоса (Н) подается в котлоагрегат. Б паровом котле (ПК) при постоянном давлении осуществляется нагрев воды до температуры кипения и ее испарение. Полученный пар поступает в пароперегреватель (ПП), который обычно составляет одно целое с паровым котлом, перегревается там до заданной рабочей температуры и затем снова используется в турбине.

Рис. 2. Схема паросиловой установки.
Изображение идеального цикла Ренкина в i-s-диаграмме водяного пара показано на рис.3.
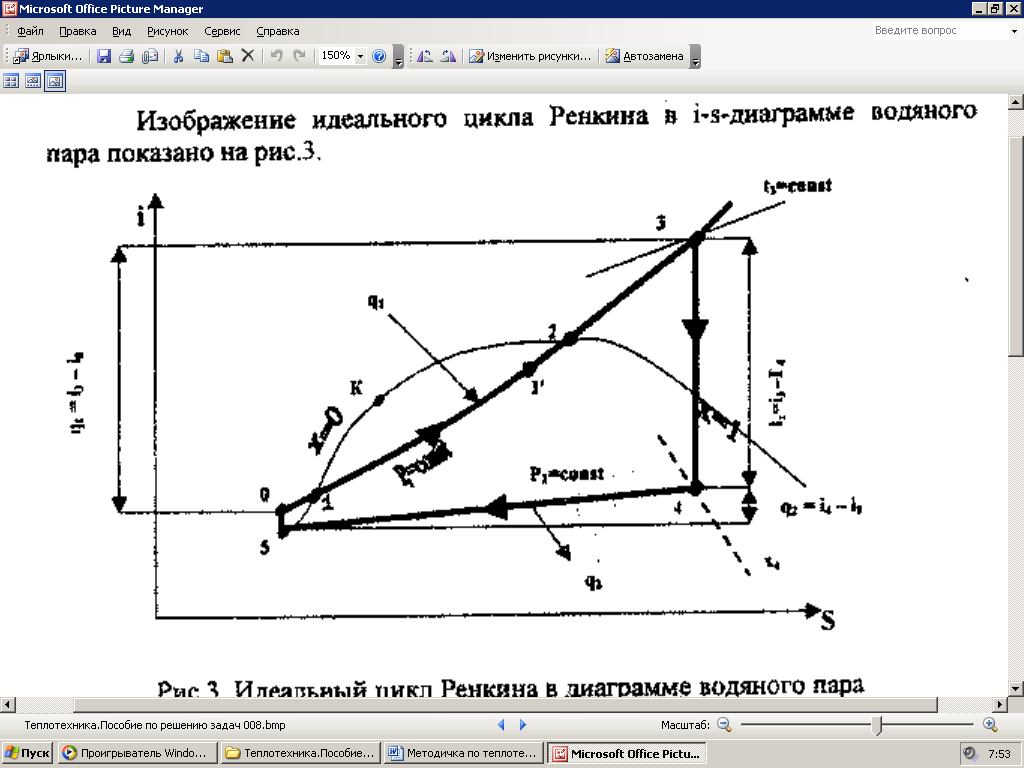
Рис. 3. Идеальный цикл Ренкина в диаграмме водяного пара.
В турбине перегретый пар адиабатно расширяется по линии 3-4. В соответствии с 1-м законом термодинамики для потока газа техническая работа, совершаемая паром в турбине, равна разности энтальпий пара до и после турбины: lт = i3 – i4, Дж/кг
За турбиной в точке 4 пар обычно бывает влажным. По линии 4-5 пар конденсируется в конденсаторе при постоянном давлении р2, следовательно, и постоянной температуре t2, равной температуре насыщения при этом давлении. Выделяющееся при конденсации тепло q2 отводится с охлаждаю шей водой. Из первого закона термодинамики для процессов при p=const следует:
q1 = i3-i0 ~ i3-i5;
q2 = i4-i5.
Термический КПД идеального цикла Ренкина, равный отношению полезной работы к затраченному теплу, определяется формулой:
ηt = lц/q1~ lтурб/q1~i3 – i4/ i3 – i5.
Величина энтальпии is соответствует температуре кипения воды при давлении р; и находится по таблицам.
Таким образом, методика решения данной задачи будет следующей :
- Температура пара иа входе в пароперегреватель (рис. 1)
t1' = tкип = t1
- Температура пара перед турбиной t3 = t1 + Δt
- По i-s диаграмме определяем теплоту, подведенную к пару в пароперегревателе, qпороперегр = i3 – i1/, Дж/кг.
- определяем работу цикла Ренкина (см. рис. 3):
1ц = 1т = i3 – i4, Дж/кг и затраченную теплоту q1 = i3 – i5, Дж/кг.
- Вычисляем термический КПД цикла ηt = i3 – i4/ i3 – i5.
- По i-s диаграмме определяется степень сухости пара х4

