
- •Глава 1 Электротехника
- •1.1 Понятие об электричестве
- •1.1.1 Строение вещества
- •1.1.2 Физическая природа электрического тока
- •1.1.3 Проводники, полупроводники и диэлектрики
- •1.1.4 Электрическое поле
- •1.2 Постоянный электрический ток
- •1.2.2 Электрическая цепь. Закон Ома
- •1.2.3 Соединение резисторов
- •1.2.4 Работа и мощность электрического тока
- •1.2.5 Тепловое действие электрического тока
- •1.3 Магнитные и электромагнитные явления
- •1.3.1 Постоянные магниты
- •1.3.2 Понятие о магнитном поле
- •1.3.3 Магнитное поле вокруг проводника с током
- •1.3.4 Намагничивание тел
- •1.3.5 Самоиндукция
- •1.3.6 Взаимоиндукция
- •1.3.7 Катушки индуктивности. Соединение индуктивностей
- •1.4 Ёмкость
- •1.4.1 Электрическая емкость. Соединение конденсаторов
- •1.5 Переменный ток
- •1.5.1 Получение переменного тока
- •1.5.2 Величины, характеризующие переменный ток
- •1.5.3 Векторная и развернутая диаграммы. Фаза и сдвиг фаз
- •1.5.4 Виды сопротивлений в цепях переменного тока
- •1.5.5 Понятие о трехфазном токе и получение его
- •1.5.6 Вращающееся магнитное поле и его получение
- •1.6 Трансформаторы
- •1.7 Электрические машины
- •1.7.1Асинхронный двигатель
- •1.7.2 Синхронный генератор трехфазного переменного тока
- •1.7.3 Генератор постоянного тока
- •1.7.4 Электрические двигатели постоянного тока
- •1.8 Выпрямление и стабилизация напряжения
- •1.8.1 Основные схемы выпрямления
- •1.8.2 Стабилизация напряжения в электрических цепях
- •1.9 Элементы Автоматики
- •1.9.1 Реле
- •1.9.2 Синхронные передачи. Сельсины
- •1.9.3 Понятие о следящих системах
- •1.9.4 Усилители автоматических устройств
- •Глава 2 Радиотехника
- •2.1 Электромагнитные колебания и колебательный контур
- •2.1.1 Свободные колебания в контуре
- •2.1.2 Вынужденные колебания в контуре
- •2.1.3 Резонанс в колебательном контуре
- •2.1.4 Связанные цепи
- •2.1.5 Колебательные системы сверхвысоких частот
- •2.2 Электровакуумные приборы
- •2.2.1 Термоэлектронная эмиссия
- •2.2.2 Устройство электронной лампы
- •2.2.3 Двухэлектродная лампа — диод
- •2.2.4 Трехэлектродная лампа — триод
- •2.2.5 Четырехэлектродная лампа — тетрод. Лучевой тетрод
- •2.2.6 Пятиэлектродная лампа — пентод
- •2.2.7 Триоды ультракоротких волн
- •2.2.8 Газоразрядные (ионные) приборы
- •2.3 Полупроводниковые приборы
- •2.3.1 Некоторые сведения об энергетической структуре вещества
- •2.3.2 Диэлектрики, полупроводники, проводники
- •2.3.3 Собственные и примесные полупроводники
- •2.3.4 Электронно-дырочный переход
- •2.3.5 Полупроводниковые диоды
- •2.3.6 Полупроводниковые триоды (транзисторы)
- •2.3.7 Схемы включения транзисторов
- •2.4 Усилители сигналов
- •2.4.1 Ламповые усилители на сопротивлении
- •2.4.2 Транзисторный усилитель на сопротивлении
- •2.4.3 Усилители мощности на триодах
- •2.4.4 Обратная связь в усилителях
- •2.5 Радиопередающие устройства
- •2.5.1 Общие сведения
- •2.5.2 Усилители мощности высокой частоты
- •2.5.3 Принцип работы лампового генератора с самовозбуждением (автогенератора)
- •2.5.4 Схемы автогенераторов
- •2.5.5 Стабилизация частоты радиопередающих устройств
- •2.5.6 Триодный генератор свч
- •2.5.7 Отражательный клистрон
- •2.5.8 Магнетронные генераторы
- •2.5.9 Амплитрон
- •2.5.10 Управление колебаниями высокой частоты
- •2.6 Линии передачи энергии высокой частоты
- •2.6.1 Бегущие и стоячие волны
- •2.6.2 Входное сопротивление линии
- •2.6.3 Типы фидерных линий и их применение
- •2.7 Антенные системы
- •2.7.1 Общие сведения
- •2.7.2 Вибраторные антенны
- •2.7.3 Рупорные и параболические антенны
- •2.8 Распространение радиоволн
- •2.8.1 Общие сведения
- •2.8.2 Особенности распространения ультракоротких волн (укв)
- •2.9 Радиоприёмные устройства
- •2.9.1 Общие сведения
- •2.9.2 Усилитель высокой частоты
- •2.9.3 Увч на лампе с бегущей волной (лбв)
- •2.9.4 Преобразователи частоты
- •2.9.5 Усилитель промежуточной частоты (упч)
- •2.9.6 Детектирование
- •2.9.7 Видеоусилитель
- •2.9.8 Автоматическая подстройка частоты и регулировка усиления в приемнике
- •2.10 Элементы импульсной техники
- •2.10.1 Основные определения
- •2.10.2 Формирование импульсов
- •2.10.3 Генераторы несинусоидальных напряжений
- •2.11 Индикаторные устройства
- •2.11.1 Назначение и типы индикаторных устройств
- •2.11.2 Принцип работы индикатора
- •2.11.3 Типовой индикатор кругового обзора
- •2.11.4 Канал формирования развертки дальности
- •2.11.5 Краткие сведения об индикаторах измерения высоты
- •Глава 3 Основы автоматизации систем управления
- •3.1 Принципы обработки радиолокационной информации (рли)
- •3.1.1 Понятие об обработке рли
- •3.1.2 Первичная обработка рли
- •3.1.3 Вторичная обработка рли
- •3.1.4 Понятие о третичной обработке рли
- •3.2 Основы передачи дискретной информации в асу
- •3.2.1 Назначение и структурная схема системы передачи дискретной информации
- •3.2.2 Виды модуляции сигналов в системах передачи дискретной информации
- •3.2.3 Помехоустойчивое кодирование
- •3.2.4 Понятие о фазировании распределителей
- •Глава 4 Принципы и методы радиолокации
- •4.1 Общие сведения
- •4.2 Методы радиолокации
- •4.3 Методы измерения дальности
- •4.4 Методы определения азимута и угла места
- •4.5 Системы селекции движущихся целей (сдц)
- •4.6 Потенциалоскопы
- •Глава 5 Основные характеристики рлс ртв
- •5.1 Тактические характеристики рлс ртв
- •5.2 Технические характеристики рлс
- •5.2.1 Передающие устройства
- •5.2.2Высокочастотный тракт
- •5.2.3 Антенные устройства
- •5.2.4 Приемное устройство рлс
- •5.2.5 Аппаратура защиты от пассивных помех (азпп)
- •5.2.6 Аппаратура защиты от активных помех (азап)
- •5.2.7 Системы вращения и качания антенн рлс
- •Глава 1 Электротехника……………………………………………………………………………...1
- •Понятие об электричестве…………………………………………………………………..1
- •1.1.1 Строение вещества…………………………………………………………………1
- •Глава 2 Радиотехника……………………………………………………………………………….58
- •Глава 3 Основы автоматизации систем управления…………………………………………….145
- •Глава 4 Принципы и методы радиолокации…………………………………………………….160
- •Глава 5 Основные характеристики рлс ртв……………………………………………………168
Глава 1 Электротехника
1.1 Понятие об электричестве
1.1.1 Строение вещества
Все тела, которые имеются в природе, состоят из мельчайших частичек, называемых молекулами. Молекулы разных веществ воды, железа, кислорода — отличаются друг от друга. Молекулы же одного вещества одинаковы. Они могут существовать отдельно и сохранять химические свойства этого вещества. В свою очередь молекулы состоят из еще более мелких частичек, которые называются атомами.
Атомом называется мельчайшая химически неделимая частица вещества. Так, молекула воды при делении распадается на два атома водорода и один атом кислорода; молекула соляной кислоты — на атом водорода и атом хлора. При этом свойства воды и кислоты теряются.
Молекулы различных веществ отличаются числом входящих в них атомов и их видом.
Великий русский ученый Д. И. Менделеев все простые тела, называемые элементами, на основании их свойств расположил в стройную таблицу, состоящую из рядов по восьми элементов в каждом (за исключением первого ряда), и открыл знаменитый периодический закон строения вещества, носящий его имя. На основании этого закона были предсказаны свойства элементов, которые тогда еще были неизвестны. Впоследствии часть этих элементов была открыта, причем предсказания Менделеева полностью подтвердились.
Молекулы и атомы располагаются на некотором расстоянии друг от друга и находятся в непрерывном движении. Это движение называют тепловые. Чем выше температура тела, тем быстрее движутся молекулы и атомы.
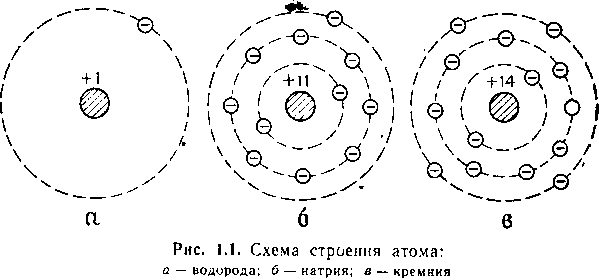
Раньше считали, что атом является пределом делимости вещества. Слово атом означает неделимый. Однако научные открытия в конце прошлого века показали, что атомы имеют сложное строение. Наглядные, но несколько упрощенные схемы строения некоторых атомов представлены на рис. 1.1.
Каждый атом состоит из ядра, относительно которого по круговым или эллиптическим орбитам непрерывно движутся еще более мелкие частички, называемые электронами. Каждый электрон характеризуется отрицательным зарядом (q = e= 1,6• 10-19 Кл), массой (m = 9,l1 • 10-31 кг) и собственным механическим моментом импульса, называемым спином (S=±1/2)
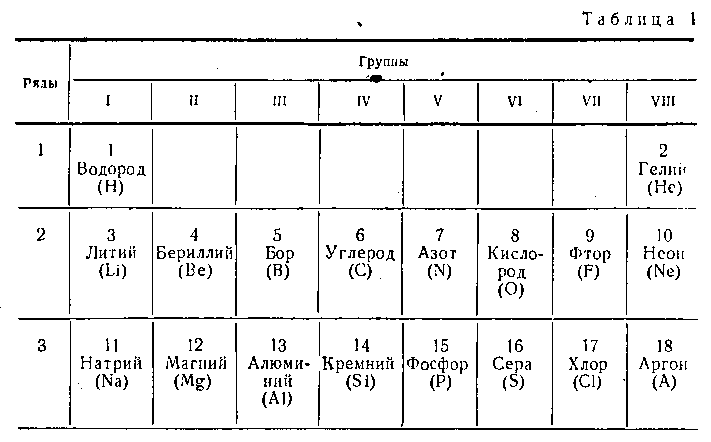
Число вращающиеся вокруг ядра электронов и расположение их зависят от того, в каком месте периодической системы Менделеева находится тот или другой элемент. Первые три ряда таблицы периодической системы элементов Д. И. Менделеева приведены в табл. 1.
Так, например, водород помещается на первом месте первого ряда таблицы, следовательно, вокруг ядра его атома вращается один электрон (рис. 1.1,а); натрий стоит под одиннадцатым номером (первое место третьего ряда) таблицы, следовательно, вокруг ядра атома его вращается 11 электронов, расположенных в три слоя: в первом — два, во втором — восемь (по числу элементов в рядах таблицы) и в третьем слое — один электрон (соответственно месту атома в ряду таблицы, т.е. валентности элемента). Кремний стоит на 14-м месте и имеет 14 электронов: два — в первом слое, восемь — во втором и четыре — в третьем.
Строение атомов натрия и кремния показано на рис. 1.1,б и 1.1,в.
Полное число электронов в слое равно числу элементов в ряду периодической системы.
Ядро атома также имеет сложное строение. Оно состоит из положительно заряженных частиц вещества, называемых протонами, и не заряженных электричеством частичек, которые называются нейтронами.
Заряд протона равен заряду электрона по величине, но по знаку противоположен. Число протонов в ядре атома равно числу электронов. Поэтому положительный заряд равен сумме отрицательных зарядов всех электронов, вращающихся вокруг ядра, и атом в целом нейтрален. Электроны, протоны и нейтроны в атом всех веществ одинаковы. Атомы различных веществ различаются между собой числом протонов и нейтронов в ядре и числом электронов, вращающихся вокруг ядра.
Если атом теряет или приобретает несколько электронов, то он становится электрически заряженным ионом. Нейтральный атом, потерявший электрон, является положительным ионом, а получивший электрон — отрицательным ионом.
Электрически заряженные частицы взаимодействуют между собой. Частицы, несущие разноименные электрические заряды, притягиваются, а несущие одноименные заряды, отталкиваются друг от друга. Ядро атома очень мало. Протоны, входящие в его состав, находятся на очень близких расстояниях. Сила взаимного отталкивания обратно пропорциональна квадрату расстояния между ними н поэтому очень велика. Однако под действием этих сил ядра не распадаются. Объясняется это тем, что кроме электрических в ядре действуют внутриядерные силы притяжения. Они прочно связывают все частицы ядра.
Проблема нарушения ядерных сил и деления ядра атома наукой и техникой решена. Огромная энергия, выделяющаяся при этом, называется атомной энергией, которая используется как в мирных, так и в военных целях.
