
- •Вопрос 1
- •Вопрос 2 история развития микробиологии
- •Вопрос 3
- •Вопрос 4
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •12. 12. Капсула
- •16. Использование в диагностике
- •Техника проведения окраски
- •Нуклеоид
- •Методика окраски
- •Результат окраски
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 41
- •Вопрос 40
- •53. Вопрос 53
- •Вопрос 54
- •Вопрос 55
- •Вопрос 56 Микрофлора почвы
- •Вопрос 57
- •59Вопрос
- •Вопрос 60
- •Вопрос 61
- •1) Патогенность (вирулентность);
- •2) Нозологическая специфичность и органотропность;
- •Вопрос 62
- •Вопрос 63
- •Вопрос 64
- •Вопрос 65
- •Вопрос 66.
- •Вопрос 67
- •Методы определения чувствительности бактерий к антибиотикам
- •Вопрос 68
- •Вопрос 69
- •Вопрос 70
- •Вопрос 71
- •Вопрос 72
- •Вопрос 73.
- •Вопрос 74
- •Вопрос 75
- •Центральные органы иммунной системы
- •Периферические органы иммунной системы
- •Вопрос 77
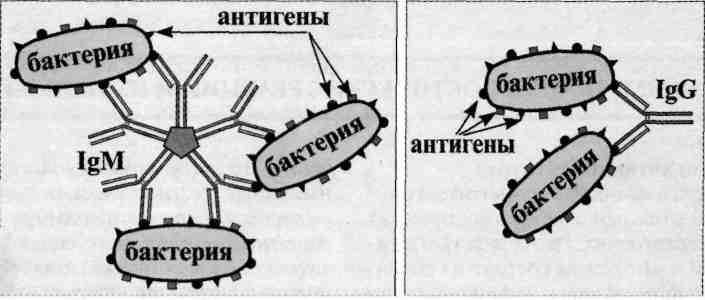
- •IgG обеспечивает:
- •IgM обеспечивает:
- •Вопрос 84
- •Вопрос 85
- •Вопрос 94
- •Вопрос 96
- •Вопрос 100
- •Определение и классификация
- •[Править]Причины
- •Вопрос 103
- •Вопрос 104
- •Вопрос 105
- •Вопрос 110
- •Вопрос 112
- •Вопрос 162
- •Вопрос 163
- •10.3.3. Возбудитель лямблиоза
Вопрос 85
Реакция агглютинации — простая по постановке реакция, при которой происходит связывание антителами корпускулярных антигенов (бактерий, эритроцитов или других клеток, нерастворимых частиц с адсорбированными на них антигенами, а также макромолекулярных агрегатов). Она протекает при наличии электролитов, например при добавлении изотонического раствора натрия хлорида.
Применяются различные варианты реакции агглютинации: развернутая, ориентировочная, непрямая и др. Реакция агглютинации проявляется образованием хлопьев или осадка (клетки, «склеенные» антителами, име ющими два или более антигенсвязывающих центра — рис. 13.1). РА используют для:
1) определения антител в сыворотке крови больных, например, при бруцеллезе (реакции Райта, Хеддельсона), брюшном тифе и паратифах (реакция Видаля) и других инфекционных болезнях;
2) определения возбудителя, выделенного от больного;
3) определения групп крови с использованием моноклональных антител против алло-антигенов эритроцитов.
Для определения у больного антител ставят развернутую реакцию агглютинации: к разведениям сыворотки крови больного добавляют диагностикум (взвесь убитых микробов,) и через несколько часов инкубации при 37 ˚С отмечают наибольшее разведение сыворотки (титр сыворотки), при котором произошла агглютинация, т. е. образовался осадок.
Характер и скорость агглютинации зависят от вида антигена и антител. Примером являются особенности взаимодействия диагностикумов (О- и H-антигенов) со специфическими антителами. Реакция агглютинации с О-диагностикумом (бактерии, убитые нагреванием, сохранившие термостабильный О-антиген) происходит в виде мелкозернистой агглютинации. Реакция агглютинации с Н-диагностикумом (бактерии, убитые формалином, сохранившие термолабильный жгутиковый Н-антиген) — крупнохлопчатая и протекает быстрее.
Если необходимо определить возбудитель, выделенный от больного, ставят ориентировочную реакцию агглютинации, применяя диагностические антитела (агглютинирующую сыворотку), т. е. проводят серотипирование возбудителя. Ориентировочную реакцию проводят на предметном стекле. К капле диагностической агглютинирующей сыворотки в разведении 1:10 или 1:20 добавляют чистую культуру возбудителя, выделенного от больного. Рядом ставят контроль: вместо сыворотки наносят каплю раствора натрия хлорида. При появлении в капле с сывороткой и микробами хлопьевидного осадка ставят развернутую реакцию агглютинации в пробирках с увеличивающимися разведениями агглютинирующей сыворотки, к которым добавляют по 2—3 капли взвеси возбудителя. Агглютинацию учитывают по количеству осадка и степени просветления жидкости. Реакцию считают положительной, если агглютинация отмечается в разведении, близком к титру диагностической сыворотки. Одновременно учитывают контроли: сыворотка, разведенная изотоническим раствором натрия хлорида, должна быть прозрачной, взвесь микробов в том же растворе — равномерно мутной, без осадка.
Разные родственные бактерии могут агглютинироваться одной и той же диагностической агглютинирующей сывороткой, что затрудняет их идентификацию. Поэтому пользуются адсорбированными агглютинирующими сыворотками, из которых удалены перекрестно реагирующие антитела путем адсорбции их родственными бактериями. В таких сыворотках сохраняются антитела, специфичные только к данной бактерии.
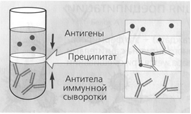
86) Реакция преципитации (РП) - это формирова¬ние и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количес¬твах; избыток одного из них снижает уровень образования иммунного комплекса.
РП ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др. Широкое рас¬пространение получили разновидности РП в полужидком геле агара или агарозы: двойная иммунодиффузия по Оухтерлони, радиальная иммунодиффузия, иммуноэлектрофорез и др.
Механизм. Проводится с прозрачными коллоид¬ными растворимыми антигенами, экстрагированными из патоло¬гического материала, объектов внешней среды или чистых культур бактерий. В реакции используют прозрачные диагности¬ческие преципитирующие сыворотки с высокими титрами анти¬тел. За титр преципитирующей сыворотки принимают то наибольшее разведение антигена, которое при взаимодействии с иммун¬ной сывороткой вызывает образование видимого преципитата — помутнение.
Реакция кольцепреципитации ставится в узких пробирках (диаметр 0,5 см), в которые вносят по 0,2—0,3 мл преципити-рующей сыворотки. Затем пастеровской пипеткой медленно наслаивают 0,1—0,2 мл раствора антигена. Пробирки осторожно переводят в'вертикальное положение. Учет реакции производят через 1—2 мин. В случае положительной реакции на границе между сывороткой и исследуемым антигеном появляется пре¬ципитат в виде белого кольца. В контрольных пробирках преци¬питат не образуется.
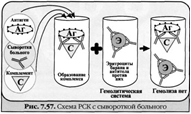
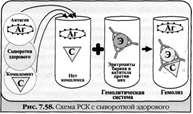
87) Реакция связывания комплемента (РСК) за¬ключается в том, что при соответствии друг другу антигены и антитела образуют иммун¬ный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), т. е. происходит связывание комплемента комп¬лексом антиген—антитело. Если же комплекс антиген—антитело не образуется, то комп¬лемент остается свободным.
Специфическое взаимодействие АГ и AT сопровождается адсорб¬цией (связыванием) комплемента. Поскольку процесс связыва¬ния комплемента не проявляется визуально, Ж. Борде и О.Жангу предложили использовать в качестве индикатора гемолитическую систему (эритроциты барана + гемолитическая сыворотка), кото¬рая показывает, фиксирован ли комплемент комплексом АГ-АТ. Если АГ и AT соответствуют друг другу, т. е. образовался иммунный комплекс, то комплемент связывается этим комплексом и гемоли¬за не происходит. Если AT не соответствует АГ, то комплекс не образуется и комплемент, оставаясь свободным, соединяется со второй системой и вызывает гемолиз.
Компоненты. Реакция связывания комплемента (РСК) относится к слож-ным серологическим реакциям. Для ее проведения необходимы 5 ингредиентов, а именно: АГ, AT и комплемент (первая система), эритроциты барана и гемолитическая сыворотка (вторая система).
Антигеном для РСК могут быть культуры различных убитых микроорганизмов, их лизаты, компоненты бактерий, патологи¬чески измененных и нормальных органов, тканевых липидов, ви¬русы и вирусосодержащие материалы.
В качестве комплемента используют свежую или сухую сыво¬ротку морской свинки.
Механизм. РСК проводят в две фазы: 1-я фаза — инкубация смеси, содержащей три компонента антиген + антитело + комплемент; 2-я фаза (инди¬каторная) — выявление в смеси свободного комплемента путем добавления к ней гемоли¬тической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содер¬жащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген—антите¬ло происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизирован¬ных антителами эритроцитов не произойдет; реакция положительная. Если антиген и ан¬титело не соответствуют друг другу (в иссле¬дуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит — ан-тиэритроцитарное антитело, вызывая гемо¬лиз; реакция отрицательная.
Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифи¬лиса (реакция Вассермана).
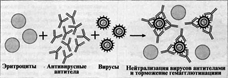
88) Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови.
Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении ан¬тигенов вирусов антителами иммунной сы¬воротки, в результате чего вирусы теряют свойство агглютинировать эритроциты.
РТГА применяют для диагностики мно¬гих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещево¬го энцефалита и др.) могут агглютинировать эритроциты различных животных.
Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток.
89) В-лимфоциты
В-лимфоциты — это преимущественно эффекторные иммунокомпетентные клетки, на долю которых приходится около 15 % всей численности лимфоцитов. Выделяют две субпопуляции В-лимфоцитов:
1. «обычные» В-клетки, не имеющие маркера CD5,
2. CD5+ В1-лимфоциты.
При электронной микроскопии В-лимфо¬циты имеют шероховатую поверхность, на которой определяются маркеры CD 19—22 и некоторые другие. Функцию антигенспецифического рецептора (BCR) выполняют
особые мембранные формы иммуноглобули¬нов. Клетки экспрессируют МНС II класса, ко-стимулирующие молекулы CD40, 80, 86, низкоаффинные FcR (к иммунным комплек¬сам и нативным молекулам иммуноглобулина класса G), рецептор к эритроцитам мыши, иммуноцитокинам и др.
Зрелые В-лимфоциты и их потомки — плаз¬матические клетки (плазмоциты) являются антителопродуцентами. Их основным продук¬том являются иммуноглобулины. Кроме того, В-лимфоциты являются профессиональными АПК.
Они участвуют в формировании:
1. гумо¬рального иммунитета,
2. В-клеточной иммуно¬логической памяти
3. гиперчувствительности немедленного типа.
Дифференцировка и созревание В-лимфоцитов происходят сначала в кос¬тном мозге, а затем в периферических орга¬нах иммунной системы, куда они отселяют¬ся на стадии предшественников. Потомками В-лимфоцитов являются клетки иммуноло¬гической памяти и плазматические клетки. Основные морфологические признаки пос¬ледних — обширная цитоплазма, развитый эндоплазматический ретикулум и аппарат Гольджи с большим количеством рибосом. Активно синтезирующий плазмоцит живет недолго, не более 2—3 суток.
В1-лимфоциты считают филогенетически наиболее древней ветвью антителопродуци-рующих клеток. Предшественники этих кле¬ток очень рано мигрируют в ткани слизистых, где автономно от центральных органов им-мунной системы поддерживают численность своей популяции. Клетки несут на своей мем¬бране маркер CD5. Они синтезируют низко¬аффинные IgA и IgM к полисахаридным и ли-пидным антигенам микробов и обеспечивают иммунную защиту слизистых от условно-па¬тогенных бактерий.
Функциональной активностью В-лимфоцитов управляют растворимые антигены и иммуноцитокины Т2-хелпера, макрофага и других клеток, например ИЛ-4, 5, 6.
90) Т-лимфоциты
Т-лимфоциты—это сложная посоставу группа клеток, которая происходит от полипотентной стволовой клетки костного мозга, а созревает
■шдифференцируется в тимусе из предшествен-Щ иков (пре- Т-лимфоциты). На долю этих клеток В приходится около 75 % всей лимфоидной по-■ вуляции. Отмечено, что на электроннограмме В" ice Т-лимфоциты имеют гладкую поверхность, К-нх общим маркером является CD3, а также ре-V вептор к эритроцитам барана. В зависимости от К строения Т-клеточного антигенного рецептора К (TCR) и функциональной направленности co¬if общество Т-лимфоцитов может быть разделено к на отдельные группы.
Различают два типа TCR. Первый 1 тип— гетеродимер, который состоит из двух полипептидных цепей; он характерен для традиционных Т-лимфоцитов, известных как Т-хелперы и Т-киллеры. Второй тип об¬наруживается на поверхности особой популя¬ции γδТ-лимфоцитов.
Профессионально Т-лимфоциты также разделяются на две субпопуляции:
1. иммунорегуляторы
2. эффекторы.
Задачу регуляции иммунного ответа (в основном активирую¬щую) выполняют Т-хелперы. Предполагалось существование Т-супрессоров, которым при¬писывали функцию торможения развития иммунной реакции (супрессия). Однако до тех пор клетка морфологически не иденти¬фицирована, хотя сам супрессорный эффект существует.
Эффекторную функцию осущест¬вляют цитотоксические лимфоциты: Т-кил¬леры и естественные киллеры.
В организме Т-лимфоциты обеспечивают клеточные формы иммунного ответа
1. гипер¬чувствительность замедленного типа,
2. транс¬плантационный иммунитет,
3. противоопухо¬левый иммунитет
4. противовирусный
5. определяют силу и продолжительность иммунной реакции.
Их созреванием, дифференцировкой и активнос¬тью управляют цитокины.
92) Синтез растворимых факторов является одним из универсальных способов коммутации клеток иммунной системы между собой и с другими клетками всего организма. К таковым относятся цитокины, коих в настоящее время известно более 25. Цитокины представляют собой гетеро¬генное семейство разнообразных по структуре и функции биологически активных молекул. Для них характерен ряд общих свойств:
• Как правило, цитокины не депонируются в клетке, а синтезируются после соответству¬ющего стимула;
• Для восприятия цитокинового сигнала клетка экспрессирует соответствующий ре¬цептор, который может взаимодействовать с несколькими различными цитокинами;
• Цитокины синтезируются клетками разных рос¬тков, уровней и направлений дифференцировки;
• Субпопуляции клеток иммунной систе¬мы различаются по спектру синтезируемых цитокинов и их рецепторов;
• Цитокины обладают универсальностью, множественностью эффектов и синергизмом;
• Цитокины могут воздействовать как на рядом расположенную клетку (паракринная регуляция), так и на сам продуцент (аутокринная регуляция);
• Цитокиновая регуляция носит каскадный характер: активация клетки одним цитокином вызывает синтез другого;
• В отличие от гормонов внутренней секре¬ции, в подавляющем большинстве это короткодистантные медиаторы — их эффекты проявля¬ются на месте выработки. Вместе с тем ряд провоспалительных цитокинов (ИЛ-1, -6, ФНО и др.) может оказывать системное действие.
Цитокины можно классифицировать в за¬висимости от их ведущей функциональной направленности:
• Медиаторы доиммунного воспаления (ИЛ-1, -6, -12, а-ФНО и др);
• Медиаторы иммунного воспаления (ИЛ-5, -9, -10, у-ИФН и др.);
• Регуляторы пролиферации и дифферен¬цировки лимфоцитов (ИЛ-2, -4, -13, р*-трансформирующий фактор роста ф-ТФР) и др.);
• Факторы роста клеток, или колониестимулирующие факторы (ИЛ-3, -7, ГМ-КСФ и др.);
• Хемокины, или клеточные хемоатграктанты (ИЛ-8 и др.).
93) Теория иммунитета Мечникова - теория, согласно которой решающая роль в антибактериальном иммунитете принадлежит фагоцитозу.
Сначала И.И.Мечников как зо¬олог экспериментально изучал морских беспозвоночных фауны Черного моря в Одессе и обратил внимание на то, что опре¬деленные клетки (целомоциты) этих животных поглощают инородные субстанции (твердые частицы и бактерий), проник¬шие во внутреннюю среду. Затем он увидел аналогию между этим явлением и поглощением белыми клетками крови позвоночных животных микробных телец. Эти процессы на¬блюдали и до И.И.Мечникова другие микроскописты. Но толь¬ко И.И.Мечников осознал, что это явление не есть процесс питания данной единичной клетки, а есть защитный процесс в интересах целого организма. И.И.Мечников первым рассмат¬ривал воспаление как защитное, а не разрушительное явление. Против теории И.И.Мечникова в начале XX в. были большин¬ство патологов, так как они наблюдали фагоцитоз в очагах воспаления, т.е. в больных местах, и считали лейкоциты (гной) болезнетворными, а не защитными клетками. Более того, не¬которые полагали, что фагоциты — разносчики бактерий по организму, ответственные за диссеминацию инфекций. Но идеи И.И.Мечникова устояли; ученый назвал действующие таким образом защитные клетки "пожирающими клетками". Его мо¬лодые французские коллеги предложили использовать гречес¬кие корни того же значения. И.И.Мечников принял этот ва¬риант, и появился термин "фагоцит". Эти работы и теория Мечникова чрезвычайно понравились Л.Пастеру, и он пригла¬сил Илью Ильича работать в свой институт в Париже.
Теория иммунитета Эрлиха — одна из первых теорий антителообразования, согласно которой у клеток имеются антигенспецифические рецепторы, высвобождающиеся в качестве антител под действием антигена.
В статье Пауля Эрлиха противомикробные вещества крови автор назвал термином "антитело", так как бактерий в то время называли термином "korper" — микроско¬пические тельца. Но П.Эрлиха "посетило" глубокое теорети¬ческое прозрение. Несмотря на то, что факты того времени свидетельствовали, что в крови неконтактировавшего с кон-кретным микробом животного или человека не определяются антитела против данного микроба, П.Эрлих каким-то образом осознал, что и до контакта с конкретным микробом в организ¬ме уже есть антитела в виде, который он назвал "боковыми цепями". Как мы теперь знаем, это именно так, и "боковые цепи" Эрлиха — это подробно изученные в наше время рецеп¬торы лимфоцитов для антигенов. Позже этот же образ мыслей П.Эрлих "применил" к фармакологии: в своей теории химиотерапии он предполагал предсуществование в организме рецеп¬торов для лекарственных веществ. В 1908 г. П.Эрлиху вручили Нобелевскую премию за гуморальную теорию иммунитета.
Также есть ещё некоторые теории.
Теория иммунитета Безредки - теория, объясняющая защиту организма от ряда инфекционных болезней возникновением специфической местной невосприимчивости клеток к возбудителям.
Инструктивные теории иммунитета — общее название теорий антителообразования, согласно которым ведущая роль в иммунном ответе отводится антигену, прямо участвующему в качестве матрицы при формировании специфической конфигурации антидетерминанты либо выступающему в качестве фактора, направленно изменяющего биосинтез иммуноглобулинов плазматическими клетками. Иммунологическая толе¬рантность — явле¬ние, противоположное иммунному ответу и иммунологической памяти. Проявляется она отсутствием специфического продуктивного иммунного ответа организма на антиген в связи с неспособностью его распознавания.
В отличие от иммуносупрессии имму¬нологическая толерантность предполагает изначальную ареактивность иммунокомпетентных клеток к определенному антигену.
Иммунологическую толерантность вызы¬вают антигены, которые получили название толерогены. Ими могут быть практически все вещества, однако наибольшей толерогенностью обладают полисахариды.
Иммунологическая толерантность быва¬ет врожденной и приобретенной. Примером врожденной толерантности является отсутс¬твие реакции иммунной системы на свои собственные антигены. Приобретенную толе¬рантность можно создать, вводя в организм вещества, подавляющие иммунитет (иммунодепрессанты), или же путем введения антигена в эмбриональном периоде или в первые дни после рождения индивидуума. Приобретенная толерантность может быть активной и пассив¬ной. Активная толерантность создается пу¬тем введения в организм толерогена, который формирует специфическую толерантность. Пассивную толерантность можно вызвать ве¬ществами, тормозящими биосинтетическую или пролиферативную активность иммунокомпетентных клеток (антилимфоцитарная сыворотка, цитостатики и пр.).
Иммунологическая толерантность отличает¬ся специфичностью — она направлена к строго определенным антигенам. По степени рас-пространенности различают поливалентную и расщепленную толерантность. Поливалентная толерантность возникает одновременно на все антигенные детерминанты, входящие в со¬став конкретного антигена. Для расщепленной, или моновалентной, толерантности характер¬на избирательная невосприимчивость каких-то отдельных антигенных детерминант.
Степень проявления иммунологической толе¬рантности существенно зависит от ряда свойств макроорганизма и толерогена.
Важное значение в индукции иммуноло¬гической толерантности имеют доза анти¬гена и продолжительность его воздействия. Различают высокодозовую и низкодозовую толерантность. Высокодозовую толерантность вызывают введением больших количеств вы-сококонцентрированного антигена. Низкодозовая толерантность, наоборот, вызывается очень малым количеством вы-сокогомогенного молекулярного антигена.
Механизмы толерантности многообразны и до конца не расшифрованы. Известно, что ее основу составляют нормальные процессы регуляции иммунной системы. Выделяют три наиболее вероятные причины развития имму¬нологической толерантности:
1. Элиминация из организма антигенспецифических клонов лимфоцитов.
2. Блокада биологической активности им-мунокомпетентных клеток.
3. Быстрая нейтрализация антигена анти¬телами.
Феномен иммунологической толерантнос¬ти имеет большое практическое значение. Он используется для решения многих важных проблем медицины, таких как пересадка ор¬ганов и тканей, подавление аутоиммунных реакций, лечение аллергий и других патоло¬гических состояний, связанных с агрессив¬ным поведением иммунной системы.
