
- •Теоретичні відомості
- •Хід роботи
- •Залежність оптичної густини Dx розчинів (рН 2) лактату заліза від концентрації молочної кислоти ([н2Лакт] позначено [l], d0-Dx позначено ∆d)
- •Лабораторна робота №2
- •Теоретичні відомості
- •Титрування кислотою або лугом
- •Лабораторна робота №3
- •Теоретичні відомості
- •Хід роботи
- •Лабораторна робота 4
- •Теоретичні відомості
- •Хід роботи
- •Лабораторна робота №5
- •Теоретичні відомості
- •Хід роботи
- •Лабораторна робота № 6. Тема: Визначення відносної, характеристичної та питомої в’язкості. Визначення молекулярної маси білків віскозиметричним методом
- •Теоретичні відомості
- •Хід роботи
- •Контрольні запитання для підготовки до роботи
- •Лабораторна робота №7
- •Теоретичні відомості
- •Хід роботи
- •Контрольні запитання для підготовки до роботи
- •Лабораторна робота № 8
- •Теоретичні відомості
- •Хід роботи
- •Список рекомендованої літератури
Лабораторна робота №2
Тема: Визначення концентрації водневих іонів і рК амінокислот
Мета: Визначення концентрації водневих іонів і рК амінокислот
Матеріали та прилади: 0,1 н розчини гліцину, 0,1 Н розчин КОН, 0,1 Н розчин НСl; мірні піпетки; склянки на 50 см3, рН-метр.
Теоретичні відомості
Концентрація іонів водню суттєво впливає на перебіг різноманітних біологічних процесів. Так, багато реакцій окиснення і відновлення органічних речовин в організмі змінюють свій напрямок при зміні концентрації іонів водню. Визначення концентрації іонів водню необхідне також у зв'язку з тим, що їх концентрація впливає на ступінь іонізації молекул, які беруть участь у багатьох біохімічних процесах. До таких процесів відносяться ферментативні реакції, конформаційні зміни білків і нуклеїнових кислот, зміна поведінки молекул при електрофоретичному і хроматографічному розділенні та інші.
Електролітичну дисоціацію води можна представити:
Н2О Н+ +ОН- , (2.1)
тоді константа дисоціації води:
К = [H+][OH-] / [H2O]. (2.2)
У розбавлених розчинах концентрація молекул води стала і дорівнює числу грамів води в 1 дм3 розчину, поділеному на молекулярну масу, тобто 1000/18 = 55,5 моль/дм3. Іонний добуток води (Кв) можна знайти за рівнянням:
Кв = [H+][OH-]. (2.3)
Величина іонного добутку води значною мірою залежить від температури (дисоціація води збільшується за підвищення температури). При кімнатній температурі Кв=10-14. Величина Кв дозволяє характеризувати всі розчини (нейтральні, кислі, лужні) за концентрацією іонів водню. Для зручності запису концентрації іонів водню Соренсен у 1920 р. ввів так звану шкалу рН, яка складена на основі іонного добутку води Кв. Шкала рН є способом позначення концентрації іонів водню в будь-якому водному розчині, кислотність якого лежить в межах 1 М Н+ і 1 М ОН-. Термін рН визначається виразом:
pН = – lg [Н+] або [H+] = 10-pH. (2.4)
Якщо концентрації іонів [Н+] = [ОН-] = 10-7 М, такий розчин називається нейтральним (рН = –lg [10-7] = 7). Коли [H+] > [OH-], тобто рН<7, розчин називається кислим, і навпаки, якщо [H+] < [OH-], тобто рН>7, розчин буде лужним.
Точні вимірювання рН в лабораторіях проводять за допомогою електродів з вибірковою чутливістю до іонів Н+. В приладі – рН-метрі – сигнал від цього електрода посилюється і порівнюється з сигналом, який генерується розчином з точно відомою величиною рН.
Характерною особливістю кислот є те, що у водному розчині вони прагнуть відщепити свій протон. Чим сильніша кислота, тим сильніше виражена ця тенденція. Здатність будь-якої кислоти НА відщеплювати протон і утворювати спряжену з нею основу А– характеризується константою рівноваги оборотної реакції НА Н+ + А-:
К’ = [H+][A-]/[HA]. (2.5)
Тобто НА та А– складають супряжену пару, НА є супряженою кислотою (донором протонів), а А– – супряженою основою (акцептором протонів).
Константа
дисоціації речовини записується як
 .
Звідси знаходимо:
.
Звідси знаходимо:

Прологарифмувавши цей вираз, отримуємо рівняння Гендерсона-Хассельбаха для розрахунку рН :
 (2.6)
(2.6)
З цього рівняння видно, що рК – це те значення рН, за якого концентрація кислоти дорівнює концентрації основи, [НА] = [А-].
«Силу» кислоти характеризують величиною рК. Для сильних кислот величини рК від’ємні. Наприклад, для НСl К = 103 і рК = –3. Ми будемо розглядати досить слабкі кислоти й основи, для яких К<<1. Наприклад, для НNО2 К = 4∙10-4 і рК = 3,4.
Амінокислоти мають різноманітні групи, що здатні до дисоціації.
Усі групи амінокислот, що здатні до іонізації, можуть бути подані в протонованій формі, тобто їх дисоціацію можна розглядати як кислотну (рис. 2.1).

Рис. 2.1. Дисоціація гліцину
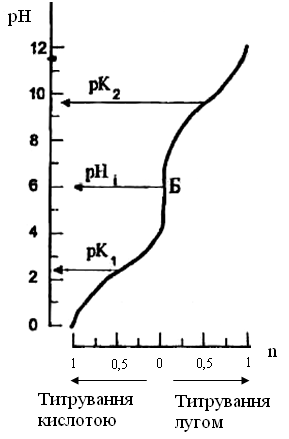
Оскільки всі амінокислоти містять принаймні дві групи, що здатні до дисоціації, то крива титрування має вигляд, наведений на рис. 2.2.
Як видно з рис. 2.2., два значення рК знаходяться порівняно далеко одне від одного. Значення pH ізоелектричної точки знаходять за формулою:

А
В
Рис. 2.2. Крива титрування амінокислот (пояснення в тексті)
Точці Б відповідає рНі, що характеризує нейтральний розчин амінокислоти, п – кількість еквівалентів доданої кислоти чи лугом
На
рис. 3.2.
рК1
відповідає
дисоціації карбоксильної групи, коли
є рівновага двох форм цієї групи А і Б
(рис. 2.1), їх співвідношення таке:
 ,
а рК2
– дисоціації аміногрупи, коли є рівновага
двох форм Б і В
(рис.
2.1) зі співвідношенням:
,
а рК2
– дисоціації аміногрупи, коли є рівновага
двох форм Б і В
(рис.
2.1) зі співвідношенням:
 .
.
Таблиця 2.1
