
- •Теоретичні відомості
- •Хід роботи
- •Залежність оптичної густини Dx розчинів (рН 2) лактату заліза від концентрації молочної кислоти ([н2Лакт] позначено [l], d0-Dx позначено ∆d)
- •Лабораторна робота №2
- •Теоретичні відомості
- •Титрування кислотою або лугом
- •Лабораторна робота №3
- •Теоретичні відомості
- •Хід роботи
- •Лабораторна робота 4
- •Теоретичні відомості
- •Хід роботи
- •Лабораторна робота №5
- •Теоретичні відомості
- •Хід роботи
- •Лабораторна робота № 6. Тема: Визначення відносної, характеристичної та питомої в’язкості. Визначення молекулярної маси білків віскозиметричним методом
- •Теоретичні відомості
- •Хід роботи
- •Контрольні запитання для підготовки до роботи
- •Лабораторна робота №7
- •Теоретичні відомості
- •Хід роботи
- •Контрольні запитання для підготовки до роботи
- •Лабораторна робота № 8
- •Теоретичні відомості
- •Хід роботи
- •Список рекомендованої літератури
НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ УКРАЇНИ
“КИЇВСЬКИЙ ПОЛІТЕХНІЧНИЙ ІНСТИТУТ”
Факультет біотехнології і біотехніки
Кафедра екобіотехнології та біоенергетики
«ЗАТВЕРДЖУЮ»
Завідувач кафедри екобіотехнології
та біоенергетики
______________ Кузьмінський Є.В.
«_____» ________________ 2012р.
Інструкція
до виконання лабораторних робіт
з дисципліни «Біофізика»
для студентів напряму 6.051401 «Біотехнологія»
спеціальностей: 7.05140101 «Промислова біотехнологія»,
7.05140105 «Екологічна біотехнологія та біоенергетика»
Рекомендовано кафедрою
екобіотехнології та біоенергетики
Протокол № ___ від « »________2012р.
Київ 2012
Лабораторна робота №1
Тема: Стандартна вільна енергія і константа рівноваги хімічної реакції.
Мета: Визначити зміну стандартної вільної енергії за константою рівноваги.
Матеріали та прилади: фотоколориметр МКМФ-1 або спектрофотометр, мірні колби (25 дм3), піпетки на 0,1; 0,2; 1; 2 та 5 см3, циліндри на 20 см3, 0,1 н соляна кислота, гліцин, хлорид натрію, вода дистильована, розчин молочної кислоти С=0,1 моль/дм3, розчин Fe(NO3)3 С=0,012 моль/дм3.
Приготування буферного розчину, рН 2. Розчин №1 – 0,1н соляна кислота. Розчин №2 – 7,507 г гліцину, 5,85 г хлориду натрію розчиняють у воді й доводять об’єм до 1 дм3. 519 см3 розчину №2 доводять до 1 дм3 розчином №1.
Теоретичні відомості
Біологічні об'єкти підпорядковуються законам термодинаміки, тому це дозволяє оцінювати енергетичний баланс у системі, а також напрямок біологічних процесів. У біологічних об'єктах більшість хімічних реакцій протікає при постійних температурах і тисках, тому робота, яка виконується, визначається через зміну вільної енергії Гіббса (ΔG). Об'єднання першого та другого закону термодинаміки дозволяє визначити ΔG як
 (1.1)
(1.1)
де
 —
зміна
ентальпії,
—
зміна
ентальпії,
 – зміна ентропії, Т – температура.
– зміна ентропії, Т – температура.
Вільна
енергія має ряд важливих властивостей,
які можна використовувати для
характеристики хімічних перетворень
у клітині. Якщо зміна вільної
енергії
для певної реакції від'ємна ( <
0), то така реакція перебігає довільно.
У даному разі спостерігається виділення
вільної енергії, і такий процес
називається
екзергонічним. Якщо перебіг реакції
відбувається зі збільшенням вільної
енергії
<
0), то така реакція перебігає довільно.
У даному разі спостерігається виділення
вільної енергії, і такий процес
називається
екзергонічним. Якщо перебіг реакції
відбувається зі збільшенням вільної
енергії
( > 0), тобто для її проходження необхідна додаткова енергія, то така реакція називається ендергонічною. У біологічних об'єктах, як правило, перебіг ендергонічних реакцій поєднаний у проміжних стадіях з екзергонічними реакціями.
За
величиною зміни вільної енергії Гіббса
можна визначити наближення
реакції
до стану рівноваги (у рівноважному стані
 ).
Положення
рівноважної
термодинаміки застосовуються для
вивчення хімічних перетворень. Нехай
відбувається проста хімічна реакція
типу
).
Положення
рівноважної
термодинаміки застосовуються для
вивчення хімічних перетворень. Нехай
відбувається проста хімічна реакція
типу
 (1.2)
(1.2)
Вільна енергія GA для речовини А залежить від концентрації [А] цієї речовини (за умови розбавленого розчину) за такою формулою:
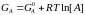 (1.3)
(1.3)
де
 – стандартна вільна енергія речовини
А, яка визначена за стандартних умов
(концентрація С
= 1 моль/
дм3,
тиск р =105
Па (1 атм),
Т=298
К; рН 7).
Тоді
зміна вільної енергії
для
реакції (1.2) буде
– стандартна вільна енергія речовини
А, яка визначена за стандартних умов
(концентрація С
= 1 моль/
дм3,
тиск р =105
Па (1 атм),
Т=298
К; рН 7).
Тоді
зміна вільної енергії
для
реакції (1.2) буде

Різниця
стандартних вільних енергій продуктів
реакції
 і початкових речовин
і
і початкових речовин
і
 є зміна стандартної вільної енергії
є зміна стандартної вільної енергії
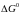 усієї
реакції (1.2).
Тоді
отримаємо такий вираз для зміни вільної
енергії реакції (1.2):
усієї
реакції (1.2).
Тоді
отримаємо такий вираз для зміни вільної
енергії реакції (1.2):
 (1.4)
(1.4)
З часом хімічна реакція досягає стану рівноваги і . За цієї умови з виразу (1.4) визначається зміна стандартної вільної енергії:
 (1.5)
(1.5)
де [А]р, [В]р і [С]р – концентрація речовин у стані рівноваги реакції (1.2). У хімічній кінетиці константа рівноваги Кр визначається таким співвідношенням:
 (1.6)
(1.6)
Тоді зв'язок зміни стандартної вільної енергії , з константою рівноваги Кр буде таким:
 (1.7)
(1.7)
Це формула Вант-Гоффа.
З даної формули видно: чим більша константа рівноваги, тим більше від'ємне значення стандартної вільної енергії. У табл. 1.1 наведено співвідношення між стандартною вільною енергією та константою рівноваги Кр.
Таблиця 1.1
Кр |
при 298 К |
Кр |
при 298 К |
0,001 |
17133 |
1,0 |
0 |
0,01 |
11422 |
10,0 |
-5711 |
0,1 |
5711 |
100,0 |
-11422 |
|
|
1000,0 |
-17133 |
Якщо в реакції (1.2) у початковий момент є 1 моль/дм3 речовини А і 1 моль/ дм3 речовини В, а =–17133 Дж/моль, тоді можна зробити висновок, що рівновага значно зміщена в напрямку утворення речовини С. Таким чином, у хімічних реакціях з великим від'ємним значенням рівноважна концентрація продуктів реакції значно переважає концентрацію реагентів.
У
даній роботі на прикладі однієї з простих
реакцій наведено спосіб визначення
константи рівноваги
Кр
і розрахунок за її величиною зміни
стандартної
вільної
енергії
 .
Вибрано реакцію молочної кислоти
СН3–СНОН–СООН
(Н2Лакт)
з тривалентним залізом
.
Вибрано реакцію молочної кислоти
СН3–СНОН–СООН
(Н2Лакт)
з тривалентним залізом
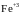 ,
оскільки в результаті такої реакції
утворюється
забарвлений продукт, який просто
реєструється на фотоколориметрі.
,
оскільки в результаті такої реакції
утворюється
забарвлений продукт, який просто
реєструється на фотоколориметрі.
Реакція записується так:
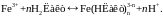 (1.8)
(1.8)
Константа рівноваги
 (1.9)
(1.9)
Щоб
знайти
Кр
необхідно знати
n,
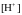 ,
,
 ,
,
 ,
,
 ,
тобто рівноважні концентрації вільної
Н2Лакт,
комплексу
,
тобто рівноважні концентрації вільної
Н2Лакт,
комплексу
 ,
незакомплексованого
заліза та координаційне число
n.
,
незакомплексованого
заліза та координаційне число
n.
Координаційне
число
п
визначається, виходячи з константи
нестійкості комплексу
,

 (1.10)
(1.10)
Далі логарифмуємо формулу (1.10)
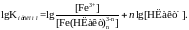
або
 (1.11)
(1.11)
Якщо
на осі ординат відкласти
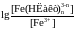 ,
а на осі абсцис –
,
а на осі абсцис – ,
тоді тангенс кута нахилу одержаної
прямої при однаковому
масштабі
чисельно буде дорівнювати
n.
Концентрація речовин визначається
за
допомогою фотоколориметра або
спектрофотометра.
,
тоді тангенс кута нахилу одержаної
прямої при однаковому
масштабі
чисельно буде дорівнювати
n.
Концентрація речовин визначається
за
допомогою фотоколориметра або
спектрофотометра.
Методика роботи на фотоколориметрі МКМФ-1. Фотоколориметр вимірює оптичну густину D (або світлопропускання Т) розчину відносно розчинника, оптична густина якого береться за нуль. Робочий діапазон вимірювання: довжиною хвиль – від 400 до 720 нм; за оптичною густиною – від 0 до 1,8; за світло пропусканням – від 5 до 100%. Прилад має оптичний і електронний блоки, які об’єднані загальним корпусом. Оптичну схему фотоколориметра МКМФ-1 наведено на рис. 1.1. Світловий потік від джерел світла 1 направляється конденсором 2 через фільтр 3, колімаційну лінзу 4, кювети 5 або 6, захисне скельце 8 на фотоелемент 9. Перед фотоелементом встановлено шторку-перемикач 7. На рис. 1.2. зображено конструкцію фотоколориметра МКМФ-1.
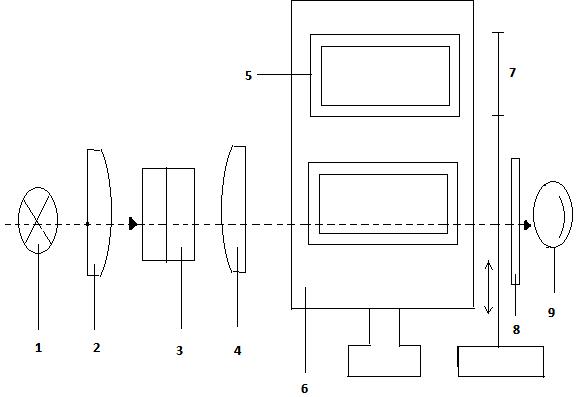
Рис.1.1. Оптична схема фотоколориметра МКМФ-1 (позначення в тексті)
Порядок виконання роботи на приладі
1. Увімкнути фотоколориметр перемикачем мережі 3. При цьому засвітиться світловипромінювальний діод 2. Прогріти прилад 1 год.
Розмістити в утримувачі 7 робочий світлофільтр (рис 1.2.). наповнити кювету дистильованою водою (або відповідним розчинником), розмістити кювету в кюветному відділенні 8 і зачинити кришку кюветного відділення.

Рис. 1.2. Фотоколориметр МКМФ-1:
1 – мікроамперметр; 2 – світловипромінювальний діод; 3 – перемикач мережі; 4 – рукоятка установки нуля; 5 – рукоятка установки 100% Т; 6 – світлозахисна кришка кюветного відділення; 7 – утримувач робочих світлофільтрів; 8 – кюветне відділення; 9 – утримувач робочих світлофільтрів; 10 – кришка
2. Настроювання фотоколориметра. Обертанням рукоятки установки нуля 4 привести стрілку мікроампер метра 1 на нульову відмітку шкали коефіцієнта пропускання Т так, щоб положення стрілки збіглося з її дзеркальним відображенням і зі штрихом відмітки. При цьому світловий потік необхідно перекрити шторкою або заглушкою світлового потоку. Потім відчинити шторку або зняти заглушку і обертаючи рукоятку установки 100%Т добитися зміщення стрілки мікроамперметра на відмітку «100» шкали коефіцієнта пропускання так, щоб положення стрілки збіглося з її дзеркальним відображенням і зі штрихом відмітки, яке відповідає нульовому значенню оптичної густини (або 100% Т).
3. Визначення коефіцієнта пропускання Т або оптичної густини D досліджуваних розчинів. Відчинити кришку кюветного відділення, вилити воду, заповнити кювету досліджуваним розчином, розмістити її в кюветному відділенні й зачинити кришку кюветного відділення. Зняти відлік зі шкали коефіцієнта пропускання або оптичної густини, записати його. Періодично проводити перевірку 100% за шкалою коефіцієнта пропускання або нуль за шкалою оптичної густини.
Вимірювання оптичної густини кожного досліджуваного розчину рекомендується проводити не менше трьох разів і вирахувати середнє арифметичне значення. Час безперервної роботи приладу не більше 8 год.
