
- •1.Предмет і методи хімії. Роль хімії в розвитку галузей промисловості і сільського господарства.
- •2.Основні закони хімії (закон збереження маси речовин, закон кратних відношень, закон сталості складу сполук, закон еквівалентів, закон Авогадро).
- •3.Будова атома. Періодичний закон і періодична система елементів д.І.Менделєєва.
- •4.Ковалентний зв’язок (полярний, неполярний). Механізм утворення ковалентного зв’язку.
- •5. Іонний зв’язок.
- •6.Оксиди, їх номенклатура, класифікація, способи добування, властивості.
- •7.Кислоти, їх номенклатура, класифікація, способи добування, властивості.
- •8.Основи, їх номенклатура, класифікація, способи добування, властивості.
- •9. Аморфні гідроксиди, їх номенклатура, класифікація, способи добування, властивості.
- •10.Солі, їх номенклатура, класифікація, способи добування, властивості.
- •11. Швидкість хімічної реакції та її залежність від різних факторів. Каталіз і каталізатори.
- •12. Незворотні і зворотні реакції. Хімічна рівновага. Константа хімічної рівноваги. Зміщення хімічної рівноваги. Принцип Ле Шательє.
- •13. Розчини та їх класифікація. Гідратна теорія розчинів д.І.Меделєєва.
- •14. Способи вираження концентрації розчинів (масова частка розчиненої речовини, молярна концентрація, еквівалентна концентрація).
- •15.Теорія електролітичної дисоціації. Дисоціація основ, кислот, солей. Ступінчаста дисоціація.
- •16.Ступінь і константа дисоціації. Сильні і слабі електроліти.
- •17. Реакція обміну між електролітами, умови їх необоротності.
- •18.Гідроліз. Ступінь гідролізу.
- •19.Окислювально –відновні реакції (овр), їх класифікація. Найважливіші окисники і відновники, їх використання.
- •20.Неметали сьомої групи
- •21.Неметали шостої групи.
- •22.Неметали п’ятої групи.
- •23.Неметали четвертої групи.
- •24.Положення металів в періодичній системі елементів, будова їх атомів. Фізичні та хімічні властивості металів. Ряд напруг металів.
- •25.Метали головної підгрупи першої групи. Натрій і Калій, знаходження їх в природі, добування, властивості, застосування.
- •26.Метали головної підгрупи другої групи. Магній і Кальцій, їх природні сполуки, властивості, добування, застосування.
- •27.Метали головної підгрупи третьої групи. Алюміній, його властивості, добування, застосування. Амфотерність оксиду і гідроксиду Алюмінію.
- •28.Метали побічної підгрупи шостої групи. Хром та його сполуки.
- •29.Метали побічної підгрупи сьомої групи. Манган та його сполуки.
- •30.Метали побічної підгрупи восьмої групи. Ферум та його сполуки.
- •31.Метали побічної підгрупи першої групи. Купрум та його сполуки.
8.Основи, їх номенклатура, класифікація, способи добування, властивості.
Складні речовини, які у водних розчинах дисоціюють з утворенням аніонів гідроксилу OH- і ніяких інших негативно заряджених йонів не утворюють, називаються основами.
![]()
Кислотність основ визначається числом гідроксогруп -OH- (гідроксид-аніонів OH-):
Натрій гідроксид NaOH– однокислотна основа;
Кальцій гідроксид Ca (OH)2– двокислотна основа/
Усі основи – тверді речовини. За розчинністю у воді їх поділяють на розчинні – луги і нерозчинні. Луги милкі на дотик, вони являють собою йонні сполуки. Нерозчинні основи – йонно-ковалентні сполуки.
Хімічні властивості лугів
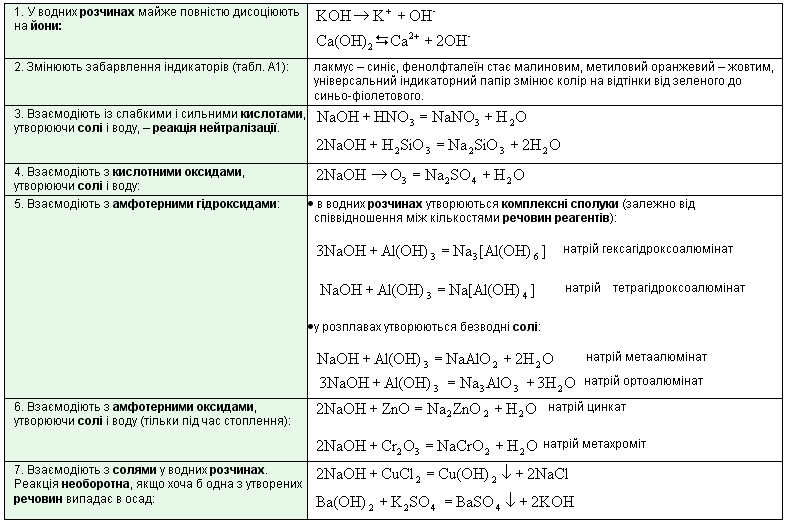
Добування лугів
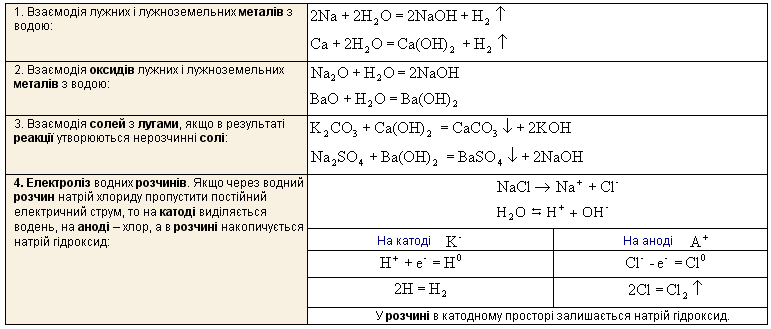
Хімічні властивості нерозчинних основ
1. Реакція нейтралізації із сильними кислотами:

9. Аморфні гідроксиди, їх номенклатура, класифікація, способи добування, властивості.
Амфотерність - здатність хімічної сполуки виявляти кислотні або основні властивості залежно від природи другого компонента, який бере участь у кислотно-основній взаємодії.

Хімічні властивості амфотерних гідроксидів
1. Виявляють основні властивості при взаємоді з кислотами і кислотними оксидами з утворенням солей, у яких хімічний елемент, який утворює амфотерний гідроксид, входить до складу катіона:
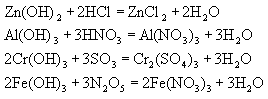
2. Виявляють кислотні властивості при взаємодії з основами та основними оксидами з утворенням солей, у яких хімічний елемент, який утворює амфотерний гідроксид, входить до складу кислотного залишку - аніона:
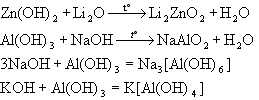
Прояв амфотерності гідроксидів у водних розчинах зводиться до утворення комплексних сполук (гідроксокомплексів), а в твердофазних системах - цинкатів, мета - і ортоалюмінатів та інш.
Добування амфотерних гідроксидів
Амфотерні гідроксиди добувають взаємодією відповідних солей з лугами або кислотами в еквівалентних кількостях:

10.Солі, їх номенклатура, класифікація, способи добування, властивості.
Складні
речовини, що у водних розчинах дисоціюють
на катіони металів (або амонію
![]() )
та аніони кислотних залишків, називаються
солями.
)
та аніони кислотних залишків, називаються
солями.

Хімічні властивості середніх солей
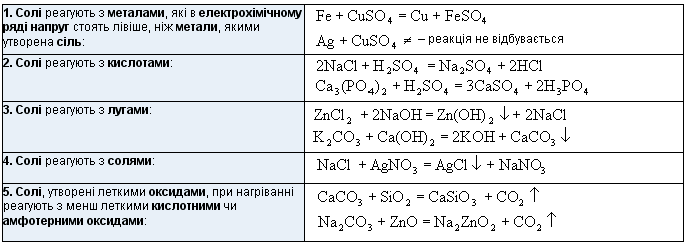
Найважливіші способи добування солей
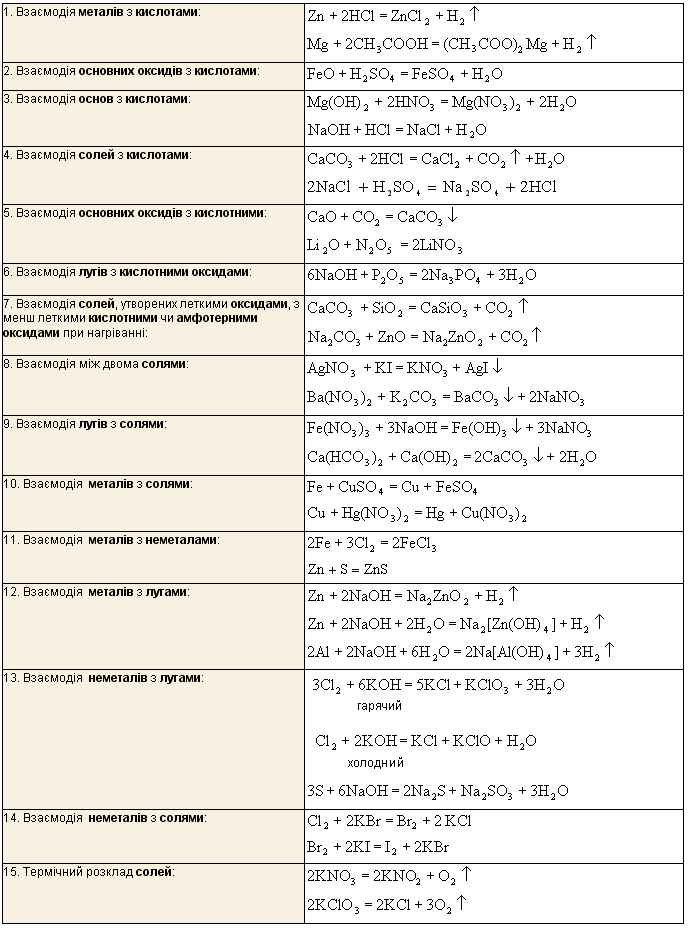
11. Швидкість хімічної реакції та її залежність від різних факторів. Каталіз і каталізатори.
Хімічна реакція – це процес, під час якого з одних речовин утворюються інші речовини, відмінні за хімічним складом і (або) будовою
Швидкістю хімічної реакції називають зміну молярної концентрації реагента або продукта реакції за одиницю часу в одиниці об’єму. Швидкість хімічної реакції при постійній температурі прямо пропорційна добуткові концентрацій реагуючих речовин у степенях, які дорівнюють стехіометричним коефіцієнтам у відповідному рівнянні реакції, наприклад швидкість хімічної реакції утворення води з Кисню та Водню, коли концентрації останніх С Н2 і С О2 можна визначити так:
v = k *C2H2 * CO2
Одиниця швидкості хімічної реакції – моль/(лwс).
Розрізняють реакції гомогенні та гетерогенні.
Реакції, що відбуваються в однорідній гомогенній фазі, наприклад у суміші газів, називають гомогенними, а ті реакції, які відбуваються на поверхні зіткнення твердої речовини і газу, твердої речовини і рідини, називають гетерогенними.
Швидкість хімічних реакцій залежить від природи реагуючих речовин, концентрації та температури. Для реакцій, що відбуваються в газах, ще й від тиску, для гетерогенних реакцій – від площі поверхні зіткнення реагуючих речовин. Швидкість багатьох реакцій залежить від наявності каталізатора.
Реакції, що відбуваються в присутності каталізатора, називаються каталітичними, а сам процес зміни швидкості реакції під впливом каталізатора – каталізом.
Каталізатори змінюють швидкість реакції за рахунок зміни механізму перебігу: з однією з реагуючих речовин каталізатор утворює проміжну сполуку – активований комплекс, який взаємодіє з іншою вихідною речовиною:
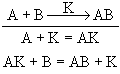
Роль каталізатора зводиться до того, що в його присутності реакція проходить при нижчій енергії активації.
Надлишкова, порівняно з середньою, енергія, яку повинні мати молекули для того, щоб їх зіткнення привело до утворення нової речовини, називається енергією активації.
Чим менша енергія активації, тим більша швидкість реакції.
Каталізатори широко використовуються у різних дослідженнях, у хімічний промисловості (синтез амоніаку, одержання азотної кислоти тощо). Без каталізу не обходиться проходження різних фізіологічних процесів.
Розрізняють гомогенний і гетерогенний каталіз.
Гомогенним називають каталіз, за яким і реагенти і каталізатор перебувають в однаковому агрегатному стані.
Якщо речовини і каталізатор перебувають у різних агрегатних станах, каталіз називається гетерогенним.
Під час гетерогенного каталізу реакції відбуваються на поверхні каталізатора, тому їхня швидкість залежить від площі та властивостей цієї поверхні. Каталізатор абсорбує молекули реагуючих сполук і збільшує їхню активність.
