
- •1.Предмет і методи хімії. Роль хімії в розвитку галузей промисловості і сільського господарства.
- •2.Основні закони хімії (закон збереження маси речовин, закон кратних відношень, закон сталості складу сполук, закон еквівалентів, закон Авогадро).
- •3.Будова атома. Періодичний закон і періодична система елементів д.І.Менделєєва.
- •4.Ковалентний зв’язок (полярний, неполярний). Механізм утворення ковалентного зв’язку.
- •5. Іонний зв’язок.
- •6.Оксиди, їх номенклатура, класифікація, способи добування, властивості.
- •7.Кислоти, їх номенклатура, класифікація, способи добування, властивості.
- •8.Основи, їх номенклатура, класифікація, способи добування, властивості.
- •9. Аморфні гідроксиди, їх номенклатура, класифікація, способи добування, властивості.
- •10.Солі, їх номенклатура, класифікація, способи добування, властивості.
- •11. Швидкість хімічної реакції та її залежність від різних факторів. Каталіз і каталізатори.
- •12. Незворотні і зворотні реакції. Хімічна рівновага. Константа хімічної рівноваги. Зміщення хімічної рівноваги. Принцип Ле Шательє.
- •13. Розчини та їх класифікація. Гідратна теорія розчинів д.І.Меделєєва.
- •14. Способи вираження концентрації розчинів (масова частка розчиненої речовини, молярна концентрація, еквівалентна концентрація).
- •15.Теорія електролітичної дисоціації. Дисоціація основ, кислот, солей. Ступінчаста дисоціація.
- •16.Ступінь і константа дисоціації. Сильні і слабі електроліти.
- •17. Реакція обміну між електролітами, умови їх необоротності.
- •18.Гідроліз. Ступінь гідролізу.
- •19.Окислювально –відновні реакції (овр), їх класифікація. Найважливіші окисники і відновники, їх використання.
- •20.Неметали сьомої групи
- •21.Неметали шостої групи.
- •22.Неметали п’ятої групи.
- •23.Неметали четвертої групи.
- •24.Положення металів в періодичній системі елементів, будова їх атомів. Фізичні та хімічні властивості металів. Ряд напруг металів.
- •25.Метали головної підгрупи першої групи. Натрій і Калій, знаходження їх в природі, добування, властивості, застосування.
- •26.Метали головної підгрупи другої групи. Магній і Кальцій, їх природні сполуки, властивості, добування, застосування.
- •27.Метали головної підгрупи третьої групи. Алюміній, його властивості, добування, застосування. Амфотерність оксиду і гідроксиду Алюмінію.
- •28.Метали побічної підгрупи шостої групи. Хром та його сполуки.
- •29.Метали побічної підгрупи сьомої групи. Манган та його сполуки.
- •30.Метали побічної підгрупи восьмої групи. Ферум та його сполуки.
- •31.Метали побічної підгрупи першої групи. Купрум та його сполуки.
3.Будова атома. Періодичний закон і періодична система елементів д.І.Менделєєва.
Періодичний закон і періодична система елементів Д.І.Менделєєва.
Вперше хімічні елементи спробував класифікувати А.Л.Лавуазьє, який поділяв елементи на метали та неметали. Цікаву спробу класифікації зробив німецький хімік І.В.Деберейнер. Проблему класифікації розглядали Д.П.Кук та М.Петтеркофер, Е.Ленсен, Ф.В.Гінрікс, француз Б. де Шанкуртуа, англієць Дж.Ньюлендс, В.Олдінг, німецький хімік Л.Мейєр… Проте всі згадані вчені не зуміли повністю розкрити загальну залежність між елементами, їм не вдалося знайти об’єктивний закон, що лежить в основі взаємозв’язку між хімічними елементами.
Д.І.Менделєєв відкрив періодичний закон у 1869 р. Розташовуючи всі відомі елементи в порядку зростання атомної маси, Д.І.Менделєєв встановив, що подібні в хімічному відношенні елементи чергуються в періодичній системі через правильні інтервали, а часто стоять поряд. Він також побачив, що для елементів є дуже важливим місце, яке вони займають у природному ряду.
Періодичний закон не можна звести до якоїсь дуже короткої формули. Тому його суть треба виражати такими положеннями:
Всі види речовинної матерії складаються з хімічних елементів – різних типів атомів.
Хімічні елементи перебувають у тісному взаємозв’язку і взаємозалежності так, що можуть бути розташовані у природний ряд, в якому кожний матиме тільки йому властивий порядковий номер.
Знаючи місце елемента у природному ряду, можна досить точно описати його властивості, здійснити виправлення атомної маси, валентності, зробити передбачення щодо синтезу нових сполук того чи іншого елемента.
Властивості хімічних елементів зі збільшенням порядкового номера змінюються періодично, так що через певне, але не завжди одне й те ж число номерів повторюються валентності елементів, форми хімічних сполук та деякі інші властивості.
Подібні елементи, крім періодичної віддаленості, можуть розташовуватись і поряд. Знаючи послідовність розподілу елементів, а також характер подібності між ними, можна робити передбачення нових елементів з попереднім описом їх властивостей, робити прогноз щодо місць знаходження їх у земній корі, оскільки подібні елементи майже зажди містяться в одних рудах.
Періодичний закон має графічний вираз у вигляді періодичної системи елементів.
Періодична система елементів.
Система складається з двох структурних одиниць – період і група. Період –це ряд елементів, в якому розташовано елементи зі зростання порядкових номерів і який розпочинається з лужного металу (або водню) і закінчується інертним елементом. У періодах спостерігається поступовий спад металічних властивостей елементів і наростання неметалічних с переходом до інертних. Існує сім періодів. Перший з них найменший, два малих, два великих, шостий – найбільший, сьомий незакінчений. Великі періоди складаються з двох підперіодів.
Важливою структурною одиницею періоду є група – ряд подібних елементів, що відносяться до різних періодів. Всього груп дев’ять. Кожна група складається з двох підгруп: головної і побічної. До кожної групи входять так звані типові елементи (це елементи малих періодів) і по два елементи від кожного великого періоду. У кожній групи елементи, що своїми властивостями нагадують типові, складають разом з ними головну підгрупу. Решта елементів групи входить до побічної підгрупи. Наприклад, елементи першої групи літій, натрій, калій, рубідій, цезій і францій – це головна підгрупа, а елементи мідь, срібло і золото входять до побічної підгрупи.
Крім груп та підгруп, у періодичній системі є такі ряди подібних між собою елементів, які знаходяться в одній і тій же групі і в одному періоді (за винятком платінових металів). Такі елементи складають родини. Наприклад, родини заліза (Fe, Co, Ni).
Розглянемо основні закономірності періодичної системи.
1.У малих періодах з зростанням відносних атомних мас елементів спостерігається поступове послаблення металічних і наростання неметалічних властивостей.
2.У великих періодах спостерігається деяка періодичність у зміні властивостей всередині самих періодів. Так, у парних рядах великих періодів металічні властивості елементів послаблюються повільно, в результаті всі елементи парних рядів – метали. У непарних рядах великих періодів властивості елементів змінюються так само, як і в елементів малих періодів: металічні властивості послаблюються, а неметалічні – посилюються.
3.Особливу подібність властивостей виявляють елементи, розміщені всередині великих періодів, наприкінці кожного парного ряду. Це та як звані тріоди: Ферум – Кобальт – Нікель, що утворюють родину Феруму, і дві інші: Рутеній – Родій – Паладій та Осмій – Іридій – Платина, що утворюють родину платинових металів (платиноїдів). Виділяють ще родину лантаноїдів ( 14 елементів шостого періоду) і родину антиноїдів (14 елементів сьомого періоду).
4. У групах у міру зростання відносних атомних мас елементів їхні металічні властивості посилюються, а неметалічні послаблюються (в елементів побічних підгруп бувають винятки).
5.У періодичній системі посилення металічних властивостей елементів у групах з верху в низ і послаблення їх у періодах з ліва на право зумовлюють появу діагональної подібності. Так, Берилій більше подібний до Алюмінію, ніж до Магнію, Бор – до Силіцію, ніж до Алюмінію.
6.У періодах максимальна валентність елементів (формальна) у сполуках з Оксигеном зростає: у малих періодах від 1 до 8, у великих періодах – в двічі, що й дало Д. І. Менделєєву підставу розмістити елементи великих періодів у два ряди.
7. У групах вища формальна валентність елементів за Оксигеном, як правило, відповідає номеру групи. Це справедливо для елементів головних підгруп, крім Флуору, Оксигену, Нітрогену та інертних газів. Елементи побічних груп можуть виявляти й іншу валентність. Так, Купрум – елемент першої групи побічної підгрупи – утворює оксиди Cu2O і CuO, де Купрум буває як одно -,так і двовалентний.
8. Елементи головних підгруп IV – VII груп. можуть утворювати легкі сполуки з Гідрогеном. Формальна валентність елементів за Гідрогеном дорівнює різниці між числом 8 і номером групи, в якій розміщується елемент.
Значення закону Менделєєва та періодичної системи полягає в тому, що:
закон дав наукову класифікацію хімічних елементів на групи і періоди, підперіоди і підгрупи, родини;
на базі закону та періодичної системи елементів стало можливим правільніше формулювання загальнохімічних понять;
періодичний закон показує, що максимальна валентність елементів майже завжди збігається з номером групи (Валентність – це здатність атома хімічного елемента приєднувати певне число атомів інших хімічних елементів. Під валентністю розуміють усю сукупність взаємодій між атомами, що сусідують в індивідуальній речовині.);
закон дав метод визначення та уточнення атомних мас;
завдяки закону стало можливим робити передбачення нових сполук для відомих елементів;
періодичний закон дозволив передбачити значну групу елементів (Ge, Ga, Sc…), які не були відомі у часи Менделєєва;
на базі періодичного закону було створено теорію будови атомів.
Будова атома.
Орбітальна модель будови атома. Атомне ядро.
Сучасні квантово-механічні уявлення про будову атома:
-в центрі атома є позитивно заряджене ядро, яке займає мізерну частину простору всередині атома;
-ядро атома складається з протонів і нейтронів, які утримуються в ядрі ядерними силами. Сума протонів (Z) і нейтронів (N) визначає масове число (А) атома:
A = Z + N
-кількість протонів у ядрі дорівнює порядковому номеру (протонному числу) елемента, а кількість нейтронів – різниці між масовим числом і зарядом ядра (числом протонів):
N = A – Z
-увесь позитивний заряд і майже вся маса атома зосереджені в його ядрі, оскільки маса електрона у стані спокою майже в 2000 разів менша від маси протона;
-навколо ядра з великою швидкістю рухаються електрони, утворюючи електронну оболонку ядра. Загальна кількість електронів дорівнює кількості протонів – порядковому номеру елемента;
-рух електрона в атомі, як і будь-яких інших елементарних частинок, не можна описувати законами класичної механіки, оскільки електрон виявляє властивості як частинки, так і хвилі. Він не має певної траєкторії руху, а наповнює простір навколо ядра у формі хвилі. Його негативний заряд при цьому виявляється “розмазаним” у всьому об’ємі простору навколо ядра;
-положення електрона в ядрі неможливо однозначно визначити (принцип невизначеності Гейзенберга), оскільки він може перебувати у будь-якій частині навколоядерного простору, але вірогідність його перебування в різних частинах простору неоднакова.
Частина простору навколо ядра, у межах якої ймовірність перебування електрона перевищує 90%, називається електронною хмарою або орбіталлю.
Нукліди – це різновиди атомів (атомних ядер) з певним числом протонів і нейтронів.
Кожний нуклід характеризується трьома параметрами:
А –масовим числом;
Z – зарядом ядра, що дорівнює числу протонів;
N – числом нейтронів у ядрі.
Ці параметри зв’язані співвідношенням A = Z + N. Їх записують у такий спосіб:
![]()
Ізотопи - це нукліди одного хімічного елемента, які мають однакове протонне число, але різне масове число.
Оскільки в природі для більшості хімічних елементів виявлено щонайменше по два нукліди , то атомні маси елементів у періодичній системі хімічних елементів Д.І.Менделєєва є середнім значенням з масових чисел кожного з нуклідів з урахуванням їхньої атомної частки в природі.
Нукліди можуть бути стабільні й радіоактивні.
Стан електрона в атомі. Розподіл електронів за орбіталями.
Властивості електрона в атомі визначаються його енергією, а енергія електрона – способом його руху. Кожному способу руху електрона відповідає атомна орбіталь АО, певної форми і розміру:
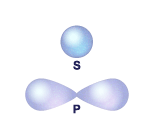
Форма s – і p – орбіталей
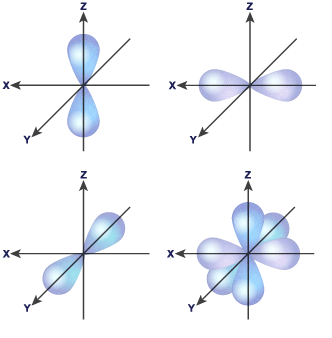
Схема взаємного розміщення p – орбіталей у просторі
Енергія електрона в атомі має не будь-які значення, а лише суворо визначені. Таку властивість енергії електрона називають квантуванням (квант – порція). Кожний електрон в атомі можна однозначно характеризувати набором чотирьох квантових чисел: головного, орбітального, магнітного і спінового.
Головне квантове число n визначає енергію електрона і віддаленість його від ядра. Воно має значення 1, 2, 3, 4 і до і показує номер енергетичного рівня. Із збільшенням номера рівня енергія електрона зростає. Максимальна кількість енергетичних рівнів, яку може мати атом в основниму стані, відповідає номеру періода, в якому розміщений хімічний елемент.
Орбітальне квантове число l визначає форму атомної орбіталі. Воно має значення від 0 до n – 1 ( l = 0, 1, 2, 3, … n – 1). Кожному значенню l відповідає орбіталь особливої форми. Якщо l = 0, орбіталь має сферичну форму (s-орбіталь). Якщо l = 1 – форму гантелі (p-орбіталь).
Складнішу форму мають орбіталі, які відповідають значенням l = 2 і 3 (d- і f-орбіталі). Отже, енергетичний рівень із значенням головного квантового числа n має n підрівнів.
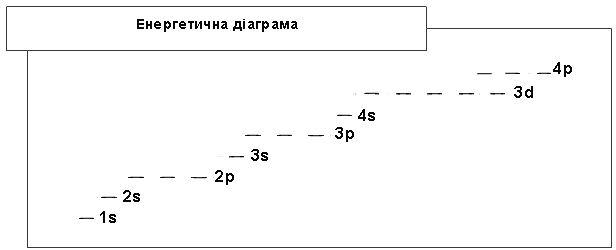
Значення енергії, яку має електрон на підрівні, зростає від s-підрівня до р-підрівня, від р- до d-підрівня і т.д., що показує енергетична діаграма:
Магнітне квантове число m визначає положення атомної орбіталі у просторі відносно зовнішнього магнітного або електричного поля. Воно зв’язано з орбітальним квантовим числом і показує, скільки може бути орбіталей з певним значенням l. Для s-електронів можливе лише одне значення m, для р-електронів – три, для d-електронів – п’ять значень, для f-електронів – сім значень m:
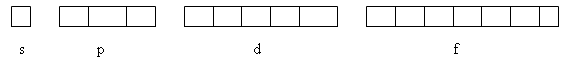
Число енергетичних комірок визначається значенням магнітного квантового числа.
Спінове квантове число s засвідчує, що електрони в атомі обертаються не лише в просторі навколо ядра, що визначається квантовими числами n, l, m, a мають ще свій власний рух – спін. Цей рух характеризується спіновим квантовим числом s, яке може мати тільки два значення +1/2 або –1/2. Вони відповідають двом протилежним напрямам власного магнітного момента електрона. Спін зображують протилежно напрямленими стрілками:
![]()
Принцип Паулі: в атомі не може бути двох електронів з однаковими значеннями усіх чотирьох квантових чисел. На одній АО може перебувати не більше двох електронів з протилежними спінами:
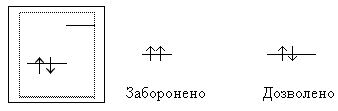
Правило Хунда: у межах одного підрівня електрони розташовуються у такий спосіб, аби їх сумарний спін був максимальним:
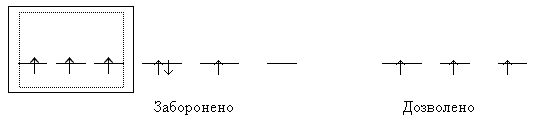
Правило Клечковського: порядок заповнення орбіталей електронами відбувається у напрямі зростання суми головного й орбітального квантових чисел (n + l). У першу чергу забудовуються такі електронні стани, які відповідають мінімальним значенням n:
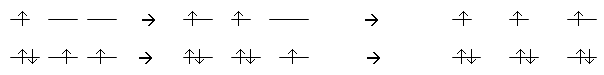
А при однакових значеннях суми (n + l) - у напрямі зростання значення головного квантового числа n.
Згідно з цим правилом заповнення електронами всіх енергетичних рівнів і підрівнів відбувається залежно від їхньої енергії у такій послідовності: 1s<2s<3s<3p<4s » 3d<4p<5s » 4d<5p<6s » 5d » 4f<6p<7s і т. д.
Залежність властивостей елементів від періодичної зміни електронних структур атомів. Радіус атома. Електронегативність.
Із зростанням заряду ядра атомів притягання ядром електронних оболонок посилюється, відбувається їх “стискання”, і радіус атома зменшується. Тому в елементів, що розміщуються на початку періода, великий радіус атома. У періодах радіус атомів елементів зменшується, а в групах (головних підгрупах) – зростає.
Електронегативність – умовна величина, що характеризує здатність атома в хімічній сполуці притягувати до себе електрони.
Чим вища електронегативність елемента, тим яскравіше виявлені у нього неметалічні властивості. Найбільша здатність до притягування електронів властива Флуору F, найменша - Cs.
У періодах електронегативність елементів зростає зліва направо, а в групах (головних підгрупах) – знизу вгору.
Подібність властивостей окремих елементів, що перебувають у різних періодах, пояснюється подібністю будови зовнішнього енергетичного рівня їх атомів.
У межах головних підгруп властивості елементів у міру зростання протонного числа закономірно змінюються: з одного боку, посилюється металічна активність елементів, що виявляється у більшій легкості віддавання електронів, тобто у зменшенні електронегативності, а з іншого боку, послаблюється неметалічна активність, тобто знижується здатність атомів до приєднання електронів. Це пояснюється збільшенням радіуса атома.
У межах періоду із збільшенням протонного числа металічна активність елементів послаблюється, електронегативність збільшується, радіус атомів зменшується.
Зв’язок між будовою атомів і властивостями речовин показаний у табл. 1.2.3 на прикладі елементів третього періоду.
Формули вищих оксидів
Характеристики елементів та їхніх сполук |
|
|||||||
|
І |
ІІ |
ІІІ |
IV |
V |
VI |
VII |
VIII |
Хімічний знак |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
Протонне число |
+11 |
+12 |
+13 |
+14 |
+15 |
+16 |
+17 |
+18 |
Розподіл електронів за енергетичними рівнями |
2.8.1 |
2.8.2 |
2.8.3 |
2.8.4 |
2.8.5 |
2.8.6 |
2.8.7 |
2.8.8 |
Схема будови зовнішнього шару |
Na
3s1 |
Mg
3s2 |
Al
3s23p1 |
Si
3s23p2 |
P
3s23p3 |
S
3s23p4 |
Cl
3s23p5 |
Ar
3s23p6 |
Властивості простої речовини |
Метал |
Метал |
Перехідний Метал |
Неметал |
Неметал |
Неметал |
Неметал |
Інертний Газ |
Ступінь окиснення атомів елемента у вищому оксиді та гідроксиді |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
- |
Формули вищих оксидів та гідратів оксидів |
Na2O
NaOH |
MgO
Mg(OH)2 |
Al2O3
Al(OH)3
H3AlO3 |
SiO2
H2SiO3 |
P2O5
H3PO4 |
SO3
H2SO4 |
Cl2O7
HСlO4 |
- |
Властивості оксидів і гідратів оксидів |
Основний |
Основний |
Аморфний |
Кислотний |
Кислотний |
Кислотний |
Кислотний |
|
Ступінь окиснення атомів елемента в леткій сполуці з Гідрогеном |
|
|
|
-4 |
-3 |
-2 |
-1 |
- |
Формула леткої сполуки неметалічного елемента з Гідрогеном |
|
|
|
SiH4 |
PH3 |
H2S |
HCl |
|
