
- •1.Предмет і методи хімії. Роль хімії в розвитку галузей промисловості і сільського господарства.
- •2.Основні закони хімії (закон збереження маси речовин, закон кратних відношень, закон сталості складу сполук, закон еквівалентів, закон Авогадро).
- •3.Будова атома. Періодичний закон і періодична система елементів д.І.Менделєєва.
- •4.Ковалентний зв’язок (полярний, неполярний). Механізм утворення ковалентного зв’язку.
- •5. Іонний зв’язок.
- •6.Оксиди, їх номенклатура, класифікація, способи добування, властивості.
- •7.Кислоти, їх номенклатура, класифікація, способи добування, властивості.
- •8.Основи, їх номенклатура, класифікація, способи добування, властивості.
- •9. Аморфні гідроксиди, їх номенклатура, класифікація, способи добування, властивості.
- •10.Солі, їх номенклатура, класифікація, способи добування, властивості.
- •11. Швидкість хімічної реакції та її залежність від різних факторів. Каталіз і каталізатори.
- •12. Незворотні і зворотні реакції. Хімічна рівновага. Константа хімічної рівноваги. Зміщення хімічної рівноваги. Принцип Ле Шательє.
- •13. Розчини та їх класифікація. Гідратна теорія розчинів д.І.Меделєєва.
- •14. Способи вираження концентрації розчинів (масова частка розчиненої речовини, молярна концентрація, еквівалентна концентрація).
- •15.Теорія електролітичної дисоціації. Дисоціація основ, кислот, солей. Ступінчаста дисоціація.
- •16.Ступінь і константа дисоціації. Сильні і слабі електроліти.
- •17. Реакція обміну між електролітами, умови їх необоротності.
- •18.Гідроліз. Ступінь гідролізу.
- •19.Окислювально –відновні реакції (овр), їх класифікація. Найважливіші окисники і відновники, їх використання.
- •20.Неметали сьомої групи
- •21.Неметали шостої групи.
- •22.Неметали п’ятої групи.
- •23.Неметали четвертої групи.
- •24.Положення металів в періодичній системі елементів, будова їх атомів. Фізичні та хімічні властивості металів. Ряд напруг металів.
- •25.Метали головної підгрупи першої групи. Натрій і Калій, знаходження їх в природі, добування, властивості, застосування.
- •26.Метали головної підгрупи другої групи. Магній і Кальцій, їх природні сполуки, властивості, добування, застосування.
- •27.Метали головної підгрупи третьої групи. Алюміній, його властивості, добування, застосування. Амфотерність оксиду і гідроксиду Алюмінію.
- •28.Метали побічної підгрупи шостої групи. Хром та його сполуки.
- •29.Метали побічної підгрупи сьомої групи. Манган та його сполуки.
- •30.Метали побічної підгрупи восьмої групи. Ферум та його сполуки.
- •31.Метали побічної підгрупи першої групи. Купрум та його сполуки.
24.Положення металів в періодичній системі елементів, будова їх атомів. Фізичні та хімічні властивості металів. Ряд напруг металів.
Елементи періодичної системи четвертої та третьої групи, крім Н, Не та В, мають металічну природу.
Особливості будови атомів металічних елементів .
Для більшості елементів-металів характерна невелика кількість електронів на зовнішньому енергетичному рівні їх атомів (від 1 до 3) і порівняно великі радіуси атомів, що зумовлює здатність атомів металів легко втрачати валентні електрони й утворювати позитивно заряджений йон.
Металічний зв’язок -це особливий тип хімічного зв’язку, який виникає в кристалі металу, внаслідок віддавання окремими його атомами валентних електронів. Останні циркулюють всередині кристалу (“електронний газ”), стають усуспільненими всіма йонами металу і міцно їх зв’язують.
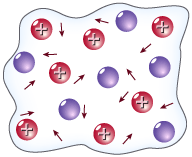
Металічний зв’язок є ненапрямленим, оскільки валентні електрони розподілені по всьому кристалі майже рівномірно. Він існує в кристалах і розплавах металів і сплавів, у чистому вигляді характерний для лужних і лужноземельних металів. У перехідних металів зв’язок між атомами частково є ковалентним. Наявність металічного зв’язку зумовлює спільні властивості металів.
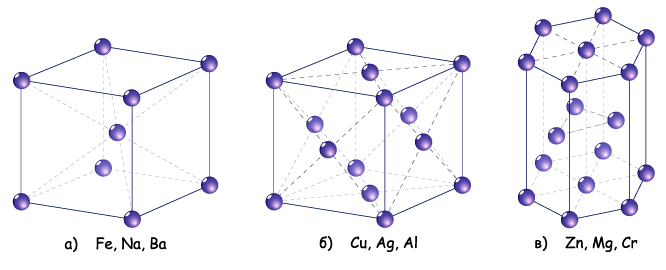
Кристалічні гратки металів.
У вузлах кристалічних граток металів містяться атоми та позитивно заряджені йони. Між ними постійно рухаються електрони. За рахунок електростатичного притягання між йонами та електронами забезпечується певна стабільність кристалічних граток металів.
Фізичні властивості металів.
Для металів характерні:
-металічний блиск внаслідок розсіювання світла електронами. Найкраще відбивають світло індій In та срібло Ag;
-кристалічна будова, крім ртуті Hg та францію Fr;
-сріблясто-білий колір (Ag, Al, Ni) або сріблясто-сірий (Fe, Pb), за винятком золота Au та міді Cu. За забарвленням метали умовно поділяють на чорні й кольорові. До чорних металів найчастіше відносять залізо та його сплави (чавун, сталь). Усі інші – називають кольоровими.
-теплова й електрична провідність, що зумовлена постійним рухом електронів у кристалі. За стандартних умов найвищу електричну провідність має срібло Ag, на другому місці – мідь Cu, далі золото Au і алюміній Al;
-твердість металів порівнюють із твердістю алмазу. Найтвердішими з металів є хром Cr і вольфрам W. Найм’якішими – є лужні метали, натрій Na і калій K легко ріжуться ножем;
-пластичність металів, їхня здатність необоротно деформуватися під дією механічних навантажень пояснюється можливістю переміщення (ковзання) одних шарів йонів металів відносно інших завдяки наявності “електронного газу”. Пластична деформація пояснюється розривом деяких міжатомних зв’язків і утворенням нових. Найпластичнішим металом є золото Au, а стибій Sb – дуже крихкий метал;
-розчинність. Усі метали не розчинні у воді, але розчиняються один в одному у розплавах
Твердий розчин одного металу в іншому називають сплавом.
- густина. За густиною метали поділяють на легкі r< 5 г/см3 і важкі r > 5 г/см3.
Типові легкі метали – літій Li, натрій Na, магній Mg, алюміній Al. До важких металів належить цинк Zn, залізо Fe, мідь Cu, свинець Pb, ртуть Hg, золото Au. Найважчим з металів є осмій Os.
-температура плавлення найвища у вольфраму 3380oC, найнижча – у ртуті -30oC
За температурою плавлення метали поділяються на легкоплавкі tпл < 1000o C - натрій, магній, алюміній і тугоплавкі tпл > 1000oC - мідь, залізо, хром, титан, молібден.
Хімічні властивості металів.
Метали :
-взаємодіють з неметалами:
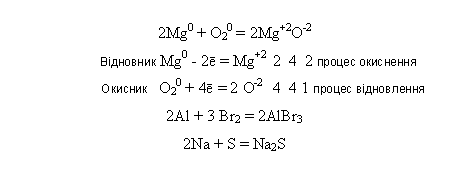
-взаємодіють з водою:
Лужні й лужноземельні метали взаємодіють з водою за стандартних умов з утворенням лугів:
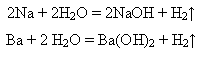
Менш активні метали реагують з водою при нагріванні:
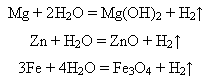
-взаємодіють з кислотами:
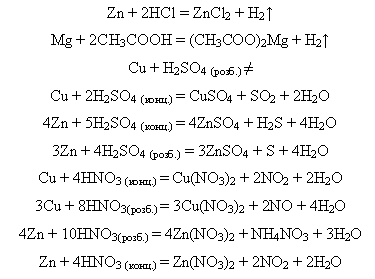
-взаємодіють з солями:
Реакція відбувається тільки у водному розчині: активніші метали витісняють менш активні:
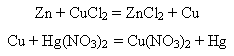
-взаємодіють з оксидами:
Активні метали відновлюють менш активні з оксидів під час нагрівання – металотермія:
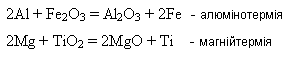
-взаємодіють з лугами:
Метали, яким відповідають амфотерні гідроксиди, реагують з лугами:
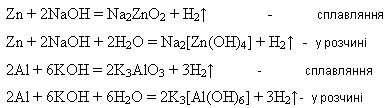
Хімічна активність металів визначається здатністю їх атомів віддавати валентні електрони, тобто окиснюватись і перетворюватись на катіони (позитивно заряджені йони).
Чим легше метали віддають електрони, тим вони хімічно активніші, тим вони є сильнішими відновниками.
За активністю метали розташовано у певний ряд (ряд Бекетова, витискувальний ряд, ряд активності, електрохімічний ряд металів):
![]()
![]()
-кожний метал цього ряду може витіснити з водного розчину сполуки будь-який з металічних елементів, що стоїть праворуч від нього, і може бути витіснений будь-яким з металів, що стоять ліворуч;
-усі метали, що стоять ліворуч від водню, можуть витісняти Гідроген з кислот, а ті, що стоять праворуч, - не можуть;
-чим лівіше стоїть у ряду метал, тим він сильніший відновник і тим важче відновити його.
