
- •1.2 Загальна характеристика автомобільного транспорту.
- •Основні вузли автомобілів.
- •1.4.Характеристика основних деталей, які найбільш інтенсивно зношуються.
- •Тема 2. Несправності деталей машин та механізмів
- •5.1. Вплив мікро - та макроструктури матеріалу деталей на їхні фізико-механічні та експлуатаційні властивості
- •Тема 4. Методи усунення дефектів
- •Режим вібродугового наплавлення стальних деталей.
- •Режими вібродугового наплавлення чавунних деталей.
- •Режими вібродугового наплавлення в середовищі вуглекислого газу.
- •11.1Суть процесу та способи напилювання.
- •Нпо «Тулачермет»
- •11.6 Основні елементи та параметри газотермічного напилювання покриттів.
- •12.2Розрахунки часу необхідного для напилювання та наплавлення покрить.
- •12.4 Охорона праці та навколишнього середовища при напилені.
- •Тема 4. Електролізний метод нанесення покрить.
- •Тема 6.Контроль параметрів процесу та якості покрить
- •Тема 1. Характеристика основних вузлів та деталей автомобілів,
- •Тема 2. Несправності деталей машин та механізмів......................16
- •Тема 3. Технологічна підготовка виробництва до відновлення
- •Тема 4. Методи усунення дефектів...................................68
- •Тема 5. Електролізний метод нанесення покрить......................... 96
- •Тема 6.Контроль параметрів процесу та якості покрить..........145
- •Укладачі: Анатолій Степанович
12.4 Охорона праці та навколишнього середовища при напилені.
До роботи на установках для плазмового й електродугового напилювання допускаються люди яким виповнилось не менш як 18 років, навчені прийомам роботи на устаткуванні 2-й і 3-й груп електробезпечності.
При плазмовому напилюванні найбільш шкідливими для здоров'я працюючих є шум, забруднення повітря, ультрафіолетові й інфрачервоні випромінювання. Шум плазмового струменя в безпосередній близькості від плазмотрона досягає 115...120 Дб. Для захисту оператора від шуму рекомендується покриття наносити в спеціальних камерах.
При плазмовому напилюванні повітря приміщення може забруднюватися металевим пилом, аерозолями оброблюваних матеріалів і окислами азоту. Для захисту оператора в цьому випадку також служать спеціальні камери з місцевою відкачкою повітря.
Плазмовий струмінь є інтенсивним джерелом інфрачервоного й ультрафіолетового випромінювання, тому оператор повинний працювати в захисній масці зі світлофільтром. Металізаційні камери також обладнають відповідними світлофільтрами. Руки від випромінювання захищаються рукавицями з азбестової тканини.
Вимоги до техніки безпеки при газоплазмовим і електродуговому напилюванні пред'являються також, що і при виконанні робіт з газового й електродугового зварювання.
Запитання до теми „Методи усунення дефектів”
В яких випадках руйнування деталей автомобілів для їхнього
відновлення використовують зварювання?
Які методи наплавлення використовують для відновлення
спрацьованих деталей?
Які існують види газополуменевого напилювання покрить?
Які механічні показники є визначальними при виборі методу та матеріалу при нанесені покрить?
Тема 4. Електролізний метод нанесення покрить.
Лекція 13. ЕЛЕКТРОЛІЗ
13.1. Електроліз у розчинах і розплавах.
Електроліз - сукупність процесів минаючих при проходженні електричного струму через розплав чи розчин електроліту.
При проходженні струму через розплав, наприклад, MgCl2 катіони магнію Mg2+ під дією електричного струму рухаються до негативного електрода. Тут вони взаємодіють з минаючими по зовнішньому ланцюзі електродами - відновлюються.
Mg2+ + 2ē=Mg
Аніони хлору рухаються до позитивного електрода і віддаючи надлишкові електроди, окислюються.
2Cl- = 2Cl + 2ē потім 2Cl → Cl2
Сумарне рівняння буде виглядати
Mg2+ + 2Cl- = Mg + Cl2
Ця реакція не може протікати довільно: енергія для її здійснення надходить від зовнішнього джерела струму. Як і в ХДЕЕ електрод на який відбувається відновлення називається катодом, а електрод на який відбувається окислювання - анодом.
Знаки в катода й анода зворотні тим, що були в ХДЕЕ. При електролізі хімічна реакція здійснюється за рахунок енергії електричного струму,
що пiдводиться ззовні, у той час як при роботі гальванічного елемента енергія хімічної реакції, що відбувається в ньому перетворюється в електричну енергію.
При електролізі розчинів потрібно пам'ятати, що крім іонів електроліту, у кожному водяному розчині маються ще іони води, що розпалася H+ і OH-. У такий спосіб на катоді можуть розряджатися як катіони електроліту так і катіони водню. Аналогічно на аноді може йти як розряд аніонів електроліту, так і іонів гідроксилу.
Розглядаючи катодні процеси потрібно враховувати величину потенціалу процесу відновлення іонів водню. Цей потенціал у випадку нейтральних розчинів (pH=7) дорівнює φ = -0,059 · 7= -0,41В. Якщо електроліт утворений металом, електродний потенціал якого значно позитивнiше -0,41В, то в катоді буде виділятись метал. Такі метали в ряді напруг знаходяться поблизу водню (починаючи з олова і після нього).
Навпаки у випадку електролітів, метал яких має потенціал значно більш негативний чим
-0,41В, метал відновлюватися не буде, а відбудеться виділення водню. До таких металів відносяться метали початку ряду напруг - приблизно до титана включно. Нарешті якщо потенціал металу близький до величини -0,41В (це метали середньої частини ряду - Zn, Cr, Fe, Ca, Nі, Co) то в залежності від концентрацій розчину, можливо як відновлення металу так і виділення водню: нерідко йде спільне виділення металу і водню.
Електрохімічне виділення водню з кислих розчинів відбувається внаслідок розряду іонів водню. У випадку нейтральних чи лужних середовищ воно є результатом електрохімічного відновлення води.
![]()
При розгляді анодних процесів варто мати на увазi, що матеріал анода в ході електролізу може окислятися. У зв'язку з цим розрізняють електроліз з інертним анодом і електроліз з активним анодом. Інертним називається анод, що не перетерплює змін у процесі електролізу. Активним називається анод, матеріал якого може окислятися в ході електролізу. Як матеріали для інертних анодів найчастіше використовують: графіт, вугілля, платину. На інертному аноді, при електролізі водяних розчинів лугів, кисневмісних кислот, а також HF і фторидiв відбувається електрохімічне окислювання води з виділенням кисню. У залежності від pH розчину цей процес протікає по-різному і може бути записаний різними рівняннями. У лужному середовищі вони мають вигляд:
4OH- = 2H2O + O2 + 4ē
а у кислому та нейтральному середовищі:
2H2O = O2 + 4H+ + 4ē
Киснемiсткi аніони чи не здатні окислятися чи їхнє окислювання відбувається при дуже високих потенціалах. При електролізі розчинів галогенних кислот (крім HF) HІ, HBr, HCl та їхніх солей в анода виділяється відповідний галоген:
![]()
У випадку активного анода можливо: електрохімічне окислювання води з виділенням O2, розряд аніона (тобто окислювання) і електрохімічне окислювання матеріалу анода. З цих трьох буде йти той, котрий хімічно найбільш вигідний.
Якщо метал анода розташований у ряді стандартних напруг раніше обох інших електрохімічних систем, то буде спостерігатися анодне розчинення. У противному випадку буде йти виділення кисню чи розряд аніона.
13.2. Електроліз розчинів при інертному й активному анодах.
Розглянемо електроліз розчину CuCl з інертним анодом
катод анод
Cu![]() + 2ē = Cu
+ 2ē = Cu
![]()
2Cl = Cl
Електроліз розчину NiSO4 з нікелевим анодом.
Стандартний потенціал розчину Nі (-0,250В) трохи більше чим -0,41В, тому при електролізі нейтрального розчину NіSO4 на катоді в основному відбувається розряд іонів Nі2+ і виділення металу. На аноді відбувається зворотний процес - окислювання металу, тому що потенціал Nі набагато менше потенціалу окислювання води
[(2H
O
= O
+ 4H
+
2ē) φ![]() = 1,228В], а тим більше потенціалу окислювання
іона SO
= 1,228В], а тим більше потенціалу окислювання
іона SO![]()
![]()
[(![]() =
=![]() +
2ē) φ
= 2,01В]. Тому в даному випадку електроліз
зводиться до розчинення металу на
аноді і на виділенню його на катоді
+
2ē) φ
= 2,01В]. Тому в даному випадку електроліз
зводиться до розчинення металу на
аноді і на виділенню його на катоді
катод NiSO4 анод
 Ni
+ 2ē = Ni Ni +
Ni
+ 2ē = Ni Ni +
![]() =
Ni
+
+ 2ē
=
Ni
+
+ 2ē
Лекція 14. Закони електролізу Фарадея. Поляризація
14.1. Закони Електролізу.
Вивчаючи електроліз англійський фізик Фарадей установив наступні закономірності:
Маса утвореної при електролізі речовини пропорційна кількості електрики, що пройшла через розчин . m= KІt, де К – електрохімічний еквівалент
- + - + - + - +
HCl AgNO3 CuCl2 SnCl4
- +



















Рис. 14.1
![]()
2. При проходженні однакової кількості електрики через розчини різних електролітів, кількість кожного з речовин, що виділилися, пропорційні їхнім хімічним еквівалентам.
H Ag Cu Sn
Маса металу, 1 107,9 31,8 29,7
що видiлилась на катодi, г
Атомна вага металу 1 107,87 63,51 118,69
Водню, що виділився 1 – грам-атом, Ag – 1грам-атом, Cu – ½ грам-атома, Sn – ¼ грам-атома.
До того ж результату приводить і маса речовини, що видiлилась на аноді. т.е. кількість виділюваної речовини пропорційно хімічному еквіваленту, що дорівнює A/n, де А- атомна вага, а n - валентність.
При цьому для виділення 1 грам-еквівалента речовини потрібно затратити заряд рівний 96500 (96487) Кл. Це число називається числом Фарадея і позначається F.
Електролізом розплавів солей одержують метали, що мають сильно негативні електродні потенціали. Унаслідок відсутності води, процеси при електролізі розплавів протікають простіше чим у розчинах. Електролітом служать суміші солей підібрані так, щоб система була легкоплавкою.
Цим методом одержують алюміній, магній, натрій, літій, берилій і кальцій. Цей метод можна також застосувати для одержання цирконію і титана. Електролізом водяних розчинів руд одержують Zn, Cd і Co, а також переробляють бідні марганцеві і хромові руди. Електричному рафінуванню піддають Cu, Nі, Pb, Sn, Ag, Au.
14.2. Електрохімічна поляризація. Перенапруга.
Коли електрод знаходиться при потенціалі, рівному рівноважному, на ньому встановлюється електрохімічна рівновага Red Ox + 2ē
Якщо прийняти, що за межами прикатодного шару концентрація зберігається постійної і дорівнює С , а в самому шарі міняється лінійно і дорівнює С, то щільність струму на катоді Jk дорівнює:
![]() А/см2
А/см2
де
Jk – щільність струму на катоді
![]() ,
А/см2
,
А/см2
δ – товщина прикатодного (дифузійного шару) см;
Z – валентність іонів, що розряджаються;
F – число Фарадея (Кл);
D
– коефіцієнт дифузії -
![]() ;
;
При збільшенні щільності струму зменшується концентрація іонів С бiля поверхні катода. У межі, при дуже великій щільності струму концентрація С→0.
Тоді гранична щільність струму при який С=0 буде дорівнювати:
![]() А/см2
А/см2
Зміна потенціалу електрода ∆φ, викликане протіканням струму при дифузійному утрудненні, має вид:
![]() ,
В
,
В
З формули видно, що при малiй щільності струму Jk , близькiй до нуля, величина поляризації також дорівнює нулю. При зростанні щільності струму потенціал катода зрушується в область більш негативних значень. Коли Jk наближається до Jпр то поляризація нескінченно зростає. У дійсності поляризація не буде необмеженої тому що стають можливими інші електрохімічні процеси (розряд інших іонів), що затримує подальшу зміну потенціалу.
При підвищенні температури зростає коефіцієнт дифузії, відповідно зменшується поляризація. При перемішуванні електроліту, конвекції в рідині, а також рух пухирців газу, що утворюються у електродів збільшується гранична щільність струму Jпр, а значить знижується величина поляризації катода.
При зсуві потенціалу електрода в позитивну чи негативну сторону на ньому починають протікати процеси окислювання чи відновлення.
Відхилення потенціалу електрода від його рівноважного значення називається електрохімічною поляризацією чи просто поляризацією.
Розглянемо приклад. Нехай мідний електрод знаходиться в 0,1m розчині CuSo4 не утримуючих ніяких домішок, у тому числі і розчиненому кисні. Поки ланцюг незамкнутий, потенціал електрода буде мати рівноважне значення рівне
φ = 0,337 + 0,03Lg10-1 ≈ 0,31В,
а на границі металу з розчином установиться електрохімічна рівновага
Cu Cu2+ + 2ē.
Підключимо тепер цей електрод до джерела струму зробивши його катодом. Надлишок електронів, що з'являються тепер на електроді, зрушать потенціал електрода в негативну сторону і рівновага порушиться. Електрони будуть притягати катіони міді з розчину - піде процес відновлення
Cu2+ + 2ē = Cu.
Якщо підключити електрод не до негативного, а до позитивного полюса джерела струму - зробити його анодом, то унаслідок видалення частини електронів потенціал електрода зміститься в позитивну сторону і рівновага також порушиться. Але тепер на електроді буде протікати процес окислювання, так як в ході цього процесу звільняються електрони - це анодна поляризація
Cu = Cu2+ + 2ē
Поляризація електрода - необхідна умова протікання електродного процесу. Від її величини залежить швидкість електродного процесу: чим сильніше поляризований електрод, тим з більшою швидкістю протікає на ньому відповідна напівреакція.
Крім величини поляризації на швидкість електродних процесів дуже впливає каталітичний вплив електрода. Так якщо катод виготовлений із платини, то для виділення водню, із заданою швидкістю, необхідна визначена величина катодної поляризації. При заміні платини на срібло (за інших рівних умов) знадобиться велика поляризація, а при заміні Ag на Pb поляризація знадобиться ще більше.
Отже різні метали володіють різною каталітичною активністю стосовно процесу відновлення іонів водню.
Величина поляризації, необхідна для протікання даного електродного процесу з визначеною швидкістю, називається перенапругою даного електродного процесу. У такий спосіб перенапруга виділення водню на різних металах по-різному. Приведемо величини перенапруги для 1н розчину величини катодної поляризації, яку необхідно здійснити на електроді для виділення на ньому водню зі швидкістю 0,1 мл/хв із 1см2 робочої поверхні електрода
Таблиця 14.1
Метал електроду |
Електроліт |
Перенапруга В |
Метал електроду |
Електроліт |
Перенапруга В |
залізо |
HCl |
0,5 |
цинк |
H |
1,0 |
мідь |
H SO |
0,6 |
ртуть |
H SO |
1,2 |
срібло |
HCl |
0,7 |
свинець |
H SO |
1,3 |
14.3. Вихід по струму.
За законом Фарадея випливає, що якщо через електроліт пропустити 96500Кл електрики, то виділиться 1 грам-еквівалент речовини.
Однак у практиці часто мають місце випадки, коли кількість речовини, що виділилася на катоді (металу), менше розрахованого за законом Фарадея.
Наприклад, якщо пропустити через розчин хромової кислоти (H2CrО4), то на катоді повинний виділитися 1 грам-еквівалент хрому
![]()
а виділяється в дійсності приблизно в 10 разів менше. Пояснення полягає в тім, що крім основного процесу, на катоді має місце побічний процес - виділення водню. Якщо підрахувати кількість електрики, витраченої на осадження Cr і виділення H , то одержимо нове підтвердження закону Фарадея.
Метал, що осаджується |
Атомна вага |
Валентність |
Електрохімічний еквівалент в г/А-год |
Вихід по струму в % |
Щільність г/см3 |
Мідь (з кислого електроліту) |
63,54 |
2 |
1,186 |
98 -100 |
8,96 |
Мідь (з ціаністого електроліту) |
63,54 |
1 |
2,372 |
50 - 80 |
8,96 |
Нікель |
58,69 |
2 |
1,095 |
95 - 98 |
8,9 |
Хром |
52,01 |
6 |
0,324 |
10 - 14 |
7,19 |
Цинк |
65,38 |
2 |
1,220 |
90 - 98 |
7,14 |
Олово (з кислого електроліту) |
118,7 |
2 |
2,214 |
95 - 98 |
7,3 |
Олово ( з лужного електроліту) |
118,7 |
4 |
1,107 |
70 - 85 |
7,3 |
Свинець |
207,21 |
2 |
3,865 |
98 - 99 |
11,34 |
Срібло |
107,88 |
1 |
4,025 |
95 - 99 |
10,5 |
Золото |
197,2 |
1 |
7,357 |
65 - 75 |
19,32 |
Відношення маси речовини, що виділилася практично, до теоретично обчисленого за законом Фарадея називається виходом по струму.
У випадку хрому вихід по струму в % буде
![]()
З огляду на вихід по струму закони Фарадея можна записати у виді об'єднаного рівняння
![]() де
I – сила струму, t – час в годинах, к –
електрохімічний еквівалент, η – вихід
по струму.
де
I – сила струму, t – час в годинах, к –
електрохімічний еквівалент, η – вихід
по струму.
Лекція 15. Основні розрахунки, застосовувані в
гальванотехніці.
15.1. Визначення виходу по струму.
При технологічних розрахунках зручніше користатися не числом Фарадея, а ампер-годинами. Відомо, що кількість електрики ∆Q=І∆t. У нашому випадку ∆Q=F значить F=І∆t. Враховуючи те, що F=96500А·с, а в 1 годині 3600с одержимо, що
F=28,8 A*год
тоді
![]() г/А*год
г/А*год
Приклад 1. Електроліз у нікелевій ванні тривав 30 хвилин при І=300A. Осіло на катоді 102г нікелю. Визначити катодний вихід по струму:
![]() звідси
звідси
![]()
Підставляючи наші дані одержимо:
![]()
Приклад
2. Визначити яка кількість електрики, у
Кл, витрачено при осадженні цинку, якщо
маса осаду m=13,07г, К![]() =1,22
г/А*год
=1,22
г/А*год![]() ,
а η=90
,
а η=90
Q=It
![]()
![]()
Що в кулонах буде Q=11,9 · 3600=42890Кл.
15.2. Визначення середньої товщини покриття.
 При
розрахунках товщини покриття, необхідно
пам'ятати, що рівномірного покриття при
осадженні на плоскі і рельєфні поверхні
не виходить. Розглянемо плоскі електроди.
Як видно, силові лінії електричного
поля у країв розташовуються густіше
чим у центра. Сила струму буде в країв
теж більше, а виходить, більше буде і
товщина покриття. Тому при визначенні
товщини можна говорити тільки про її
середнє значення. У розрахунках також
вводиться щільність струму
При
розрахунках товщини покриття, необхідно
пам'ятати, що рівномірного покриття при
осадженні на плоскі і рельєфні поверхні
не виходить. Розглянемо плоскі електроди.
Як видно, силові лінії електричного
поля у країв розташовуються густіше
чим у центра. Сила струму буде в країв
теж більше, а виходить, більше буде і
товщина покриття. Тому при визначенні
товщини можна говорити тільки про її
середнє значення. У розрахунках також
вводиться щільність струму
![]() .
Найчастіше силу струму вимірюють в А,
а площа в дм2 чи см2.
.
Найчастіше силу струму вимірюють в А,
а площа в дм2 чи см2.
Природно, що щільність струму теж у країв буде більше чим у середині пластини, тому в розрахунках фігурує середнє значення щільності струму.
Приклад
3. Визначити товщину Zn покриття, осадженого
з ціаністої ванни за 3 хв,
![]() щільность
струму J = 1,5 А/дм2, вихід по струму 90%.
К
=1,22
г/А*год
Визначимо масу Zn, що осів на 1см
площі катода, , J=1,5 A/дм2 = 0,015 А/см2, тоді
щільность
струму J = 1,5 А/дм2, вихід по струму 90%.
К
=1,22
г/А*год
Визначимо масу Zn, що осів на 1см
площі катода, , J=1,5 A/дм2 = 0,015 А/см2, тоді
![]()
m = ρ·V = ρ·S·δ; де δ – товщина покриття.
![]()
звідси

Таким чином товщина покриття δ = 11мкм.
Приклад
4. Через розчин NіSO4 пропускають струм
протягом 12 хв. Визначити величину струму,
його щільність і товщину покриття якщо
за цей час через розчин проходить 36000
Кл електрики, а активна площа катода
S=10дм2,
![]() г/см3,
η = 95%, K=1,095 г/А·год.
г/см3,
η = 95%, K=1,095 г/А·год.
Визначимо скільки ампер-годин складає 36000Кл.
Так
як 1Кл = 1А·с,
![]() ,
то
,
то
![]()
Враховуючи, що 12хв = 0,2 год знаходимо силу струму
![]() Звідси
Звідси
![]()
Товщина покриття може бути визначена:
m
= S·δ·ρ,
![]() ;
;
![]() ;
;

Визначення тривалості процесу.
Приклад
5. Визначити час, необхідний для одержання
мідного покриття, з кислої ванни, товщиною
15мкм, при щільності струму J=2A/дм2 з
виходом по струму 98%.
![]() г/см3,
г/см3,
![]() .
.
По
закону Фарадея
![]()
Визначимо масу міді, що виділилася на 1см2 площі:
m
= S·ρ·δ,
![]() .
.
Підставляючи це значення в формулу Фарадея одержимо:
![]() =
=
![]() звідки знаходимо t.
звідки знаходимо t.
Лекція 16. Структура гальванічних покрить
16.1. Будова гальванічних покрить.
Під структурою гальванічних покрить розуміють розмір і форму кристалів з яких складається металеве покриття, і їхнє розташування стосовно поверхні катода.
Гальванічне осадження металів можна розглядати як кристалізацію, що складається з 2-х процесів утворення окремих кристалів і їхнього росту.
У залежності від співвідношення швидкостей кожного з цих процесів виходить та чи інша структура опади.
У тому випадку, коли в початковий момент електролізу, утвориться велике число нових, повільно зростаючих кристалів, метал виділяється у виді дрібнокристалічного осаду. Якщо ж утвориться невелике число кристалів, що швидко ростуть, то метал виходить великокристалічним.
Розміри кристалів неоднакові по товщині шару. Спершу на поверхні катода виділяються дуже дрібні кристали, частина з них, знаходячись у менш сприятливих умовах, припиняє свій ріст, а інша частина продовжує рости. Найбільш сильний вплив на структуру гальванічного осаду робить природа електроліту.
По гіпотезі Ханта, кристалічна структура осаду залежить від концентрації іонів обложеного металу в катодному шарі і концентрації інших складових частин електроліту в цьому ж шарі.
Якщо кількість іонів металу щодо інших частин, що знаходяться в електроліті, порівняно великою, то ріст кристалів не буде зустрічати утруднень і осад буде мати грубокристалічну форму.
Якщо ж унаслідок малого ступеня дисоціації, комплексоутворення, високого ступеня гідратації, присутність колоїдних часток і т.д. концентрація іонів металу в катодному шарі щодо інших складових частин електроліту мала, то ріст кристалів буде утруднений, і швидкість утворення центрів кристалізації буде більше.
Інакше кажучи, всяке утруднення надходження в катодний шар нових іонів металу приведе до утворення дрібнокристалічних опадів.
Механізм кристалізації Хант пояснює так: іон металу, досягаючи катодної поверхні, прагне якомога швидше впровадиться в кристалічну гратку і для цього він повинен звільниться від іонної атмосфери і від оболонки гідратної води. Чим швидше буде рости шар металу і відбуватися осадження поверх даного іона, тим менше шансів цим стороннім тілам знову повернутися в розчин.
Опади Zn, Cu, Cd, Tl, Pb, Sn з розчинів простих солей, наприклад сірчанокислих, виходять, як правило, крупнокристаличними. Так, наприклад, Pb з азотнокислих розчинів осаджується у виді голкоподібних кристалів.
Ця структура абсолютно непридатна для практичних цілей. Краща структура виходить з оцетнокислих розчинів, із кремнієфтористоводневих і ціаністих. Так осадження цинку і міді з розчинів ціанідів дають дуже дрібну кристалічну структуру. Пояснюється це тим, що в розчинах простих солей дисоціація йде в одну стадію з утворенням простих іонів, а в другому випадку дисоціація йде в двох стадіях. В першій стадії утвориться складний комплексний аніон і тільки в другій стадії - іони металу, що осаджується. Крім того, кристали, отримані із сірчанокислого електроліту, розташовуються перпендикулярно площини катода, а з ціаністого електроліту, ростуть безладно, хаотично.
K[Au(CN)2]; K2[Ni(CN)4]; K[Ag(CN)2]; AgCN
Наприклад:
1. Осадження Zn з ZnSO4:
![]()
![]()
2. Осадження Zn из CN растворів: [соль Na2[Zn(CN)4]]
![]()
![]() а
потім
а
потім
![]()
![]()
Тому що комплексний ціаністий аніон дисоціює дуже слабко, то концентрація простих іонів дуже низька. У цих умовах виходять покриття зі значно меншою величиною окремих кристалів, чим у кислих ваннах.
16.2. Вплив катодної поляризації на структуру осаду.
Встановлено, що розряд іонів металу на катоді при більш негативному потенціалі приводить до утворення осадів більш тонкої структури. Ріст зародків, що утворилися, вимагає меншого відхилення від рівноважних умов, тобто протікає при менш негативному потенціалі.
На
малюнку зображена крива катодного
відновлення Cd з 1н розчину CuSO4 на
платиновому катоді. Неполяризований
платиновий електрод має більш позитивний
потенціал (![]() )
чим це відповідає рівноважному потенціалу
кадмію (
)
чим це відповідає рівноважному потенціалу
кадмію (![]() ).
При включенні струму, що поляризує,
потенціал платинового електрода різко
зміщається убік негативних значень,
потім він стає більш позитивнішім, і
встановлюється на величині, що відповідає
процесу електролізу φ.
).
При включенні струму, що поляризує,
потенціал платинового електрода різко
зміщається убік негативних значень,
потім він стає більш позитивнішім, і
встановлюється на величині, що відповідає
процесу електролізу φ.
 Спостерігаючи
поверхню катода в мікроскоп, можна в
крапці mіn помітити появу першого зародка.
Подальший ріст його відбувається при
потенціалі φ. Відхилення від рівноважного
значення Cd відповідає величині ∆φ1. В
умовах протікання процесу електролізу
поляризація виражається величиною
∆φ2.
Спостерігаючи
поверхню катода в мікроскоп, можна в
крапці mіn помітити появу першого зародка.
Подальший ріст його відбувається при
потенціалі φ. Відхилення від рівноважного
значення Cd відповідає величині ∆φ1. В
умовах протікання процесу електролізу
поляризація виражається величиною
∆φ2.
Оскільки відновлення Cd із сірчанокислого розчину протікає без великої перенапруги, то ∆φ2 незначна, і обумовлена головним чином концентраційними змінами біля поверхні електрода .
Гальмування процесу можна здійснити додаванням в електроліт поверхнево-активних речовин, що здатні пасивувати катод. У такому напрямку діють: декстрин, желатина, клей, фенол і ряд інших речовин. Наприклад, якщо до електроліту, що містить 250г/л мідного купоросу і 30г/л сірчаною кислоти додати 0,01г/л желатини, то структура осаду стає настільки тонкою, що окремі зерна міді в осаді майже нерозрізнені під мікроскопом.
Подібна дія на структуру гальванопокриттів роблять гідрати окислів деяких металів, що утворяться в прикатодному шарі.
Утворення гідратів окислів металів відбувається звичайно в слабокислих чи нейтральних середовищах в умовах спільного виділення металу і водню, коли відбувається підлужування прикатодного шару електроліту (нагромадження іонів OH-). Гідрати окислів осаджуються разом з металом, утворити дрібнокристалічний осад.
При підвищенні змісту гідратів окислів металу якість осаду погіршується: він стає тендітним, темним по кольору, грубошерсткуватим.
Зі збільшенням кислотності розчину гідратоутворення знижується. Особливо помітний вплив робить на структуру покрить концентрація водневих іонів у таких металів як залізо, нікель і кобальт. Водень може поглинатися виділеним металом. В опадах Cr міститься близько 0,45% вагової водню, у Fe, Nі, Co - до 0,1%, у Zn - 0,01-0,001%, а в інших металах ще менше.
Незважаючи на малий зміст водню в металах, в опадах виникають великі внутрішні напруження, що є причиною його відшаровування від основи, утворення міхурів і підвищеної крихкості.
Лекція 17. Вплив режимів електролізу на структуру покрить.
17.1. Компоненти електролізу, що не беруть участь у розряді.
У рідких випадках електроліти складаються тільки з солі чи іншого з'єднання, іони яких розряджаються на катоді з утворенням відповідного покриття. Часто в електроліти вводять солі лужних чи лужноземельних металів з метою підвищення електропровідності, що дозволяє, при більш низькій напрузі на клемах ванни підтримувати підвищену щільність струму. У мідному сірчанокислому електроліті цю роль виконує сірчана кислота, а в станiтних електролітах - луги. Для стабілізації pH розчинів (попередження різких коливань) в електроліти вводять слабкі кислоти - борну (H2BO3), оцтову (CH3COOH), лимонну ((CO2H)42CH2 · C(OH)).
Крім того в розчин, як уже говорилося, уводяться поверхнево-активні речовини.
17.2. Вплив режимів електролізу на структуру осаду.
Режим електролізу (щільність струму, температура, перемішування) дуже впливає на процес кристалізації. Кількість кристалів, що утворяться, при проходженні постійної кількості електрики на катоді тим більше, чим менше концентрація електроліту, вище щільність струму, нижче температура і менше інтенсивність перемішування.
Підвищення щільності струму приводить до зменшення величини кристалів в осаді. Однак у деяких випадках подібна закономірність спостерігається лише з визначеної щільності струму: спочатку відбувається укрупнення кристалів і лише починаючи з визначеною щільністю струму, величина їх зменшується.
Підвищувати щільність струму можна тільки до визначеної межі, після якої починається порушення процесу. Унаслідок сильного збідніння прикатодного шару іонами металу спостерігається відкладення металу на деяких виступаючих ділянках катода, де утворяться т.зв. дендрити. При подальшому підвищенні щільності струму, катод покривається губчатою порошкоподібною масою, що складається з дрібних окремих кристалів чи їхніх зростків, неміцно зв'язаних між собою й основою.
При осадженні Nі, Co, Fe підвищення щільності струму сприятливо впливає на структуру осаду, але з ростом щільності струму росте і кількість виділюваного водню, тому потрібно постійно підтримувати необхідне pH.
Вплив температури на структуру осаду протилежно впливу щільності струму. З підвищенням температури осаду стають більш крупнокристалічні. Такий вплив температури зв'язаний зі збільшенням швидкості дифузії іонів до катода.
У тому ж напрямку, що і підвищення температури діє перемішування електроліту. Воно так само ідентично підвищенню концентрації солі металу, що осаджується, оскільки при цьому швидше заповнюється недолік іонів металу, що розрядилися на катоді. Але з іншої сторони підвищення температури електроліту і перемішування дозволяє одержувати велику щільність струму. У деяких випадках при інтенсивному перемішуванні в метал, що осаджується, попадають часточки шлаку. Тому перемішування часто сполучено з одночасним фільтруванням електроліту.
17.3. Вплив структури основного металу на структуру осаду.
При відповідній підготовці поверхні основного металу його структура відтворюється в шарі, що осаджується, тобто спостерігається спрямована кристалізація - епітаксія. Так мікроструктура відкладеної міді по міді підданій глибокому травленню, відтворює структуру основи, представляючи собою як би її продовження. Якщо ж основний метал піддадуть тільки знежиренню в лужному розчині без травлення, то електроосаджена мідь має волокнисту чи стовпчасту будівлю, характерну для структури електролітної міді.
Таке розходження в структурі осаду можна пояснити тим, що на поверхні металу очищеного лише лугом, може залишитися плівка водню, кисню, чи окису іншої сторонньої речовини. Дія такої плівки хоч і недостатньо для того, щоб перешкодити зчепленню електроосадженого металу однак вона не допускає тісного атомного зіткнення, необхідного для відтворення осадом чи структури продовження росту кристалів основного металу.
При знежиренні і травленні продовження структури основного металу в виділеному шарі спостерігається навіть у тому випадку коли вони відносяться до різних кристалографічних систем.
Продовження росту кристалів основного металу легше здійснюється на крупнокристалічному осаді, хоча й у випадку мілкокристаличної структури такий ефект має місце. Особливо підсилює ефект не просте, а елктрополірування.
Так електроосаджений нікель і хром, по електрополірованій латуні, у шарах порядку 1мкм, мають яскраво виражену структуру латуні. Лише при збільшенні товщини покрить до 10мкм вплив структури основного металу перестає позначатися.
Усе це свідчить про важливість попередньої обробки. Останньою операцією перед зануренням виробів у гальванічні ванни повинне бути легке травлення (декапірування) з наступним промиванням водою.
17.4. Спільний розряд іонів водню і металу на катоді.
При електролізі водяних розчинів можливе виділення на катоді водню, що не тільки позначається на швидкості перебігу процесу, але і викликає водневу крихкість осаду, обумовлює утворення губчатих чи порошкоподібних опадів, пітингу й інших дефектів. Якщо потенціал металу, наприклад, міді в сірчанокислих електролітах значно позитивніше потенціалу виділення водню, то він не виділяється навіть при значній концентрації кислоти.
Такі метали як Zn, Pb, Sn, що мають велику перенапругу, виділяються із сірчанокислих електролітів на катоді з виходом по струму, близьким до теоретичного. У той же час метали групи заліза, на яких перенапруга водню порівняно невелика, дуже чуттєві до концентрації іонів водню.
Іони водню беруть участь у переносі струму і впливають на зміну в приелектроній зоні. Якщо кількість іонів водню, дифузюючих з об’єму і переносимі струмом в одиницю часу, менше кількості іонів водню, що розряджаються, то pH прикатодного шару буде зростати в порівнянні з його значенням в обсязі електроліту, при зворотному співвідношенні швидкостей переносу і розряду буде спостерігатися зниження pH. Зміна pH прикатодного шару спричиняє процес дифузії, що прагне зрівняти активність іонів водню в об’єму розчину і прикатодному шарі. Ця різниця в pH прикатодного шару й об’єму зі збільшенням щільності струму буде зростати. У розчинах кислот підлужування може йти тільки до pH =7.
У розчинах лугів підлужування прикатодного шару нічим не обмежено.
У випадку ж утворення важко розчинних з'єднань ( гідратів чи основних солей) граничне значення pH прикатодного шару буде відповідати pH цих з'єднань.
Вимір pH прикатодного шару можна здійснювати: відбором проб електроліту з прикатодного шару методом індикаторів, методом метал-водневого електрода, скляним мікроелектродом.
Підвищення температури, перемішування і висока концентрація іонів основного металу перешкоджають підлужуванню розчину в прикатодному шарі. Як уже говорилося, частина водню впроваджується в осад. Фактори, що впливають на величину водню, що впроваджується, такі:
1) Збільшення щільності струму зменшує кількість H2 в осаді.
2) Чим більше pH, тим менше водню поглинається осадом.
3) З підвищенням температури зменшується зміст водню в осаді.
4) Перемішування електроліту сприяє зменшенню змісту водню в осаді.
5) Розчинність у металі водню залежить від природи металу.
6) Для того самого металу кількість поглиненого водню залежить від аніона, з яким зв'язаний іон металу, що осаджується.
Ці положення варто доповнити властивостями матеріалу катода і величиною водневої перенапруги на ньому. Так, наприклад, свинець і олово навіть із сильно кислих електролітів практично виділяються з 100%-м виходом по струму унаслідок високої напруги водню на них (~1,3В). Зміст водню в опадах Fe, Cu, Nі, перенапруга яких всього 0,5-0,75В складає ~ 0,1%. Видалити його можна або нагріванням у вакуумних печах при t=500-600°C протягом 2-3 годин, або нагріванням в інертній атмосфері при 170-240°С в перебігу 24 годин.
Іноді водень затримується на поверхні катода у виді пухирців. У цих місцях розряд металу стає неможливим. Вони розряджаються навколо пухирців. Осад унаслідок цього стає ніздрявим, у ньому виявляються порожнечі, що іноді пронизують усю його товщу. Такий осад вважаються браком. Це явище називається "пітингом", воно найчастіше спостерігається при нікелюванні.
Здатність газових пухирців залежить від крайового кута змочування катодної поверхні водою.
Якщо метал добре змочується водою, то пухирець сидить на маленькій основі, периметр його зіткнення з поверхнею катода малий і він легко відривається (І).
Якщо крайовий кут великий, наприклад θ=75°, то периметр дотику його з поверхнею катода, а значить і сила утримуюча його F=δl більше, тому до моменту відриву він може вирости до великих розмірів.
При
досить великій катодній поляризації
кут змочування θ убуває, разом з ним
зменшується прилипання. При збільшенні
щільності заряду катода змочування
його водою з більшується,
і вода як би виштовхує пухирці з поверхні.
Найбільший θ виходить, коли заряд = 0.
Тому якщо процес йде при потенціалі
близьким до 0, то крайовий кут θ великий,
що відриваються пухирці досягають
великих розмірів.
більшується,
і вода як би виштовхує пухирці з поверхні.
Найбільший θ виходить, коли заряд = 0.
Тому якщо процес йде при потенціалі
близьким до 0, то крайовий кут θ великий,
що відриваються пухирці досягають
великих розмірів.
Додавання поверхневе активних речовин (ПАР) може як збільшити, так і зменшити крайовий кут. Для боротьби з пітингом часто використовують миючі засоби, наприклад, порошок "Прогрес".
Лекція 18. Розсіювання електроліту. Призначення гальвано-
покриттів.
18.1. Здатність електроліту розсіюватись.
Важливим фактором, що визначає якість гальванопокриттів, є рівномірність розподілу його по поверхні виробу. Розрахунок товщини покриття за законом Фарадея дає лише середнє значення товщини. Досвід показує, що навіть на плоских катодах, що знаходяться на однакових відстанях від анодів, щільність струму і товщина покриття розподіляються нерівномірно. На кутах і краях щільність струму значно більше розрахункової, а на середній частині катодів відповідно менше.

Зразковий
розподіл щіль-ності струму Jсер=22
а/дм2
Рис.
18.1
Схема
розподілу силових ліній на електродах
при різному положенні їх у електролізері
Рис.18.2
Ще в більшому ступені нерівномірність розподілу струму спостерігається при покритті профільованих виробів, у яких маються значні виступи і поглиблення. Так робити цинкування і кадміювання сильнопрофільованих виробів використовуючи кислі електроліти практично неможливо через складність одержання на них рівномірних покрить.

 На
різних ділянках профільованих виробів
буде різний опір між анодом і різними
катодними ділянками - ближніми і
далекими, а виходить, різною буде і
щільність струму на цих ділянках. На
ближній до анода ділянці катода осяде
більше металу, а на далекій менше. Разом
з тим практикою встановлено, що в ряді
випадків товщини металу, обмірювані на
різних ділянках складнопрофільованого
катода, рівновіддалених від анода, не
пропорційні відстаням.
На
різних ділянках профільованих виробів
буде різний опір між анодом і різними
катодними ділянками - ближніми і
далекими, а виходить, різною буде і
щільність струму на цих ділянках. На
ближній до анода ділянці катода осяде
більше металу, а на далекій менше. Разом
з тим практикою встановлено, що в ряді
випадків товщини металу, обмірювані на
різних ділянках складнопрофільованого
катода, рівновіддалених від анода, не
пропорційні відстаням.
Якщо взяти металеву кульку d=50мм і помістити її замість катода в золотий ціаністий електроліт на відстані 150мм від плоского катода, то в процесі електролізу, він весь покриється золотом, причому товщина покриття у віддалених і більш близьких до анода місцях кульки буде однаковою. Ця здатність електроліту вирівнювати товщину покриття в далеких і ближніх місцях катода називається розсіювальною здатністю електроліту .
На здатність розсіюватись впливають багато факторів: природа електроліту, температура і питомий електричний опір розчину, геометричні розміри і форма ванни й електродів. Всі електроліти, що мають у своєму складі комплексні солі (наприклад ціаністі), володіють гарною здатністю розсіюватись, а електроліти складені з простих солей (Cu, Zn, Nі - сірчанокислі) електроліти, мають більш низьку здатність розсіюватись.
На здатність розсіюватись впливає падіння потенціалу на границі електроліт-катодна поверхня. Унаслідок більшої поляризації на опуклих ділянках з підвищеною щільністю струму, у порівнянні з більш видаленими від анода заглибленими ділянками, де катодна поляризація менше, іонам металу стає сутужніше пробитися до опуклих ділянок катода і вони змушені переходити до увігнутого. Частина струму відволікається від опуклих ділянок і розподіляється на ділянках з меншою катодною поляризацією. Ступінь зміни початкового розподілу струму залежить від ступеня поляризації.Таким чином, при електролізі відбувається перерозподіл струму убік великої рівномірності, у порівнянні з тим розподілом, що відповідає відстані різних катодних ділянок від анода.
Рівномірність розподілу металу по поверхні катода залежить від характеру щільності струму, а значить і виходу по струму.
Ступінь перерозподілу струму і металу при електролізі убік більшої рівномірності називається розсіювальною здатністю електроліту .
Зовсім рівномірний розподіл струму на всіх ділянках поверхні, що покривається, можливий тільки у виняткових випадках, наприклад, на концентричному циліндрі, де електроди розміщаються один в одному чи на плоских довгих паралельних електродах.
На рівномірність розподілу металу впливають деякі добавки неорганічних з'єднань, наприклад, нейтральні солі лужних металів, а також колоiднi і поверхнево-активні речовини. Для більш рівномірного розподілу металу варто застосовувати тим меншу щільність струму, чим складніше форма виробів, що покриваються. Температура може позначатися по-різному і встановлювати її можна дослідним шляхом. Якщо домогтися гарної розсіюваності неможливо, тоді застосовують наступні прийоми:
1. Анодам додають форми виробів, що покриваються;
2. Збільшують відстань між анодом і виробом, що покривається;
3. Застосовують додаткові катоди для відволікання на них надлишкового струму;
4. Використовують непровідні екрани.
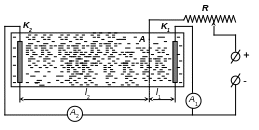 По
методу Херинга і Блюма здатність, що
розсіює, визначається відношенням
приросту ваги металу на двох катодах,
що знаходяться на різній відстані від
анода. Для цієї мети застосуються
По
методу Херинга і Блюма здатність, що
розсіює, визначається відношенням
приросту ваги металу на двох катодах,
що знаходяться на різній відстані від
анода. Для цієї мети застосуються
Рис.18.3
прямокутна ванна, в обох кінцях якої встановлюються нерухомі катоди, що включаються паралельно, а рухливий сітчастий анод розташовується між ними так, щоб відстань від нього до одного з катодів у 5 разів перевищувало відстань до іншого катода.
 Т-
здатність розсіюватись в %;
Т-
здатність розсіюватись в %;
![]() -
відношення відстані між електродами;
-
відношення відстані між електродами;
Мб – кількість металу, що виділився на ближньому катоді; Мд – кількість металу, що виділився на дальньому катоді;
18.2. Призначення гальванічних покрить та їхні види.
Вибір покрить, а також їхня товщина залежить від умов служби виробів. Їхня товщина регламентується ДСТами і приводиться в табл. 18.1
Таблиця 18.1
Призначення покриття |
Метал основи |
Метал покриття |
Товщина покриття, мкм |
1. Захист від атмосферної корозії |
сталь |
цинк |
3 - 35 |
2. Захист від морської води і від атмосфери насиченої морськими випарами |
-//- |
кадмій |
7 - 50 |
3. Захист від сірчаної кислоти, її солей і сірчистих з'єднань |
-//- |
свинець |
30 - 1000 |
4. Захист консервної тари і покриття під пайку |
-//- |
олово |
1,5 - 5,0 |
5. Захист від дії органічних кислот (кухонні і їдальні виробу) |
-//- |
олово |
10 - 25 |
6. Те ж |
-//- |
хром |
50 - 70 |
7. Захисно-декоративна обробка |
сталь, мідь та її сплави |
нікель |
5 - 25 |
8. Те ж |
те ж |
хром |
1 - 40 |
9. Те ж |
сталь |
Cu-Ni-Cr |
15 - 15 - сумарна товщина |
10. Те ж |
сталь |
Cu-Ni чи Ni-Cu-Ni |
15 - 45 - сумарна товщина |
11. Те ж |
сталь, мідь та її сплави |
нікель-хром |
6 - 12 - сумарна товщина |
12. Те ж |
мідь, латунь |
срібло |
5 - 20 |
13. Те ж |
те ж |
золото |
0,3 - 10 |
14. Покриття гартових стереотипів |
гартова сталь, чугун |
нікель |
10 - 100 |
15. Підвищення опору зносу |
те ж |
хром |
3 - 500 |
16. Відновлення зношених деталей і підвищення зносостійкості |
те ж |
залізо |
10 - 2000 |
17. Захист від насичення вуглецем при цементації |
сталь |
мідь |
20 - 40 |
18. Гальванопластика |
Cu, Al |
мідь |
250 - 2000 |
19. Поліпшення антифрикційних і оптичних властивостей |
сталь, мідь та її сплави |
індій |
0,3 - 3 |
20. Поліпшення антифрикційних властивостей і покриття під пайку |
-//- |
сплав олова і свинцю |
10 - 100 |
21. Поліпшення зчеплення гуми при гарячому пресуванні |
-//- |
латунь |
3 - 5 |
22. Зменшення поверхні електричного опору |
-//- |
срібло |
5 - 20 |
23. Підвищення відбивної здатності |
-//- |
Cu, Ni, Cr |
15 - 20 |
24. Те ж |
-//- |
срібло |
10 - 20 |
25. Підвищення зносостійкості і відбивної здатності |
-//- |
родій |
0,1 - 0,15 |
26. Захист від корозії точних приладів |
мідь та її сплави |
палладій |
2 - 6 |
27. Те ж |
-//- |
золото |
10 - 20 |
18.3Види покрить та їхнє позначення.
У залежності від способу одержання прийняті наступні умовні позначки покрить.
Ан - анодне оксидування;
Х iм - хімічний спосіб;
Гор - гарячий спосіб;
Диф - дифузійний спосіб;
Мет - металізаційний спосіб;
Кон - конденсаційний (вакуумний) спосіб;
Кт - контактний спосіб;
Кт - контактно-механічний спосіб;
Вж - впалювання;
Кр - катодне розпилення;
Эм - емалювання;
Пк - плакування;
Умовні позначки специфічних видів покрить.
тв - тверде
зн - зносостійке
шр – шорсткувате
еiз - електроізоляційне
е - електропровідне
сс - світлостійке
пор - пористе
мр - макропористе
мс - мікропористе
Умовні підвиди декоративних видів покрить.
а
б) по
ступені декоративної
шорс-
ткості
гл - гладкі
сш - злегка шорсткуваті
ш - шорсткуваті
вш - дуже шорсткуваті
зк- дзеркальне
б - блискуче
пб - напівблискуче
м - матове
Позначення матеріалів покрить.
А – Al Ko – Co Pд – Rh
Bи – Вi Mц – Mn С – Pb
В – Ж M – Cu Ср – Ag
Ж – Fe Mo – Mo Су – Sb
Зл – Au H – Ni X – Cr
Кд
– Cd O – Si Ц – ZnПд – Pd
18.4. Анодні і катодні покриття.
Механізм захисту сталі й інших сплавів заліза від корозії у різних покрить різний.
Як
приклад можна розглянути покриття
цинку на залізі, що наноситься як
антикорозійне. Якщо на якійсь ділянці
покриття буде ушкоджено, то при наявності
вологи в місці ушкодження утвориться
У цій гальванічній парі цинк буде розчинятися, а на залізі будуть розряджатися іони водню, при цьому залізо розчинятися не буде. Тому що в цій парі цинк грає роль анода, то такі покриття називаються анодними.
Іншим прикладом може служити покриття Sn на Fe. Так як потенціал заліза є більш електронегативний ніж потенціал олова, то у випадку утворення гальванічної пари Fe-Sn, залізо буде відігравати роль анода, а олово – катода. Залізо буде розчинятися, а на олові будуть розряджатися іони водню. У такий спосіб у випадку руйнування олов’яного покриття залізо буде ржавіти. Такі покриття, у яких захисний метал, у випадку виникнення гальванічної пари, грає роль катода, називаються катодними. У катодних покрить потенціал більш позитивний чим у металу, що захищається.
Однак розподіл на анодні і катодні покриття залежить від умов. Так в умовах атмосфери чи водяних розчинах неорганічних з’єднань олово стосовно заліза є катодним, а в присутності органічних сполук воно відіграє роль анодного покриття.
Більш надійними є анодні покриття (Zn і частково Cd), а у випадку катодних (Сu, Nі, Cr, Sn, Pb, Ag, Au) в атмосферних умовах плівка їхня повинна бути суцільною. Але навіть надійні Zn покриття, що широко застосовуються в середніх географічних широтах, виявляються нестійкими в тропічному кліматі. Причиною цього є інтенсивне розчинення і змивання водою і вологою повітря шару солей цинку, що утворяться на поверхні цинку при корозії. Відбувається оголення глибинних шарів металу, і швидкість корозії не сповільнюється.
Крім цього Zn втрачає свої захисні властивості при температурі води 70° - 80°С. Потенціал цинку при цих температурах значно зростає.
Лекція 19. Принцип одержання блискучих покрить
19.1. Блискучі покриття.
При
осадженні металів зі звичайних
електролітів покриття виходять матовими.
Але так як вони повинні виконувати не
тільки захисні, але і декоративні функції
їх піддають поліруванню. Полірування
це трудомісткий процес, крім того,
затрачаються полірувальні матері
Тому дуже привабливим з’явилася ідея одержання з електролізних ванн блискучих покрить, не потребуючі полірування. Однією з умов одержання таких покрить є забезпечення тонкої кристалічної структури. Установлено, що ідеальне (дзеркальне) відображення світла порушується в тих випадках, коли висота профілю, що утвориться на поверхні, не задовольняє рівнянню
ρ=2H·cosφ,
де
- довжина хвилі падаючого світла; Н –
висота профілю; φ – кут падіння світла;
ρ – постійна, котра для видимих променів
дорівнює 0,1 (ρ=0,1для видимих променів
![]() чи 0,5мкм,Таким чином для перпендикулярно
падаючих променів (φ=0°) знаходимо
чи 0,5мкм,Таким чином для перпендикулярно
падаючих променів (φ=0°) знаходимо
![]()
тобто на дзеркальній поверхні допускаються тільки такі виступи, що по своїх лінійних розмірах у 20 разів менше довжини хвилі падаючого світла.
Так
як в звичайних ваннах розміри зерен
складають 1,9-2мкм, то дзеркальність
поверхні не спостерігається. Однак
дрібнозернистість ще не забезпечує
одержання блискучих покрить. Важливу
роль так само має напрямок розташування
У якості блискоутворювачів у гальванотехніці використовують желатин, нафталін, формальдегід, фурфурол, тіосечовину і її похідні. Механізм дії таких блескообразующих, наприклад при нікелюванні, можна пояснити в такий спосіб. Нікелевий кристал в активному центрі досягає більш високих значень потенціалу чим навколишні кристали. Завдяки цьому відбувається відновлення прилягаючих до нього блискоутворювачів до інгібіторів, що абсорбуються з утворенням ізолюючого шару, тимчасово затримують ріст кристалів. Прилягаючі кристали продовжують рости доти, поки теж не досягнуть потенціалу, достатнього для електровідновлення, після чого і вони ізолюються інгібіторами. Коли вся поверхня в такий спосіб покриється плівкою, осадження металевих кристалів і весь абсорбуючий цикл повторюється. У такий спосіб виходять шари металу паралельні до поверхні основного металу.
Сильні блискоутворювачі підвищують потенціал поляризації і збільшують твердість осаду.
Усі блискоутворювачі умовно розбиті на дві групи: сильні блискоутворювачі і слабкі. Для сильних характерні наступні ознаки:
1. Незалежність блиску від товщини покриття;
2. Наявність включень сторонніх речовин, що виявляються, у гальванічних осадках;
3. Сильне підвищення катодної поляризації;
4. Збільшена твердість і знижена пластичність покрить;
5. Підвищені внутрішні напруження в покриттях.
Слабкі блискоутворювачі дають можливість одержувати напівблискучі покриття. Для них характерно:
1. Зменшення блиску в міру підвищення товщини покриття;
2. Відсутність включення сторонніх речовин у гальваноосадах;
3. Незначний вплив на катодну поляризацію;
4. Незначне збільшення твердості і незначне зменшення пластичності;
5. Мала чутливість електроліту до великої кількості блискоутворювачів.
До сильних блискоутворювачів відносяться – формальдегід, тіосечовина, з ароматичних - нафталін, нафтол. До слабких – спирти.
Блискучі покриття виявляють усі дефекти поверхні, на відміну від полірування, що їх згладжує. Тому у випадку блискучих покрить поверхню необхідно ретельно готувати, стежити за хімічною і фізичною чистотою електролітів.
19.2. Блискучі гальванопокриття з одночасним вирівнюванням (згладжуванням) поверхні.
Якщо
в електроліт увести
Згладжування поверхні в процесі електроосадження спостерігається в тих випадках, коли в поглибленнях товщина металу більше чим на виступах І (Рис.19.1). Прикладом може служити осадження блискучого нікелю на нікелеву основу (І).
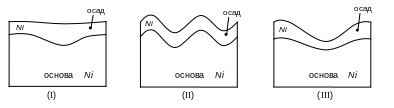
Рис.19.1
У
тих випадках, коли на виступах і западинах
товщина металу однакова (ІІ), то ніякого
згладжування немає – електроліт має
нульову
При додаванні в електроліт таких блискоутворювачі як тіосечовина, кумарин, сахарин і ін. У нікелевих ваннах спостерігається ефект згладжування.
Пропонується кілька методів визначення згладжування:
1) Нанесенням на поверхню зразка рисок визначеної глибини з наступним виміром її глибини після нанесення покриття.
2) Вимір профілю поверхні зразка за допомогою профілометра з метою визначення її шорсткості до і після нанесення покриття.
Перший спосіб більш трудомісткий тому що вимагає виготовлення шліфа, але зате він і більш точний чим другий.
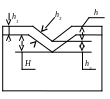
H1 – товщина покриття на рівній поверхні;
h2 – товщина покриття в поглибленні;
h3 – товщина покриття в середній частині поглиблення;
H – глибина западини до нанесення покриття;
h – глибина западини після нанесення покриття.
Рис.19.2
Тоді ступінь згладжування можна визначити:
![]()
Другий спосіб визначення ступеня згладжування заснований на глибині западини до і після покриття:
![]()
Другий метод більш простий і точний, тому його використовують у практиці найчастіше. Найбільшою здатністю вирівнювати володіє кумарин. Максимальний ступінь вирівнювання досягається при концентрації кумарину 0,1г/л. При подальшому підвищенні концентрації кумарину ступінь вирівнювання зменшується, а при 2г/л і більше практично не змінюється.
При
поясненні причини вирівнювання чи
згладжування виходять з дифузійно-адсорбційного
механізму. На шорсткуватій поверхні
кількість іонів чи молекул, що дифундують,
до виступів катодної шорсткості
більше, ніж до западин. Тому на виступах
зосереджується більша кількість
адсорбованої
Лекція 20. Електролітичне осадження сплавів.
20.1. Основні положення електролітичного осадження сплавів.
Крім гальванічного осадження чистих металів, великий інтерес представляє осадження з однієї ванни одночасно двох чи трьох металів. Такий процес називається співосадженням. Метою цього процесу є нанесення на поверхню виробу сплавів, що мають якісь специфічні особливості. Перші досвіди по спільному співосадженню Zn і Cu були проведені Б.С.Якобі ще в 1844р. У роки першої світової війни набув широкого застосування процес електроосаждення свинцю й олова.
Однак широке промислове застосування співосадження металів одержало лише в останні 30-40 років. Електроосажденні сплави іноді мають коштовні властивості: підвищену корозійну стійкість, підвищену зносостійкість, підвищену твердість, антифрикційні властивості, особливі магнітні властивості, підвищену декоративність.
В даний час, крім давно застосовуваних в гальванотехніці латунювання і бронзування, розроблені і набули широкого застосування покриття зі сплавів: Pb-Sn, Nі-Co, Fe-Nі, Sn-Zn, Sn-Cd, Sn-Nі, на основі Au і Ag і ін.. Важливим у співосадженні є і те, що такі метали як W і Mo не осаджуються в чистому виді, але легко співосаджуються разом з Nі, Co, Fe.
Загальної стрункої теорії соосаждения металів немає, але головними факторами, що визначають принципову можливість співосадження є:
1) Величина рівноважних потенціалів кожного металу в даному електроліті;
2) Катодна поляризація кожного металу;
3) Відносна концентрація іонів металів, що осаджуються, особливо в прикатодному шарі;
4) Перенапруга водню на шарі, що осаджується;
5) Режим електроліту ( t°С, J А/Дм2, перемішування, наявність колоїдів і ПАР).
Врахувати окремо кожен фактор можна, але сумарна їхня дія неможлива.
Так потенціали Nі і Co у сірчанокислих розчинах настільки близькі, що їхнє спільне виділення на катоді можливо навіть при найнижчих значеннях щільності струму. Навпаки потенціали Cu і Zn у сірчанокислих електролітах настільки рiзнi, що на катоді удається виділяти чисту мідь при присутності в розчині Zn.
Так
як електродний потенціал при 25°С и 760мм
рт. ст. дорівнює
![]() , то видно, що змінюючи концентрацію
металу в розчині можна змінювати і його
потенціал. У ціаністих електролітах
удається змінити так потенціали Cu і Zn,
що вони будуть дуже близькі, що дозволить
їх легко співосаджувати. У такий спосіб
можна підібрати такі електроліти, що
мають комплексоутворювачi (наприклад
CN), що знижують потенціал (активність
іонів) більш шляхетного металу (Cu) і
підвищують менш шляхетного (Zn). Тому
процес спільного осадження Cu і Zn з
ціаністих електролітів одержав найбільше
поширення. Немає необхідності при
цьому домагатися повної рівності
потенціалів, досить зробити їх настільки
близькими, щоб при не дуже великому
співвідношенні солей металів в
електроліті, наприклад 10:1, співосадження
ставало можливим при низькій щільності
струму.
, то видно, що змінюючи концентрацію
металу в розчині можна змінювати і його
потенціал. У ціаністих електролітах
удається змінити так потенціали Cu і Zn,
що вони будуть дуже близькі, що дозволить
їх легко співосаджувати. У такий спосіб
можна підібрати такі електроліти, що
мають комплексоутворювачi (наприклад
CN), що знижують потенціал (активність
іонів) більш шляхетного металу (Cu) і
підвищують менш шляхетного (Zn). Тому
процес спільного осадження Cu і Zn з
ціаністих електролітів одержав найбільше
поширення. Немає необхідності при
цьому домагатися повної рівності
потенціалів, досить зробити їх настільки
близькими, щоб при не дуже великому
співвідношенні солей металів в
електроліті, наприклад 10:1, співосадження
ставало можливим при низькій щільності
струму.
Порівняємо ж приклади зміни потенціалів у простому і ціаністому розчинах.
Таблиця 20.1
Формула з'єднань міді і цинку |
Потенціал рівноваги, В |
Різниця потенціалів, В |
Потенціал виділення при J=0,5 А/Дм2 |
Різниця потенціалів виділення, В |
||
Cu |
Zn |
Cu |
Zn |
|||
1. CuSo4, ZnSo4 |
+0,285 |
-0,815 |
1,1 |
+0,261 |
-0,878 |
1,139 |
2. Na6Cu(P2O7)2, Na6Zn(P2O7)2 |
+0,082 |
-0,972 |
1,054 |
-1,102 |
-1,392 |
0,29 |
3. Cu(NH3)4(OH)2, Zn(NH3)4(OH)2 |
+0,051 |
-1,04 |
1,091 |
-1,042 |
-1,305 |
0,263 |
4. Na2Cu(CH)4, Na2Zn(CH)4 |
-0,763 |
-1,108 |
0,345 |
-1,448 |
-1,424 |
-0,024 |
Таким чином, із приведеної таблиці видно, що із сірчаних з'єднань співосадження міді і цинку відбуватися не буде.
У комплексних електролітах (2,3) співосадження відбуватися буде, але найкращі умови в ціаністих тому що різниця потенціалів виділення складає усього 24 мв. З таблиці видно, що потенціал поляризації в ціаністих електролітах у міді різко знижується, а в цинку зниження незначне, що приводить до вирівнювання.
Електролітичне осадження сплавів у рідких випадках протікає з теоретичним виходом по струму. Часто воно супроводжується виділенням водню, що перемішує прилягаючий до катода шар електроліту і тим самим впливає на хімічний склад сплаву, що осаджується. Крім того, на виділення водню затрачається визначена кількість електрики, що утрудняє визначення виходу по струму для кожного металу, що входить до складу сплаву.
Неможливо також вважати, що збільшення іонів металу в розчині в 2 рази приведе до збільшення його рівно в два рази в осаді. Іноді концентрація збільшується лише на 5-10%. Усе це робить процеси співосадження металів мало прогнозованими.
Підвищення щільності струму, а також зниження температури (при відсутності перемішування) сприяють підвищенню процентного вмісту в сплаві металу з більш негативним потенціалом (у випадку латуні - цинк).
Перемішування сприяє переважному виділенню на катоді шляхетного металу. Наприклад, у ціаністих електролітах без перемішування виділяється переважно золото, а при перемішуванні сплави виходять не жовті, а білі опади, що свідчить про переважне виділення срібла.
20.2. Фазова структура і властивості співосадженних сплавів.
Фазова структура сплавів отриманих з електролітів при температурах нижче 100°С може значно відрізнятися від таких же сплавів отриманих з розплавів. При формуванні сплавів, отриманих гальванічним шляхом, роль дифузії практично зводиться до нуля.
По діаграмі стану Cu-Sn розчинність олова в міді при кімнатній температурі не перевищує 1%. У сплавах же Cu-Sn, отриманих із хлорнокислих розчинів, пересичені тверді розчини олова в міді утворяться аж до вмісту олова 22%.
Багато сплавів, наприклад, Co-W, Nі-P, Co-P, Cu-Zn, Cu-Pb, Ag-Zn, Ag-Cd після рекристалізаційного відпалювання здобувають характерну для рівноважних сплавів структуру.
Очевидно, рівноважну структуру гальванічні сплави мають лише в тому випадку, коли розряд іонів обох металів відбувається одночасно вже при найнижчій щільності струму. Навпроти, якщо розряд іонів більше негативного металу настає лише по досягненні визначеної щільності струму, то сплави осаджуються в хитливому стані і при нагріванні їх до температури рекристалізації з'являються нові фази. Виникаючі при співосадженні нерівноважні сплави можуть мати особливі властивості. Так чисті метали мідь і вісмут не мають надпровідностi, а отриманий їхній сплав 50-80% Bі має цю властивість. Співосадженням можна одержувати сплави з особливими магнітними властивостями, антифрикційними, оптичними й ін.
При співосаджені металу до анодів пред'являються більше вимоги, чим при осадженні чистих металів. При цьому застосовують три типи електродів: 1) Розчинні, що представляють собою сплави такого ж складу, що виділяються на виробах, що покриваються; 2) Нерозчинні; 3) Комбіновані з окремих металів.
Розчинні аноди найбільш зручні з погляду їхньої експлуатації так як вони розчиняючись дозволяють підтримувати сталість електроліту. Однак рівномірно розчиняються тільки однофазні аноди, гетерогенні сплави можуть розчинятися нерівномірно.
Застосування нерозчинних анодів зв'язано з частим коректуванням електроліту. Комбіновані аноди завішують часто на окремі штанги. Електрична схема при цьому ускладнюється, додаткові реостати, амперметри.
20.3 Гальванотермічний спосіб покриття сплавами.
Крім безпосереднього електроосадження з розчину сплаву двох металів, можна роздільно осаджувати кожен метал, з наступним нагріванням з метою утворення сплаву перемінного складу в результаті дифузії. При цьому електроосадження кожного металу відбувається в розчинах простих солей, що дозволяє вести процес з нагріванням і перемішуванням при високої щільності струму. При утворенні сплавів відбувається дифузійна взаємодія і з підкладкою, що збільшує міцність зчеплення.
Так після нанесення міді і нікелю на сталь з наступним вiдпалюванням утворювався сплав, що наближається до монель-металу.
Щоб полегшити дифузію на зразок металу наносимо пошарово шар Nі та шар Cu, потім знову Nі і Cu і т.д. Вiдпалювання проводимо в печі з температурою 800-1000°С з тривалістю від 3 до 25 годин. Випробовування на корозійну стійкість показали, що вона в 1,5 рази вище, ніж у таких же сплавів Cu-Nі, отриманих співосадженням з розчинів.
20.4 Застосування ультразвуку і реверсування струму в
гальванотехніці.
Теоретичні передумови про те, що ультразвукові коливання значно прискорюють процеси осадження металів не підтвердилися.
Більший ефект має реверсування струму. Покриття при цьому виходять більш щільні, а процес протікає більш інтенсивно. Так, застосовуючи реверсування при латунюванні, удалося збільшити швидкість осадження в 2 рази.
Лекція 21. Підготовка поверхні перед нанесенням покриття.
21.1. Механічна обробка поверхні.
Підготовка
поверхні основного металу є невід'ємною
і досить істотною операцією всього
технологічного процесу нанесення
металевих покрить. Міцність зчеплення
між основою і металопокриттям може бути
задовільною тільки при відсутності між
ними сторонніх забруднень, найчастіше
у виді жирів і окислів. Міжатомні сили,
що забезпечують зчеплення між
основоюпокриттям виявляються лише при
відстані між атомами порядку
![]() .
Для видалення з поверхні виробу окалини,
задирок, раковин застосовують шліфування.
Абразиви- SіС, корунд - Al2O3, наждак (60-70%
Al2O3 + 30-40% Fe2O3), що зв'язаннi вогнетривкою
глиною, польовим шпатом, тальком, каучуком
(табл.. 21.1).
.
Для видалення з поверхні виробу окалини,
задирок, раковин застосовують шліфування.
Абразиви- SіС, корунд - Al2O3, наждак (60-70%
Al2O3 + 30-40% Fe2O3), що зв'язаннi вогнетривкою
глиною, польовим шпатом, тальком, каучуком
(табл.. 21.1).
За ДСТом шліфувальні абразиви поділяються на шліф - зерно (150-2300мкм), шліф - порошки (20-150мкм), мікро порошки (3,5-28мкм).
Полірування проводиться на тих же верстатах, що і шліфування, але проводиться за допомогою еластичних дисків (диск дерево - шкіра, повстяні кола, фетрові з бавовняних і ін. тканин). Абразивні матеріали закріплюються за допомогою столярного клею або наносяться разом зі стеарином, парафіном, олеїновою кислотою, технічним салом, воском або церезином. Абразив: крокус - окис заліза, окис хрому, окис алюмінію й ін.
Тоді підготовка поверхні полягає найчастіше в знежиренні і травленні для видалення жирових і оксидних забруднень. У випадку якщо вироби перед цим піддавалися відпалюванню, то знежирення уже втрачає зміст.
Однак якщо вироби піддавалися загартовуванню в маслі, то знежирення - обов'язкове.
Таблиця 21.1
Склади паст для полірування металу.
Метал, що полірується |
Найменування пасти |
Склад пасти |
Вагових частин в % |
Вуглецева та нержавіюча сталі, хром. |
Хромова |
Окис хрому Cr2O3 Стеарин Воску |
72% 14% 14% |
Сталь, нікель, мідь та її сплави, цинкові сплави. |
Крокусна |
Окис заліза Fe2O3 Стеарин Олеїнова кислота Церезин Парафін |
73% 18,6% 1,0% 2,0% 5,4% |
Латунь, нікель, алюміній, срібло, золото. |
Вапниста |
Віденське вапно Церезин Стеарин Сало технічне Скипидар |
71,8% 1,5% 23% 1,5% 2,5% |
Нікель, мідь та її сплави |
Алюмінієва |
Окис алюмінію Al2O3 Сало технічне Стеарин Церезин Скипидар |
65% 8% 10% 14,5% 2,5% |
При нанесенні захисно-декоративних покрить підготовка поверхні доповнюється ще одною операцією - тонке шліфування, а іноді і полірування. При цьому шорсткість потрібно звести до мінімуму, тому що на виступах щільність струму більше і покриття теж більше. Мікродефекти не тільки не зникають, а навпаки ще більше виділяються.
Однак механічна підготовка поверхні - досить дорога операція (наждакові спеціальні повстяні кола змінюють, переходячи від самого великого абразиву до самого тонкого). Часто вартість механічної обробки дорожче, ніж безпосереднє нанесення гальванопокриттів.
Механічна обробка забезпечує не тільки високу декоративність, але і зменшує пористість покрить. Однак при механічній обробці поверхневий шар деформується, і міцність зчеплення трохи зменшується. Щоб знівелювати негативний вплив проводять декапірування
21.1. Знежирення.
Усі жирові забруднення можуть бути віднесені до двох основних груп:
1) Рослинного і тваринного походження;
2) Мінерального походження.
Перша група жирів під дією водних розчинів, лугів або солей лужних металів утворить мила, розчинні у воді солі кислот і гліцерину. Друга група жирів не обмилюється розчинами солі. Процес омилення жирів можна продемонструвати на прикладі реакції стеарину з їдким натром:
(C17H35COO)3C3H5 + 3NaOH = 3C17H35COONa + C3H5(OH)3
стеарин стеарат натрію гліцерин
Утворений стеарат натрію (мило) гарно розчиняється у воді, особливо гарячої.
Вибір складу розчинів, що знежирюють, робиться в залежності від природи оброблюваного матеріалу і ступеня жирності поверхні.
Вироби з цинку, алюмінію і їхніх сплавів знежирюються в слаболужних розчинах. Для сталі можна застосовувати більш концентровані розчини. Приклади.
Для сталі, міді та
її сплавів.
NaOH
или KOH....................20-30г/л Na3PO4
и Na2CO3.................25-30г/л Na2SiO3.................................3-10г/л Температура
70-90°С Тривалість
10-30хв.
Для цинку, алюмінію
та їх сплавів.
Na3PO4.............................50г/л Na2CO3.............................50г/л Na2SiO3............................30г/л Температура
60-70°С Тривалість
15хв.
Електрохімічне знежирення.
При електрохімічному знежиренні на процес хімічного впливу накладається електричний струм. Щільність струму 3-10А/Дм2, t=60-80°С, а тривалість у кілька разів менше, ніж при хімічному. Частіше виріб обробляється катодно, хоча в окремих випадках прибігають і до анодного процесу. Електролітами можуть служити ті ж розчини, що і для хімічного знежирення. Механізм процесу електрохімічного знежирення зводиться в основному до емульгування жирів пухирцями водню, що виділяються, на катоді або кисню на аноді.
При зануренні металу з жирною поверхнею в лужний розчин спостерігається розрив масляної плівки і збирання її в крапельки під впливом сил поверхневого натягу. При поляризації металу крайові кути крапельок, що утворилися, зменшуються, і прилипання масляної плівки до поверхні металу слабшає, а змочуваність водою збільшується. Дрібні газові пухирці, відриваючись від електрода біля краплі масла, затримуються на останній і залишаються на границі між олією і розчином. В міру збільшення газових пухирців масляні краплі витягаються, сили зчеплення з поверхнею металу зменшуються, і схоплені газовим пухирцем вони спливають на поверхню розчину.
При проходженні струму на катоді може виділятися водень, іони металів Zn, Pb, Sn утворюючи тонку плівку. Щоб від неї позбутися рекомендують до кінця процесу змінити напрямок струму на 0,5хв. При цьому на колишній катод почне виділятися О2, що буде взаємодіяти з абсорбованим на ньому воднем, звільняючи поверхню від плівок.
У випадку якщо на поверхні деталі виявилися мінеральні масла, а у виробництві так найчастіше і трапляється, то усунути їх хімічним і навіть електрохімічним методом неможливо тому що вони не обмилюються .
Жири мінерального походження віддаляються шляхом розчинення їх в органічних розчинах, наприклад, у гасі, бензині, толуолі й ін. (табл.. 21.2)
Особливо широке застосування одержав трихлоретилен, що на ряді з гарною розчинюючою здатністю жирів є незаймистим і не робить роз'їдаючого впливу на металеві поверхні, за винятком алюмінієвих і магнієвих виробів. Як і всі розчинники жирів трихлоретилен (C2HCl3) шкідливий для здоров'я людини, викликає головний біль. Однак на відміну від гасу, бензину, толуолу його пари майже в чотири рази тяжкіше повітря, що дозволяє збирати його внизу, а свіже повітря подавати зверху. В міру наповнення у ванні жирів розчинник звільняють від них дистиляцією і знову вводять у виробництво. Витрата розчинника при цьому зводиться до мінімуму.
Приведемо деякі характеристики основних розчинників:
Вище температури кипіння, при наявності вологи усі вони утворюють пари соляної кислоти, з яким можуть координувати металеві поверхні. Тому не можна приводити в зіткнення з розчинниками вироби, що мають сліди вологи або кислоти (наприклад, після пайки). Після знежирення в розчинниках на поверхні може залишатися дуже тоненька жирова плівка. Тому слідом за розчиненням жирів в органічних розчинниках необхідно додатково лужне знежирення і промивання в гарячій воді. Особливо добре розчиняють мінеральні олії Na3PO4 і Na2O · 3Sі2 якщо в розчин увести поверхово активні речовини.
21.2. Травлення.
Видалення окислів з поверхні виробів перед зануренням їх у гальванічні ванни є обов'язковою операцією що забезпечує міцне зчеплення з гальванічними покриттями. Травник вибирається в залежності від природи оброблюваного металу і наявної на його поверхні плівки окислів, її товщини і будівлі. Частіше травлення здійснюється в розчинах кислот, але для деяких металів, наприклад алюмінію і його сплавів, видалення окислів ефективніше протікає в лужних розчинах.
Таблиця 21.2
Розчинник |
Молекулярна маса |
Щільність при 15°С, г/см3 |
Температура кипіння при 760мм рт.ст., °С |
Трихлоретилен C2HCl3 |
131,4 |
1,47 |
87,0 |
Тетрахлоретилен C2Cl4 |
166,8 |
1,62 |
119,2 |
Чотирихлористий вуглець CCl4 |
153,8 |
1,59 |
76,5 |
Тетрахлоретан C2H2Cl4 |
167,8 |
1,59 |
145,5 |
Гексахлоретан C2Cl6 |
236,7 |
2,0 |
185 |
Травлення сталі і чавуна звичайно здійснюється сірчаною або соляною кислотою. При цьому протікають наступні реакції:
FeO
+ 2HCl
= FeCl2
+ H2O Fe2O3
+
6HCl
= 2FeCl3
+ 3H2O Fe3O4
+ 8HCl
= 2FeCl3
+ FeCl2
+ 4H2O Fe
+ 2HCl
= FeCl2
+
H2 FeCl3
+
H
= FeCl2
+ HCl
2FeCl3
+Fe
= 3FeCl2
FeO
+ H2SO4
= FeSO4
+ H2O Fe2O3
+
3H2SO4
= Fe2(SO4)3
+ 3H2O Fe3O4
+ 4H2SO4
= FeSO4
+ Fe2(SO4)3
+ 4H2O Fe
+ H2SO4
= FeSo4
+ H2 Fe2(SO4)3
+ H2
=
2FeSO4
+ H2SO4 2Fe2(SO4)3
+ 2Fe
= 6FeSO4
З цих реакцій з найбільшою швидкістю протікають реакції (1) - розчинення закису заліза і реакція (4) - розчинення металевого заліза.
Що стосується інших окислів, то розчинність їх надзвичайно мала і видаляються вони, імовірно, по електрохімічному механізму. Велику роль мають реакції відновлення тривалентного заліза до двовалентного (5). У свіжих травильних розчинах солі тривалентного заліза відсутні.
Розглянемо вплив швидкості розчинення окислів заліза в соляній кислоті в залежності від її концентрації.
З табл.. 21.3 видно, що розчинність металевого заліза в соляній кислоті будь-якої концентрації більше розчинності його окислів.
Але з підвищенням концентрації соляної кислоти швидкість розчинення окислів зростає в більшому ступені, чим швидкість розчинення металевого заліза. Ще більше швидкість розчинення Fe у H SO . Так у 10% розчині H SO заліза розчиняється в 70 разів більше, ніж Fe, а в 10% розчині HCl тільки в 10 разів.
Таблиця21.3
Концентрація HCl, % |
Розчинність, г/год на 100г речовини |
||
Fe |
Fe2O3 |
FeO |
|
1 |
20,8 |
0,112 |
0,48 |
2 |
22,7 |
0,17 |
0,63 |
3 |
31,6 |
0,31 |
0,76 |
5 |
40,7 |
0,71 |
0,83 |
7 |
50,1 |
1,6 |
1,8 |
10 |
72 |
10,6 |
7,5 |
14 |
109,6 |
21,1 |
41,1 |
18 |
191 |
38,6 |
79,7 |
21 |
356 |
46,8 |
90 |
Fe3O4 являє собою напівпровідник і в контакті з металевим залізом у розведеній H SO утворює мікро гальванопару з едс порядку 0,8-1,0В при силі струму 2ма/см2. Водень, що виділяється на магнетитовому катоді, відновлює Fe3O4 до FeО і Fe, що значно легше розчиняються в кислотах. Fe2O3 - поганий провідник електричного струму і не може, подібно магнетитові, розглядатися як катод у короткозамкнутому гальванічному елементі. Більш того Fe2O3 утворить тонку плівку, що утрудняє доступ кислоти до заліза і, отже, утрудняє роботу гальванічного елемента. У процесі видалення окалини Fe2O3, очевидно, хімічно не реагує з кислотою і попадає в травильний шлам. Відновлення Fe2O3 воднем, подібно Fe3O4, теж мало ймовірно. Хоча товщина і будова окалини залежить від багатьох факторів, розташовуються окисли в наступному порядку: тонкий верхній шар Fe2O3, під ним більш товстий Fe3O4 і, нарешті, найбільш товстий шар, що безпосередньо примикає до металу, FeО. Окисли заліза мають меншу щільність, чим залізо і тому займають більший обсяг.
Залізо і його окисли Fe FeО Fe2O3 Fe3O4
Щільність, г/см3 7,8 5,9 5,1 5,2
В наслідок
об'ємних змін в окалині виникають
внутрішні напруження, що приводять до
виникнення в ній пір і тріщин. Якщо
через тріщин в пори попадає кислота, то
виникає короткозамкнутий гальванічний
елемент, у якому чистий метал є анодом,
а його окисли, у випадку заліза Fe3O4 -
катодом. Після розчинення Fe3O4 і FeО водень
підриває плівку Fe2O3, розколюючи і
видаляючи неї з поверхні.
наслідок
об'ємних змін в окалині виникають
внутрішні напруження, що приводять до
виникнення в ній пір і тріщин. Якщо
через тріщин в пори попадає кислота, то
виникає короткозамкнутий гальванічний
елемент, у якому чистий метал є анодом,
а його окисли, у випадку заліза Fe3O4 -
катодом. Після розчинення Fe3O4 і FeО водень
підриває плівку Fe2O3, розколюючи і
видаляючи неї з поверхні.
До зіткнення кислоти з металом водень не виділяється. При введенні інгібіторів перенапруга водню на залізі підвищується, що сповільнює його розчинення. Швидкість зняття окалини не зменшується при введенні інгібіторів органічного походження (желатини) так як окисли заліза адсорбують менше ніж чисте залізо.
Введення неорганічного інгібітору (SnCl2) сповільнює зняття окалини. Швидкість травлення залежить від концентрації кислоти і збільшується при підвищенні концентрації, але до визначеної межі. Так швидкість травлення досягає max при 25% H SO , після чого починає зменшуватися. При однаковій концентрації швидкість травлення в HCl більше чим у H SO , тому часто використовують травителі 5-10% H SO і 10-15% HCl.
Унаслідок летючості соляної кислоти її температуру підтримують не вище 30-40°С; сірчану кислоту нагрівають до 60°С, а при нагромадженні в ній великої кількості FeSO4 нагрівають до 80°С. Як видно з електрохімічного механізму видалення окалини, розчиняються не тільки окисли, скільки металеве залізо, а водень, що виділяється, дифундує в метал, знижує його механічні властивості. Непродуктивно витрачається метал і кислота, робоча атмосфера засмічується бризами кислоти, що захоплюється водневими пухирцями. Для зменшення швидкості розчинення металу аж до припинення в травильні ванни вводять спеціальні речовини - сповільнювачі, в основному органічного походження. Сповільнювачі створюють на поверхні адсорбційну плівку. Ця плівка, створюючи захисні властивості, не припиняє процес тому що має досить пір (~ 60% усієї поверхні).
В ид
у розрізі (а) і зверху (б) такої плівки
показаний на малюнку. Молекулярні
ланцюжки представлені у виді маленьких
ділянок з порами. Захисна дія адсорбованої
плівки обумовлено утрудненою дифузією
іонів, у тому числі і H3O+ необхідних для
розчинення металу.
ид
у розрізі (а) і зверху (б) такої плівки
показаний на малюнку. Молекулярні
ланцюжки представлені у виді маленьких
ділянок з порами. Захисна дія адсорбованої
плівки обумовлено утрудненою дифузією
іонів, у тому числі і H3O+ необхідних для
розчинення металу.
Застосування сповільнювачів дозволяє скоротити витрату кислоти на 30%, знизити втрати металу, що зменшує нагромадження FeSO4 у ванні, зменшується кількість розчинів і стічних вод.
Інгібітори травлення.
Промисловість випускає 20-25 найменувань інгібіторів. Найбільш розповсюджені інгібітори ЧМ, ПБ-5 який виявляє інгібіруючі властивості лише при t=60°C, БА-6 добре розчиняється в розчинах кислот і не випадає в осад у присутності солей заліза.
Гарні результати дає інгібітор катанин у розчинах HCl, H SO , H3PO4. Його інгібіруючий ефект зростає якщо до розчину додати 0,1% йодиду калію.
При травленні вуглецевих, низьколегованих сталей, а також алюмінію і цинку в соляний і сірчаній кислотах застосовують інгібітор ПКУ-К при температурах до 100°С.
Широко також застосовуються інгібітори И-1-А, И-1-В, КПИ (для соляної кислоти), уротропін (для соляної і сарною кислот), тіосечовина (для азотної кислоти).
Відзначається деяке зниження міцності зчеплення покрить при застосуванні інгібіторів.
Травлення в ультразвуковому полі.
Накладення на процес травлення ультразвукових коливань сприяє видаленню різних забруднень, окалини, іржі з поверхні особливо складних, дрібних, а в деяких випадках і великогабаритних виробах, до яких пред'являються особливі вимоги по ступені очищення.
Перевага травлення в УЗП:
1) Висока якість поверхні;
2) Інтенсифікація процесу;
3) Зниження витрати хімікатів;
4) Зменшення водневої крихкості.
УЗТ протікає з max швидкістю в менш концентрованих розчинах. Температура розчину не робить істотного впливу. Оптимальний розчин: 100г/л H2SO4, 50г/л NaCl, t=50-60°C. При травленні в HCl max швидкість досягається при концентрації кислоти 12%. Застосовують також комбіноване травлення.
До недоліків сповільнювачів варто віднести збільшення тривалості процесу. До достоїнств сповільнювачів також варто віднести можливість підвищення температури без зменшення якості, значно знижуючи крихкість.
Гарний сповільнювач повинний максимально зменшувати розчинення заліза, мінімально збільшити тривалість травлення, і бути досить стійким в експлуатації.
Нержавіючі сталі мають на поверхні стійкі окисли Cr2O3, Nі2O3, Fe2O3, а також менш стійкі FeО, NіО. Її травлення проводять у 30%-м розчині HCl або використовують дві кислоти, розпушують окалину в 20%-м розчині H SO , а потім проводять травлення в 20%-м HNO3.
Мідь і її сплави труять в основному в 10%-м розчині H SO . Алюміній і його сплави травлять у 10%-м розчині NaOH при t=60-80°C, а після промивання освітляють у 50%-м розчині HNO3.
21.3. Електролітичне травлення.
При електролітичному травленні виріб включається в ланцюг постійного струму, як в якості катода, так і анода. Або проводять реверсування струму. Часто також на постійний струм накладають перемінний. Анодно поляризоване залізо стає пасивним, воно не переходить у розчин у виді Fe2+ і при потенціалі > 2В починається розряд гідроксильних іонів або інших аніонів. Виходить, у цьому випадку немає необхідності застосовувати концентровані кислоти і можна обійтися розведеними. Катодна поляризація робить такий же вплив, як і присадки, що вводяться при хімічному травленні. Однак у цьому випадку можливе насичення воднем, тому анодне травлення більш прийнятне.
Лекція 22. Електролітичне і хімічне полірування.
22.1. Основи теорії процесу електролітичного полірування.
Теоретична сутність процесу електролітичного полірування повною мірою дотепер не встановлена. Основним положенням цієї теорії є те, що поверхня виробів при електролітичному поліруванні знаходиться одночасно в активному і пасивному станах: вона активна на мікроскопічних виступах і пасивна в мікроскопічних заглибленнях.
При електролітичному поліруванні анодом є виріб, тому що тут повинне йти розчинення нерівностей. Щоб підтримувати поглиблення в пасивному стані, а виступи в активному, необхідно належним чином регулювати процес.
При дуже низькій щільності струму вся анодна поверхня знаходиться в активному стані і ніяке полірування не спостерігається, відбувається просте протравляння. При надмірно високій щільності струму нормальний хід електролітичного полірування може бути теж порушене внаслідок затримки на оброблюваній поверхні газових, (кисневих) пухирців.
У процесі електролітичного полірування відбуваються великі зміни в складі і фізико-хімічних властивостях прианодного шару, зразкова товщина якого 5·10-2см =0,5мм. Ці зміни особливо значні, коли поляризація анода має значення нижче потенціалу заряду гідроксильних іонів і виділення кисню, що перемішує прианодний шар.
Склад електроліту і властивості прианодного шару приведені нижче (для полірування Cu).
Таблиця 22.1
-//- |
Електроліт |
Прианодний шар |
Щільність при 25°С, г/см3 |
1,512 |
1,6 |
Вміст міді, г-іон/л |
- |
100,5 |
Коефіцієнт в’язкості (у H2O=1) |
13,8 |
27,2 |
Питома електропровідність, Ом-1·см-1 |
0,143 |
0,087 |
2. Розведення розчину і підвищення температури затримує процес полірування міді в ортофосфорній кислоті.

3. Більшість поліруючих електролітів є в’язкими рідинами.
В’язка плівка складається з окислів металу, що полірується і знаходиться в стиснутому стані. Ступінь стиску мінімальний на виступах і максимальна в западинах. Отже, щоб "протягти" атом через плівку необхідна максимальна робота в поглибленнях і мінімальна на виступах. Тому щільність струму на виступах величиною 0,15мм може бути в 2,5 рази вище, ніж у поглибленнях.
22.2. Хімічне полірування.
22.3. Насичення міддю.
Мідь - метал рожевого кольору, ГЦК, ρ=8,9г/см3, tпл=1083°С, ρсопр=1,7·10-8Ом·м. Мідь добре розчиняється в аміачних і ціаністих розчинах, азотній кислоті, менш інтенсивно в хромової, слабко - у сірчаній і майже не реагує із соляною кислотою.
В атмосфері мідь легко взаємодіє з вологою, вуглекислими і сірчистими з'єднаннями, покривається оксидами і теміє, або утворить зелену патину, що, очевидно, являє собою основний сульфат міді CuSO4·3Cu(OH)2. На морському узбережжі може утворювати основний хлорид міді.
Стандартний потенціал стосовно одновалентних іонів дорівнює +0,52В, стосовно двовалентних +0,34В.
Мідні покриття застосовуються:
1. Як підшар при нанесенні багатошарових захисно-декоративних і функціональних покрить на виробах зі сталі, цинкових і алюмінієвих сплавів у багатьох областях промисловості;
2. Для поліпшення пайки;
3. Для місцевого захисту сталевих деталей при цементації, азотуванні, борируванні й ін. функціональних процесах;
4. Для покриття поверхні деталей, що піддаються глибокій витяжці;
5. Для нарощування товстих шарів у гальванопластиці при знятті металевих копій з художніх виробів.
Товщина мідних покрить у залежності від їхнього призначення складає, мкм:
Підшар при срібленні і золоченні сталевих деталей...........................0,3-0,5.
Підшар у багатошарових захисно-декоративних покриттях.................. 9-36.
Підшар при пайці........................................................................................6-36.
Шар для зниження перехідного опору......................................................9-30.
Шар для захисту від цементації..............................................................до 50.
Шар для деталей, що піддаються глибокій витяжці................................до 9.
Шар у гальванопластиці............................................................................≥100.
Насичення міддю виробляється в кислих і лужних електролітах.
1. Насичення міддю в кислих електролітах.
Кислі - сульфатні або фторборатні. Стійкі в експлуатації, не токсичні, мають високий вихід по струму (95-100%) і значну швидкість осадження.
Недолік - низька здатність електролітів розсіюватися, тому у них покривають деталі не складної конфігурації. Вони на поверхні сталі виділяють контактну мідь, що слабко зчеплена з основою. Хоча при введенні в електроліти спеціальних органічних добавок, що гальмують процес контактного обміну, можна одержувати осади, міцно зчеплені зі сталлю (столярний клей, сахароміцети й ін.).
У промисловості перед насиченням міддю сталевих виробів на них наносять Nі-0,3-0,5мкм або мідь з ціаністих електролітів.
Приклад сульфатного, кислого електроліту:
міді сульфат...................................200-250г/л
кислота сірчана..............................0-50г/л
блискоутворювач У-2.....................0,5-1г/л
блискоутворювач ДСУ, ДСМ..... ........2г/л
катодна щільність струму...................3-5А/дм2.
Розчини готують на дистильованій воді.
2. Лужні розчини включають ціаніди.
Їхні достоїнства: висока здатність розсіюватися, дрібнозернистість опадів і можливість безпосередньо осаджувати мідь на сталеві вироби, так як відсутнє контактне осадження.
Недоліки: токсичність, недостатня стійкість у роботі, низький вихід по струму (50-75%), мала швидкість осадження.
Приклад лужного електроліту для обміднення:
міді ціанід (CuCN)...................................40-50г/л
натрію ціанід (NaCN)..............................45-55г/л
натрію карбонат (Na2CO3)......................10-15г/л
натр їдкий (NaOH)...................................3-5г/л
температура............................................40-50°С
катодна щільність струму..................до 1,5А/дм2
Лекція 23. Гальванічне нанесення покрить із сплавів
23.1. Гальванічні покриття Zn і Cd.
Цинк (Zn) - метал світло-сірого кольору, валентність - 2, атомна маса 65,4, ρ=7,13г/см3, tпл=419°С, гратка - гексагональна, без атомів у середині, питомий опір 6·10-8Ом·м. У сухому повітрі цинк і його покриття - високостійкі, у вологому повітрі і воді покриваються білою плівкою карбонатних і оксидних з'єднань (ZnО). Стандартний потенціал Zn=-0,76В (заліза -0,44В). Він добре розчиняється в кислотах, навіть розведених, будучи в той же час амфотерним металом, він розчиняється також у лугах.
Стосовно заліза Zn є анодним покриттям так як при наявності вологи утворить з Fe гальванічну пару, у якій цинк розчиняється, захищаючи залізо.
Цинкові покриття застосовуються:
1. Для покриття різьбових деталей при роботі в легких умовах (товщина 3-6мкм), а також у середніх і жорстких умовах експлуатації (9-12мкм);
2. Для покриття деталей, приладів, верстатів у легких умовах експлуатації (6-8мкм);
3. Для захисту від корозії сталевих виробів у середніх умовах експлуатації (15-18мкм);
4. Для захисту від корозії сталевих виробів у твердих і дуже жорстких умовах експлуатації (24-42мкм).
Кадмій (Cd) - метал сріблисто-білого кольору із синюватим відливом, атомна маса 112,4, валентність - 2, ρ=8,6г/см3, tпл=321°С, питомий опір 7,6·10-8Ом·м. Стандартний потенціал Cd=-0,4В. Захисні властивості Cd-покрить високі в умовах впливу атмосфери або рідкого середовища, що містить хлориди. Cd-покриття мають низьку корозійну стійкість у середовищах, що містять кислоти і сірку.
Cd-покриття застосовують:
1. Для покриття пружин і кріпильних деталей, що працюють у легких і середніх умовах експлуатації (товщина 6-9мкм);
2. Для покриття деталей приладів, що працюють у середніх умовах експлуатації (15-18мкм);
3. Для покриття деталей приладів, що працюють в умовах морський атмосфери (24-36мкм).
У присутності SO2 швидкість корозії Cd набагато більше, ніж Zn, а в присутності аніонів Cl- швидкість корозії Zn у 1,6 рази вище, ніж Cd. В умовах підвищеної відносної вологості і температури (тропічні умови) Zn корозірує з більш високою швидкістю, при цьому утворяться пухкі продукти корозії. Cd має низьку швидкість корозії в тропічних умовах. Швидкість корозії Zn у воді росте з підвищенням температури і досягає максимального значення при 65-70°С. Наявність максимуму зв'язана з утворенням зернистої плівки. При 65-70°С електродний потенціал Zn стає більш позитивним, чим у сталі. Кадмійовані сталеві вироби в атмосферних умовах можуть працювати при температурах до 250°С, а оцинковані до 300°С.
Всі електроліти для цинкування та кадміювання підрозділяються на прості і комплексні.
Приклади простих електролітів:
Таблиця 22.2
Цинкування |
Кадміювання |
||
Сульфат цинку, г/л |
575-700 |
Сульфат кадмію, г/л |
40-60 |
Сульфат алюмінію, г/л |
25-30 |
Сульфат натрію, г/л |
40-60 |
Кислотність, рH |
3,5-4,5 |
Сірчана кислота, г/л |
40-60 |
Температура, °C |
40-50 |
Температура, °С |
15-30 |
Катодна щільність струму, А/дм2 |
50-400 |
Катодна щільність струму, А/дм2 |
1-3 |
Приклади комплексних електролітів:
Цинкування |
Кадміювання |
||
Оксид цинку, г/л |
4-10 |
Оксид кадмію, г/л |
20-30 |
Ціанід натрію, г/л |
15-40 |
Ціанід натрію, г/л |
125-150 |
Їдкий натр, г/л |
8-24 |
БК-2С, г/л |
15-20 |
Температура, °C |
25-40 |
Температура, °С |
15-30 |
Катодна щільність струму, А/дм2 |
0,5-2 |
Катодна щільність струму, А/дм2 |
до 3 |
Для одержання сплавів Zn-Cd використовують фтороборатні електроліти наступного складу
цинку, кадмію фтороборат (Zn - 25-28г, Cd - 26-30г, в перерахунку на метал)
калію ціанід.............................45-50г/л Cd(BF4)2
NaOH…………….....................55-60г/л Zn(BF4)2
температура……....................18-25°С
катодна щільність струму......0,5-1А/см2
23.2. Гальванічне осадження елементів групи заліза Nі.
Це метали VІІІ групи періодичної системи, що мають близькі фізичні, хімічні й електрохімічні властивості. Усі вони магнітні. По хімічній активності Fe займає перше місце - воно легко окисляється на повітрі, а в присутності вологи іржавіє. Нікель виявляє великий ступінь до пасивування, що в значній мірі визначає широке поширення процесу нікелювання. Кобальт займає проміжне положення. При 400°С поверхня Co стає з початку синьою потім чорною. Усі вони утворюють 3-х і 2-х валентні з'єднання. Електроосадження металів групи заліза здійснюється з розчинів двовалентних з'єднань. Розряд іонів металів цієї групи супроводжується значною катодною поляризацією, і виділення цих металів на катоді починається при значеннях потенціалів, що більш негативні відповідних стандартних потенціалів. Тому для електроосадження металів групи заліза немає потреби прибігати до розчинів комплексних солей - ці метали цілком задовільно кристалізуються на катоді з розчинів простих солей.
22.3. Нікелювання.
Нікель (Nі) - метал сріблисто-білого кольору з жовтуватим відтінком. Атомна маса 58,7, валентність - 2, ρ=8,9г/см3, tпл=1450°С, питомий опір 7·10-8ОМ·м. В атмосфері нікель покривається дуже тонкою плівкою окислів, яка, будучи прозорою, не змінює кольору його поверхні (Nі2O3). Цей процес називається пасивуванням. Пасивна плівка дуже утрудняє дифузію елементів через неї і захищає Nі від подальшої корозії.
Стандартний потенціал нікелю - 0,25В. Стосовно Fe він більш електропозитивний і є катодним покриттям.
Нікель стійкий у лугах, воді, має малий коефіцієнт сухого тертя зі сталлю (0,11-0,12), досить зносостійкий.
Нікелеві покриття застосовуються:
1. Для захисно-декоративної і декоративної обробки деталей апаратів, приладів, навантажених частин автомобілів, велосипедів, мотоциклів, медичного інструмента, предметів домашнього побуту й ін.;
2. Для захисту від корозії в умовах підвищених температур і спеціальних середовищ (луги, деякі кислоти й ін.);
3. Як проміжний підшар для нанесення інших покрить на сталь з метою забезпечення міцного зчеплення з основою;
4. Для підвищення зносостійкості тертьових поверхонь.
Товщина нікелевих покрить визначається їхнім призначенням і рекомендується в наступних межах:
6-30мкм - для захисно-декоративних і декоративних покрить;
0,5-3мкм - як проміжний шар;
≤300мкм- для захисту від корозії в агресивних середовищах;
20-100мкм- для підвищення зносостійкості.
Для нікелювання найчастіше використовують сульфатні електроліти (NіSO4·7H2O). Ця сіль сульфату нікелю добре розчиняється у воді (до 400г/л).
У якості депасиваторів анода в ці розчини вводять солі лужних металів - NaCl, рідше KCl. Як буферне з'єднання звичайно використовують борну кислоту (H3BO3), а також солі оцтової кислоти. Для електролітів з низьким значенням pН більш ефективні добавки Na та ін. фторидів як буферні добавки. Для підвищення електричної провідності в розчин уводять сульфат натрію або сульфат магнію. Сульфатні розчини мають високий катодний вихід по струму (90-100%).
Приклад електроліту для нікелювання:
нікелю сульфат............................140-200г/л
нікелю хлорид...............................30-40г/л
борна кислота...............................25-40г/л
натрію сульфат.............................60-80г/л
pН розчину....................................5,2-5,8
температура розчину...................20-55°С
катодна щільність струму............0,5-2А/дм2
Електроліти нікелювання дуже чуттєві до різних домішок, особливо таких металів як Zn, Pb, Cu, Fe. Тому розчини готують в окремих ємностях на дистильованій воді і зливають у ванну покриту хлорвінілом у наступній послідовності: H3BO3, NіSO4, NaCl, Na2SO4, доводять до pН ~2,5 розчином сірчаної кислоти. Після цього підвішують аноди і катоди з гофрованої листової сталі і проробляють електроліт при J=0,1-0,2А/дм2 і U=1В перебігом 24-48 годин. Очищають електроліт від органічних домішок, для чого доводять pН до 5 свіжоприготовленим карбонатом нікелю або розведеною (1:10) луг, але ні в якому разі не аміаком; додають перманганат калію (0,25г/л) або перекис водню (2-3г/л) і ретельно домішують розчин у плині 30-60хв, додають у розчин ретельно роздрібнене активоване вугілля, попередньо оброблене розведеною (1:5) сірчаною кислотою 3г/л і перемішують розчин протягом 6-12год при кімнатній температурі, після чого фільтрують.
У випадку блискучого нікелювання в розчин уводять блискоутворювачі.
Приклад електроліту для блискучого нікелювання:
нікелю сульфат...............................120-170г/л
натрію хлорид.................................10-15г/л
борна кислота..................................20-30г/л
1,5 нафталиндисульфокислота......1-2г/л
рН електроліту..................................4,8-5,5
температура....................................20-40°С
напруга.............................................8-12В
катодна щільність струму...............0,5-1,2А/дм2
Велике поширення одержали фторборатні електроліти для нікелювання, що мають 100%-й вихід по струму, осадження ведеться при великій щільності струму, а значить з великою швидкістю.
Приклад фторборатного електроліту:
фторборат нікелю Nі(BF4)2........300-400г/л
хлорид нікелю NіCl2....................10-15г/л
борна кислота H3BO3..................10-15г/л
рН..................................................3,0-3,5
температура.................................10-20°С
катодна щільність струму............45-55А/дм2
Цей електроліт можна використовувати як для осадження в стаціонарних ваннах так і в дзвонах. Крім осадження чистого нікелю можна осаджувати сплави Nі з Tі, Re, Іn.
Лекція 24. Кобальтування і залізнення.
24.1. Гальванічне кобальтування.
Кобальт (Co) - метал сріблисто-білого кольору з червонуватим відтінком, валентність 2-3, атомна маса 58,9, ρ=8,83г/см3, tпл=1495°С, φоCo=-0,28В стосовно 2-х валентних іонів, φоCo=+0,28В стосовно 3-х валентних. Він стійкий у лужних розчинах, але розчиняється в розведених кислотах.
Кобальтове покриття використовується для підвищення корозійної стійкості виробів, що працюють у газовому середовищі, що містить сірку, а також як жаростійке покриття при роботі 800-900°С. Для осадження кобальту використовують сульфатні, хлоридні, фторборатні і сульфоматні електроліти.
Сульфатний електроліт для кобальтування:
кобальту сульфат...........300г/л
натрію хлорид.................20г/л
борна кислота.................40г/л
рН.....................................5-6
температура....................40°С
катодна щільність......до 15А/дм2
вихід по струму................95%.
Більш широко застосовуються сплави Nі-Co так як потенціали осадження цих металів дуже близькі. Сплави використовують для захисно-декоративних цілей, одержання покрить з певними магнітними властивостями, виготовлення матриць, застосовуваних для пресування пластмас.
Приклад складу електроліту для осадження Nі-Co:
сульфат нікелю........................200г/л
сульфат кобальту....................30г/л
хлорид натрію..........................16г/л
борна кислота..........................25г/л
рН...............................................5-5,6
температура............................17-27°С
катодна щільність струму......до 3А/дм2
24.2. Залізнення.
Залізо (Fe) - метал світло-сірого кольору, атомна маса 55,85, ρ=7,7г/см3, tпл=1539°С, валентність 2-3, φоFe=-0,44В стосовно 2-х валентних іонів і φоFe=-0,03В стосовно 3-х валентних. На катоді осаджується залізо чистотою 99,9%Fe, у виді домішок C, S, P і до 0,1%Н2.
Корозійна стійкість електролітичного заліза вище чим металургійного, але воно все-таки окисляється і тому його не використовують як захисне або декоративне. Залізнення використовується як підшар при нанесенні гальванічних покрить на чавун, але особливо часто його наносять з метою відновлення розмірів зношених деталей.
У порівнянні з хромуванням залізнення дозволяє одержувати великі швидкості осадження, знижується витрата електроенергії, низька вартість матеріалів, гарна здатність електролітів розсіюватися. У порівнянні з металізацією - велика чіпкість покрить з основою, ощадлива витрата матеріалу, у порівнянні з наплавленням - відсутність короблення деталей, можливість одночасного відновлення багатьох деталей.
Залізні покриття характеризуються наступними властивостями:
1. Мікротвердість від HB150 до HRC50-52;
2. Швидкість нанесення покрить ~0,2мм/м на кожні 10А/дм2 щільності струму;
3. За один цикл, не виймаючи деталей з ванни для проміжної механічної обробки, можна нарощувати шар заліза товщиною до 3мм;
4. Зменшення циклічної міцності можливо лише при наявності великих, глибоких тріщин;
5. Зносостійкість порівнянна зі зносостійкістю загартованої сталі;
6. Дуже висока міцність зчеплення з основою;
7. Процес легко автоматизуємий.
Дуже розповсюджений електроліт для одержання твердих HRC50-52 покрить, має наступний склад:
сульфат заліза...........................280г/л
амінооцетна кислота.................10г/л
температура...............................17-27°С
катодна щільність струму....до 10А/дм2
вихід по струму...........................85%
Покриття виходять дзеркально-блискучі, але при t≥37°C якість покриття різко погіршується, а у випадку пасивування залізного анода можливе утворення ціаністого водню.
Для одержання залізних покрить з високими механічними властивостями використовують електроліти з органічними сульфокислотами. Наприклад, у метилсульфатном електроліті з концентрацією солі заліза 350г/л при рН=1,5-2,0, t=17-57°C, J=10-15А/дм2 покриття виходять дрібнозернистими з малими внутрішніми напруженнями і високою твердістю. Електроліти не агресивні, але дорогуваті.
Для відновлення зношених деталей широко використовують гарячі хлоридні електроліти.
Приклад:
хлорид заліза.................................450-500г/л
соляна кислота..............................12,5г/л
температура...................................57°С
катодна щільність струму.........до 12А/дм2
вихід по струму...............................90-95%.
Покриття щільні, світлі HRC ~40.
Катодна щільність струму істотно впливає на вихід лише до 10-15А/дм2, при більш високої щільності вихід по струму збільшується незначно. Здатність електроліту розсіюватись -гарна.
При використанні нерозчинних анодів відбувається нагромадження Fe3+, якість покриття погіршується через осадження гідроокису заліза. Тому треба застосовувати розчинні аноди.
Крім осадження чистого заліза можна осаджувати його сплави з Nі, а також Fe-Nі-Cr, а також у циркуляційному електроліті Fe-Zn.
Лекція 25. Гальванічне хромування.
25.1. Хромування.
Хром (Cr) - метал сріблисто-білого кольору із синюватим відтінком, атомна маса 52,01, валентність 2,3,6, tпл=1850-1900°С, питомий опір 15·10-8Ом·м. Хром відноситься до числа металів, які найбільше легко пасивуються.
Розрізняють три типи хромових гальванічних покрить: матове, молочні осади і блискуче.
Матові покриття володіють низькими фізико-механічними властивостями тому не мають практичного застосування. Блискучі покриття відрізняються високими значеннями твердості і зносостійкості. Молочні опади - найменш пористі і найбільш пластичні.
По функціональному призначенню хромові покриття підрозділяються на захисно-декоративні, корозійностійкі, зносостійкі, антифрикційні.
Захисно-декоративні покриття можуть бути трьох типів:
1. Блискучі, котрі наносяться по підшарі Cu і Nі та мають товщину 0,25-1мкм;
2. Матово-блискучі, котрі застосовуються для обробки інструмента, оптичної і т.д. Ці покриття часто одержують, додаючи відповідну шорсткість поверхні основного металу.
3. Чорні і кольорові, котрі наносяться з електролітів спеціального складу, чорні покриття застосовуються при виготовленні оптичних приладів, медичного інструмента і т.д.
Корозійностійкі покриття можуть бути одношаровими і багатошаровими. Перший вид покриття це покриття молочні, котрі не мають пір і повинні мати товщину не менш 20мкм. Двошарове корозійностійке покриття застосовують у тих випадках, коли необхідно сполучити властивості високої захисної здатності і зносостійкості покрить. Таке покриття має перший шар молочного хрому, а другий шар блискучого, що відрізняється високою твердістю і зносостійкістю. Товщина другого шару складає 30-50% від загальної товщини покриття.
Зносостійкі й антифрикційні покриття можуть бути щільними і пористими.
Щільні покриття (або звичайні - тверді, зносостійкі) використовуються для підвищення зносостійкості знову виготовлених деталей і для відновлення деталей, що були в експлуатації. При цьому варто враховувати, що області одержання найбільш зносостійких покрить не збігаються.
Товщина
зносостійких покрить - 3-20мкм  -
для міряльного і різального інструмента
для міряльного і різального інструмента,
до 50-60мкм при нанесенні на матриці,
прес-форми, вали і деталі різних машин.
При відновленні зношених деталей товщина
покриття може досягати 0,2-0,5мм.
-
для міряльного і різального інструмента
для міряльного і різального інструмента,
до 50-60мкм при нанесенні на матриці,
прес-форми, вали і деталі різних машин.
При відновленні зношених деталей товщина
покриття може досягати 0,2-0,5мм.
Пористі покриття володіють високими антифрикційними властивостями і зносостійкістю, застосовуються для нанесення на гільзи циліндрів двигунів внутрішнього згоряння, поршневі кільця і деякі ін. деталі. Товщина пористого хрому на нових деталях 0,04-0,07мм, на відновлених гільзах циліндрів 0,1-0,3.
25.2. Особливості підготовки поверхні перед хромуванням.
Хромування вимагає ретельної обробки поверхні. При шліфуванні неприпустимі дефекти поверхні. Якщо в процесі шліфування виникають прожоги або шліфувальні тріщини, то хромове покриття відшаровується в місцях прижогів або взагалі не осаджується, а при наявності тріщин викликає різке зниження міцності і навіть руйнування деталі.
Анодне травлення (активування) проводять у спеціальній ванні, що містить такий же електроліт, що і для гальванічних покрить. Сполучати процес активування і хромування в одній ванні не бажано, тому що при травленні ванна швидко забруднюється залізом, а травильна ванна нагрівається до 50°С, що часто перевищує температуру осадження хрому.
Перед активуванням деталі витримують ~1,5хв в електроліті для прогріву без струму. Тривалість активації залежить від виду матеріалу, що покривається, і в деякій мері від товщини покриття, що наноситься
( табл. 25.1).
Таблиця 25.1
Сталь |
Товщина хромового покриття, мм |
Тривалість, с |
1. Низьковуглецева |
0,025 0,15 |
100-120 150-200 |
2. Високоуглецева |
0,025 0,15 |
60-100 120-150 |
3. Легована |
0,025 0,15 |
40-60 60-100 |
4. Високолегована |
0,025 0,15 |
30-40 10-15 |
5. Хромонікелеві сплави |
0,025 0,15 |
10-15 20-40 |
При хромуванні чавуна активування або взагалі не проводиться, або проводиться кілька секунд.
При осадженні Cr на мідь і її сплави активування взагалі не проводиться, мідь і її сплави активно розчиняються в хромовому електроліті, тому нанесення на них хрому проводять, завантажуючи у ванну під струмом.
25.3. Умови електролітичного осадження Cr.
Електроліт для осадження Cr складається з хромового ангідриду Cr3, водний розчин якого являє собою сильну хромову кислоту - H2Cr4. Електроліз здійснюється з нерозчинними анодами, що виготовляють зі свинцю або сплаву свинцю із сурмою (5-6%Sb), що володіють підвищеною хімічною стійкістю в електроліті. Застосування у якості розчинного аноду чистого хрому недоцільно. По-перше, хромові іони переходять у розчин з різною валентністю, що утрудняє роботу ванни, по-друге, у цьому випадку анодний вихід по струму в 6-8 разів вище катодного, а це приводить до нагромадження іонів хрому в електроліті.
Осадження хрому тільки з хромової кислоти неможливо так як в цьому випадку на поверхні катода утвориться щільна плівка основних хромовокислих з'єднань, що перешкоджають відкладенню хрому на катоді [Cr(OH)2]. Додавання в розчин сірчаної кислоти викликає розпушення плівки Cr(OH)2 і полегшує осадження Cr. Хромового ангідриду по вазі в електроліті повинне утримуватися в 100 разів більше чим сірчаної кислоти. Процес хромування відрізняється надзвичайно низьким виходом по струму (8-16%). Основна частина електроенергії витрачається на побічні процеси, такі як: електроліз води, що супроводжується виділенням H2 на катоді і O2 на аноді, відновлення 6-ти валентного хрому до 3-х валентного на катоді Cr6+ + 3ē → Cr3+ і зворотне окислювання 3-х валентного хрому до 6-ти валентного на аноді.
Кількість Cr3 в електроліті може коливатися в широких межах без істотного вплив на якість покриття.
У гальванотехніці звичайно застосовують електроліти, що містять хромовий ангідрид у кількості 150-250г/л. Підвищення концентрації Cr3 підвищує електропровідність електроліту і знижує напруга на ванні і викликає зниження виходу по струму, а також зменшує здатність електроліту розсіюватись.
Процес хромування дуже залежить від t°С і J, А/дм2. Обидва ці фактора впливають також на структуру, властивості і зовнішній вигляд Cr-покриття.
Температура і щільність струму впливає на вихід по струму, що знижується при підвищенні температури і підвищується при підвищенні щільності струму. Тому в процесі хромування застосовують високі щільності струму (10-100А/дм2). Зменшення температури збільшує катодний вихід по струму, але одночасно збільшує крихкість осаду. Тому звичайно температуру електроліту не знижують менш 45°С. Температура і щільність струму впливають на твердість. Змінюючи режим можна одержувати покриття з твердістю від 500 до 1000кгс/мм2.
Лекція 26. Технологія нанесення хромових покрить.
26.1. Технологія захисно-декоративного хромування.
Захисно-декоративному хромуванню піддаються деталі зі сталі, міді, латуні, алюмінію.
Оскільки блискучий хром має високу пористість, то звичайно при декоративному хромуванні сталеві вироби попередньо покривають міддю і нікелем для підвищення їхньої корозійної стійкості.
При цьому використовують одну зі схем:
1) Мідь, осаджена в ціаністому електроліті + мідь, осаджена в кислому електроліті + нікель + хром.
2) Нікель + мідь (у кислому електроліті) + нікель +хром.
Блискучі покриття хрому можуть бути отримані без добавки блискоутворювача прямо з ванни, але при ретельному поліруванні поверхні перед нанесенням покриття, а якщо осаджено Nі або Cu, то їхнє ретельне полірування, тому що матове покриття Cr погано полірується.
Для готування електроліту розрахункова кількість CrО3 завантажують у ванну і заливають водою t=60-80°C. Розчин ретельно перемішують, додають H2SO4, і проробляю ванну при J=6-8А/год протягом 3-4 годин. Це дозволяє нагромадити в електроліті необхідну кількість 3-х валентного хрому (2-4г/л), що сприятливо позначається на осадженні Cr. Пророблення проводять при t=40-60°C з випадковим катодом, площа якого повинна бути в 2-3 рази більше площі анода. Після цього електроліт готовий до роботи. У процесі роботи кількість Cr3+ збільшується якщо площа катода більше площі анода і навпаки. Значне нагромадження Cr3+ в електроліті звужує межі, у яких виходять блискучі покриття. Для підтримки Cr3+ у нормальних межах варто підтримувати співвідношення між катодною й анодною поверхнями від 1:1 до 1:2. У випадку значного нагромадження Cr3+ виробляється пророблення ванни в умовах, коли площа анодів у кілька разів більше площі катодів. Так як Cr3 виробляється, його необхідно періодично додавати у ванну. Також коректують зміст H2SO4. Якщо необхідно видалити надлишок H2SO4 у розчин додають BaCO3 з розрахунку 2г на 1г кислоти, що видаляється.
Кожні 10 днів проводять аналіз на зміст Cr6+ і Cr3+. У ванну кожні 2-3 години додають воду.
Для осадження блискучого Cr у захисно-декоративних цілях застосують наступний електроліт:
хромовий ангідрид CrО3 ................ 250г/л
сірчана кислота H2SO4 ................. 2,5г/л
катодна щільність струму ............. 10-25А/дм2
температура .................................. 45-55°С.
Для збільшення здатності розсіюватися, додають H3BO3 (10-15г/л).
Для одержання блискучих і світлих опадів хрому при низькій температурі в електроліт уводять фтористі солі амонію і натрію.
Приклад:
хромовий ангідрид .................... 150г/л
сірчана кислота ......................... 0,6г/л
фтористий натрій ....................... 10г/л
температура ............................... 18-25°С
катодна щільність струму .......... 5-10А/дм2
вихід по струму .......................... 10-16%.
Однак ці електроліти досить хитливі, тому через кожні А-г/л необхідно коректувати електроліт по фтористому натрію.
Чорне хромування проводиться для декоративної обробки.
В електролітах для чорного хромування не допускається наявність сульфатів, що у випадку їхньої присутності повинні бути вилучені за допомогою барію.
Склад електроліту для чорного хромування:
хромовий ангідрид ..................... 250г/л
азотнокислий натрій .................. 5г/л
температура............................... 20°С
катодна щільність струму ......... 50А/дм2
Виробу, покриті чорним хромом після промивання у воді і сушінні, просочуються олією.
У випадку нанесення двошарового корозійно-декоративного покриття молочний хром - блискучий хром. Перше покриття осаджують при t=70°C і J=30А/дм2, а потім деталь переносять, не промиваючи, у другу ванну, де осаджується блискучий хром при t=50°C і щільності струму 30-50А/дм2.
26.2. Технологія зносостійкого хромування.
При зносостійкому хромуванні товщина хрому в десятки і сотні разів більше, ніж декоративному, а підшар міді і нікелю в цьому випадку не застосовується.
Варто мати через, що стали з високим змістом вольфраму і кобальту, а також високовуглецеві і висококременисті чавуни не можна покривати хромом, тому що при цьому не забезпечується гарне зчеплення основи і покриття.
Товщина хрому при зносостійкому хромуванні коливається від 0,03 до 1мм.
Тому що електроліти володіють малою здатністю розсіватися, і опади виходять нерівномірними, застосовують додаткові катоди, екрани, що не проводять струм, аноди спеціальної форми і т.д. Глибина занурення анода і катода в електроліт повинна бути однакова. Контакти деталі з катодною штангою і з деталлю повинні бути гарними. При роботі підвіски не повинні нагріватися.
Тому що розведені електроліти дають більший вихід по струму, то електроліт має наступний склад:
CrО3 ........................................... 100-180г/л
H2SO4 ......................................... 1,0-1,8г/л
температура .............................. 551°С
катодна щільність струму ......... 50-60А/дм2
Антифрикційне хромування полягає в спеціальній додатковій обробці поверхні виробу з метою створення на ній великого числа пір і каналів, що потім служать масляними кишенями. Пористе хромування широке використовується для циліндрів і поршневих кілець двигунів.
Одержують пори шляхом анодного травлення осілого шару блискучого хрому, що має сітку найтонших тріщин. При цьому розчинення хрому відбувається головним чином по границях тріщин, унаслідок чого вони розширюються. Ступінь пористості визначається відношенням площі, зайнятої каналами або порами, до всієї площі покриття.
На характер сітки каналів впливають відносини CrО3:H2SO4, катодна щільність струму і температура електроліту. При зменшенні величини співвідношення CrО3:H2SO4 сітка каналів пористого хрому стає густіше, а ширина їх збільшується. Це співвідношення CrО3:H2SO4 рекомендується підтримувати (105-110):1. Зменшення катодної щільності викликає утворення більш густої сітки каналів при одночасному зменшенні їхньої ширини і глибини. Оптимальна величина щільності струму лежить у переділах 40-60А/дм2.
Запитання до теми „Електролізний метод нанесення покрить
Закони електролізу Фарадея.
Що таке вихід по струму?
Розсіювальна здатність електроліту.
Види блискоутворювачів.
