
Министерство образования и науки, молодёжи и спорта Украины
ОДЕССКАЯ НАЦИОНАЛЬНАЯ МОРСКАЯ АКАДЕМИЯ
Кафедра физики и химии
Лабораторная работа № 2.4
Исследование зависимости давления насыщенного пара от температуры и вычисление молярной теплоты испарения
(Указания к лабораторной работе)
Составил доц. Шакун К.С.
Утверждено на заседании кафедры 29 сентября 2011 г., протокол № 2
Одесса – 2011
1. Теоретическая часть
Вещество может находиться в различных агрегатных состояниях (твердом, жидком, газообразном). В пределах одного агрегатного состояния вещество может находиться в нескольких фазах, отличающихся по своим свойствам, составу и строению. Фазой называется часть равновесной термодинамической системы, однородной по свойствам и отделенной границами раздела от других частей термодинамической системы.
Переход вещества из одной фазы в другую – фазовый переход. Фазовый переход всегда связан с качественными изменениями свойств вещества (с изменениями в составе, строении и свойствах вещества). Различают фазовые переходы двух родов. Фазовые переходы первого рода – превращения, сопровождающиеся поглощением или выделением определенного количества теплоты, называемой теплотой фазового перехода. Например: 1) плавление и кристаллизация, 2) испарения и конденсация, 3) возгонка и конденсация, 4) перекристаллизация (из одной модификации в другую). Фазовые перехода характеризуются постоянством температуры и давления, скачкообразным изменением внутренней энергии и плотности, изменением удельного объема, изменением энтропии и объема, изменением характера упаковки частиц.
Так, процесс испарения определенной массы жидкости осуществляется при постоянной температуре и постоянном давлении, равном давлению насыщенных паров при данной температуре. Чтобы испарение происходило при T=const, надо подводить тепло. Обратный переход пара в жидкость сопровождается выделением того же количества теплоты.
При испарении жидкости и конденсации пара зависимость между давлением и температурой фазового перехода представляет собой зависимость давления насыщенного пара от температуры и изображается кривой равновесия жидкости – пара на рис. 1 и формулой (1).
Рис. 1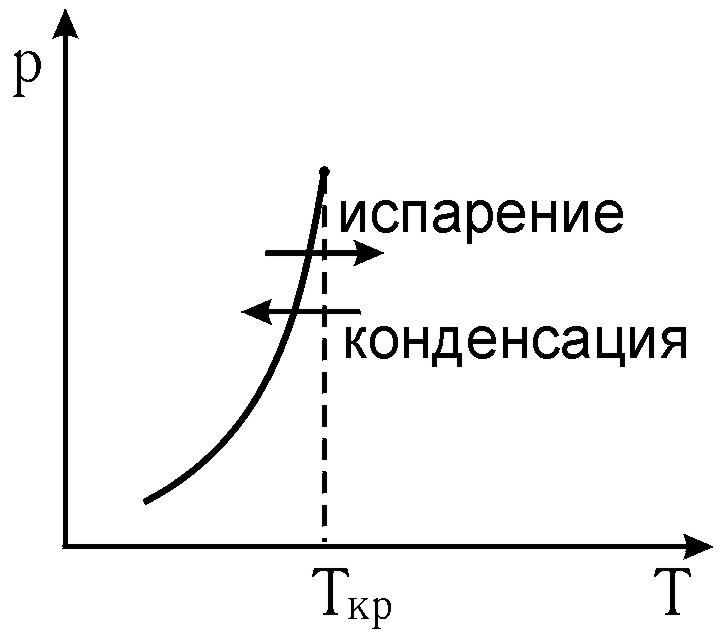
-
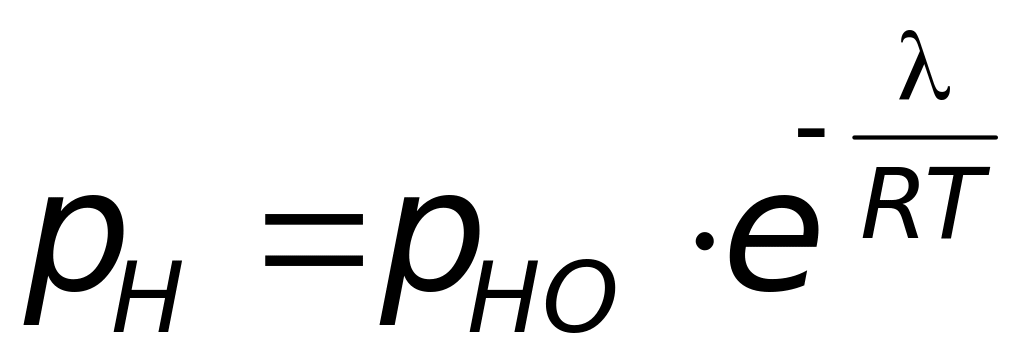 ,
,(1)
где
–
молярная теплота испарения жидкости,
численно равная количеству теплоты,
необходимому для превращения одного
моля жидкости в пар при данной температуре,
R=8,31![]() –
газовая постоянная, Tкр –
критическая температура вещества.
–
газовая постоянная, Tкр –
критическая температура вещества.
Рассмотрим опытные и теоретические
кривые равновесия жидкости-пара
(изотермы на диаграммах (p,V).
На рис. 2 представлены опытные изотермы,
полученные для углекислого газа CO2
при температуре T=283 K.
При больших объемах V
давление p
углекислого газа возрастает монотонно
с уменьшением объема, такому изотермическому
сжатию соответствует ветвь ON
кривой. Здесь свойства углекислоты
аналогичны свойствам идеального газа.
При достижении же некоторого определенного
давления pH,
которому соответствует объем
![]() (N – точка изотермы),
поведение углекислоты резко меняется.
При дальнейшем уменьшении объема
давление остается постоянным, так как
часть газообразной углекислоты переходит
в жидкое состояние. Идет процесс
конденсации углекислоты. Чем меньше
будет объем, тем большее количество
газа переходит в жидкость. При давлении
pH
газ может иметь любые объемы, заключенные
между
и
(N – точка изотермы),
поведение углекислоты резко меняется.
При дальнейшем уменьшении объема
давление остается постоянным, так как
часть газообразной углекислоты переходит
в жидкое состояние. Идет процесс
конденсации углекислоты. Чем меньше
будет объем, тем большее количество
газа переходит в жидкость. При давлении
pH
газ может иметь любые объемы, заключенные
между
и
![]() .
В этой области вещество одновременно
существует в виде двух агрегатных
состояний (газ, жидкость). При постоянном
V0
количество газа и жидкости с течением
времени не изменяется. Это означает,
что число молекул, переходящих из пара
в жидкость будет равно числу молекул,
удаляющихся из жидкости в пар. Пар,
находящийся в состоянии динамического
равновесия со своей жидкостью, называется
насыщенным паром. Давление насыщенного
пара возрастает с повышением температуры
по формуле (1).
.
В этой области вещество одновременно
существует в виде двух агрегатных
состояний (газ, жидкость). При постоянном
V0
количество газа и жидкости с течением
времени не изменяется. Это означает,
что число молекул, переходящих из пара
в жидкость будет равно числу молекул,
удаляющихся из жидкости в пар. Пар,
находящийся в состоянии динамического
равновесия со своей жидкостью, называется
насыщенным паром. Давление насыщенного
пара возрастает с повышением температуры
по формуле (1).
Рис. 2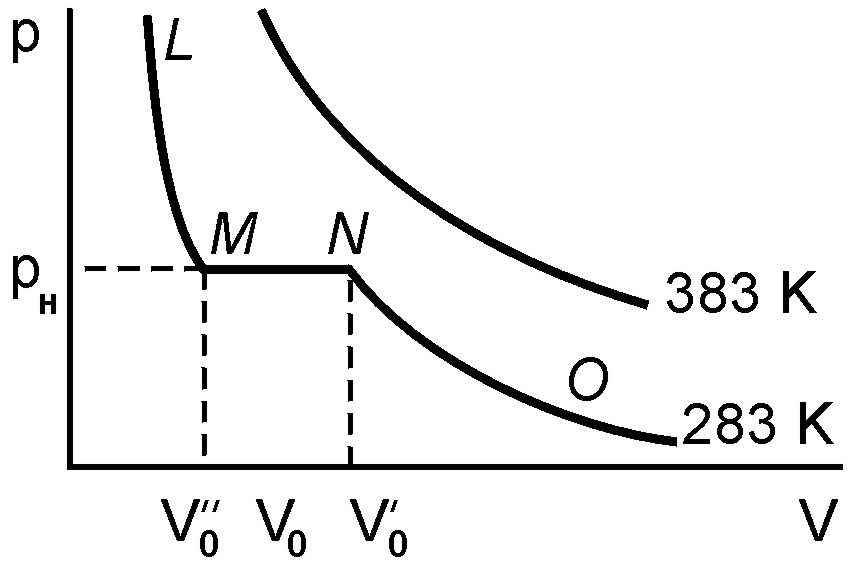
При высоких температурах Т=373 К изотерма углекислого газа (рис. 2) напоминает изотермы идеального газа. Сжатие углекислого газа при высоких температурах не переводит его в жидкое состояние.
Сравним экспериментальные изотермы с теоретическими изотермами идеального и реального газов.
Идеальным газом называется воображаемый газ, который удовлетворяет двум условиям: 1) размеры молекул настолько малы, что их можно принять за материальные точки; 2) молекулы газа не взаимодействуют друг с другом, за исключением момента непосредственного столкновения, когда они взаимодействуют как абсолютно упругие шары, природа сил отталкивания электрическая.
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) имеет вид
-
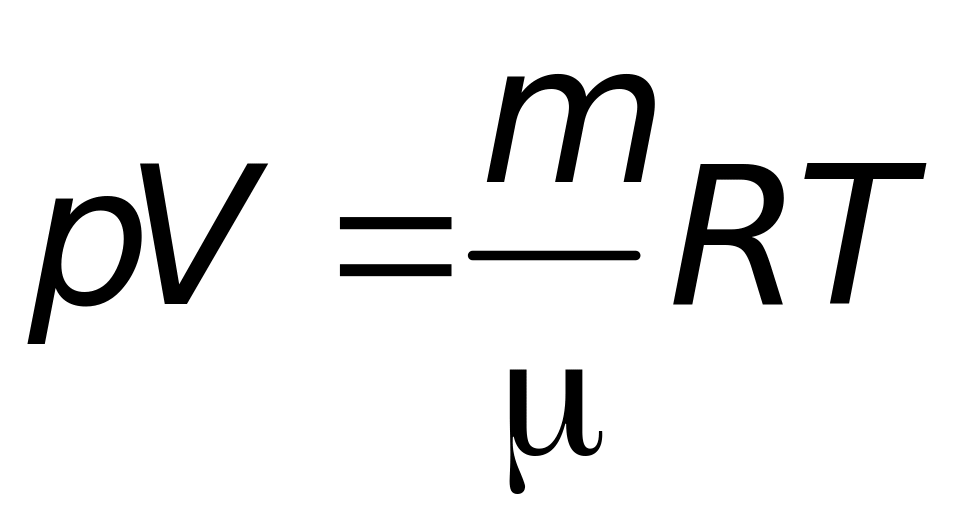 ,
,(2)
где р – давление газа; V – объем газа; m – масса газа; – молярная масса; Т – абсолютная температура; R – универсальная газовая постоянная.
Изотермы идеального газа описываются уравнением
-
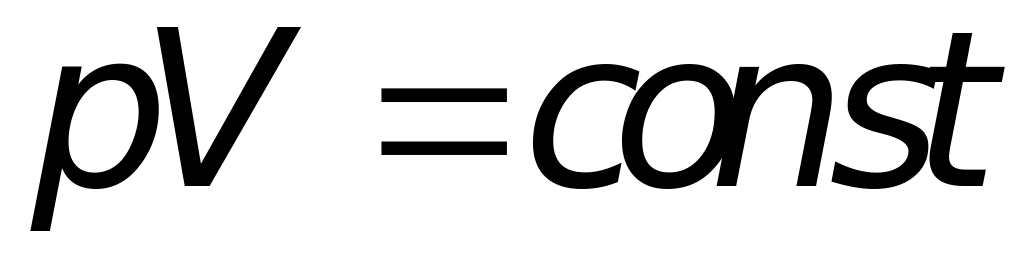 ,
,(3)
а вид их представлен на рис. 3.
Рис. 3.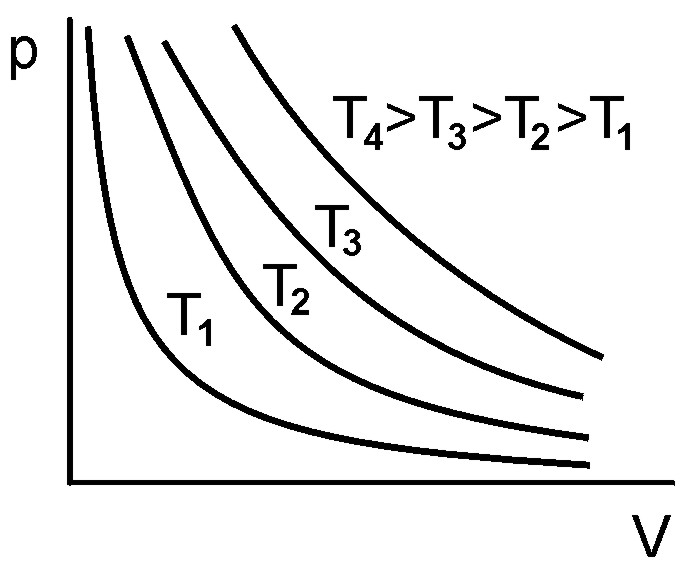
Для описания поведения реальных газов в широком интервале плотностей и температур используют уравнение Ван-дер-Ваальса
-
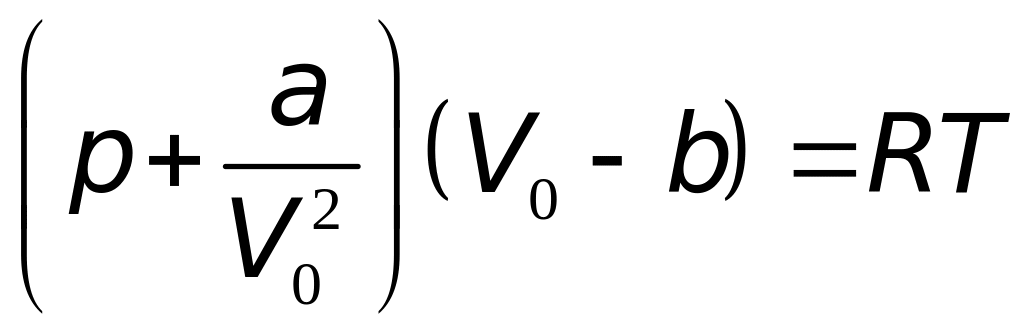 ,
,(4)
где V0 – объем одного моля газа; a и b – константы Ван-дер-Ваальса, имеющие для различных газов различные значения.
Силы
притяжения между молекулами реального
газа приводят к возникновению добавочного
внутреннего давления
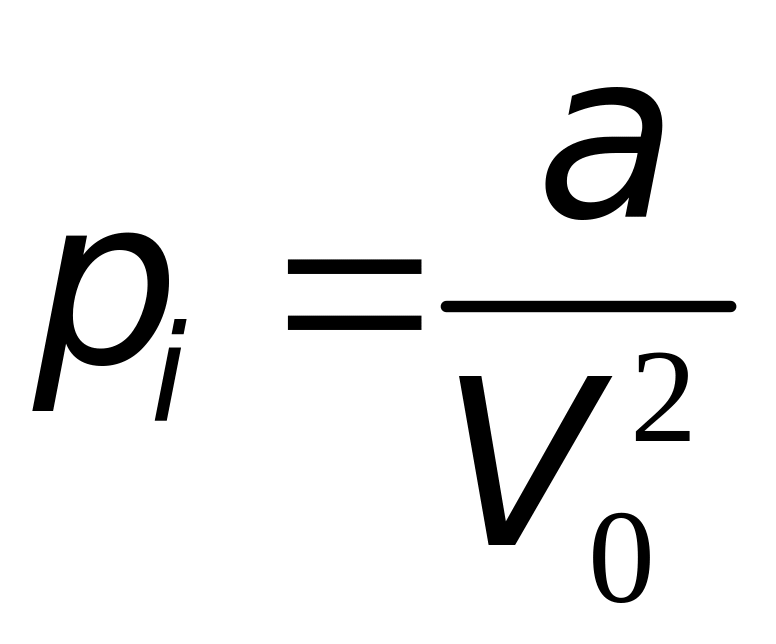 .
Полное давление, под которым находится
реальный газ в сосуде, равно (р+рi).
.
Полное давление, под которым находится
реальный газ в сосуде, равно (р+рi).
Константа b учитывает действие сил отталкивания между молекулами и равна учетверенному собственному объему молекул в одном киломоле газа. Поэтому объем, доступный для движения молекул, меньше геометрического объема сосуда V0 на некоторую величину b и равен (V0-b).
Уравнение (4) – уравнение третьей степени относительно V0 и имеет три корня V01, V02, V03, которые могут быть либо все вещественными, либо один из корней – вещественным, а два – комплексно сопряженными. Нас интересуют лишь положительные вещественные корни, так как мнимые и отрицательные корни не имеют физического смысла. На рис. 4 представлены теоретические изотермы Ван-дер-Ваальса для реальных газов p=f(V) при различных температурах (Т=const). При высоких температурах изотермы реального газа мало отличаются от изотерм идеального газа (рис. 3), и уравнение Ван-дер-Ваальса имеет лишь один вещественный корень при любых давлениях. С понижением температуры теоретические изотермы реального газа все больше отклоняются от гиперболической зависимости и при достаточно низких температурах Т1, на изотермах появляется "завиток", углубляющийся по мере понижения температуры. В области "завитка" каждой такой изотермы одному значению р1 соответствует уже три вещественных значения V01, V02, V03.
Рис. 4.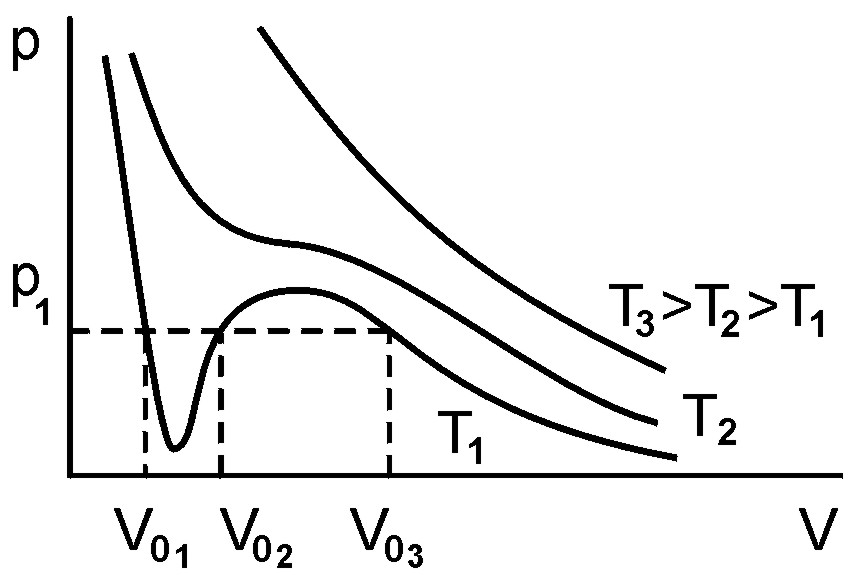
Так участок изотермы Na, попадающий в область горба "завитка", изображает состояния пересыщенных паров. Пересыщенный (переохлажденный) пар – это такой пар, который можно получить при отсутствии центров конденсации (пылинок, электрических зарядов) под давлением р, большим упругости насыщенных паров рн при данной температуре (рис. 5).
Рис. 5.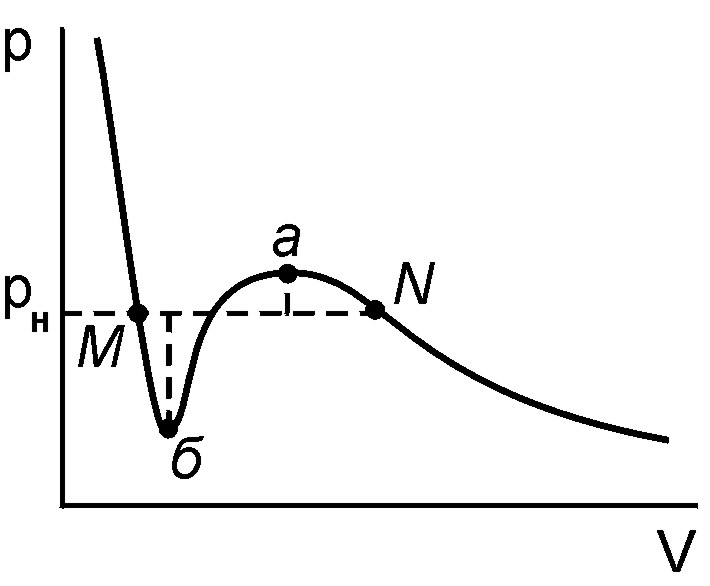
Жидкое состояние веществ также можно сохранить под давлением, меньшим упругости насыщенных паров при данной температуре, без перехода его в парообразное. Для очистки жидкости от центров конденсации жидкость фильтруют и кипятят, удаляя растворенные в ней газы. На рис. 5 это состояние описывается участком Мб впадины "завитка" изотермы Ван-дер-Ваальса. Вещество в этом состоянии называется перегретой жидкостью.
Состояния пересыщенного пара и перегретой жидкости являются малоустойчивыми состояниями по сравнению с двухфазным состоянием прямолинейного участка и носят названия метастабильных состояний.
При низких температурах парообразование будет происходить лишь с поверхности жидкости, причем скорость испарения будет расти с повышением температуры. Если нагревать жидкость до температуры, при которой давление ее насыщенных паров станет равно внешнему давлению, то парообразование жидкости начинается по всему объему. Внутри жидкости образуются пузыри газа с паром, которые уже смогут всплывать, не раздавливаясь внутри жидкости, – пар будет выходить из жидкости. Такой процесс парообразования, связанный с возникновением пара во всей массе жидкости, называется кипением. Условие кипения жидкости – равенство давления насыщенного пара в пузырьках внешнему давлению.
