
- •Глава I. Состав и свойства крови. Эритроциты
- •Раздел I. Состав и свойства крови
- •I. 1. Гематокрит
- •Гематокрит – это часть объема крови, приходящаяся на долю форменных элементов и клеток крови, в основном эритроцитов.
- •Гематокрит (Ht)
- •I. 2. Функции крови
- •Компоненты плазмы крови и их функции
- •Функции воды плазмы крови
- •I. 3. Функции минеральных веществ плазмы крови
- •Осмолярность – число молей вещества в 1 литре раствора.
- •Ронк 25–30 мм рт. Ст.
- •I. 4. Функции белков плазмы крови
- •Вязкость крови
- •Вязкость – свойство компонентов крови оказывать сопротивление при перемещении их относительно друг друга.
- •Раздел II. Структурно-функциональные
- •Заряд мембраны
- •Проницаемость мембраны.
- •Деформируемость эритроцита
- •Количество
- •Срок жизни
- •Где разрушаются эритроциты
- •Где рождаются и как развиваются эритроциты
- •О ретикулоцитах
- •Регуляция эритропоэза
- •Вещества, необходимые для синтеза эритроцитов
- •Особенности метаболизма
- •II. 2. Гемоглобин
- •Нормальные типы гемоглобина
- •Соединения гемоглобина
- •Регуляция сродства гемоглобина к кислороду
- •Содержание гемоглобина в крови
- •О гликозилированном гемоглобине
- •II. 3. Индексы эритроцитов
- •II. 4. Скорость оседания эритроцитов (соэ)
Особенности метаболизма
Энергия, необходимая для жизнедеятельности эритроцитов, образуется в процессе анаэробного гликолиза. Это связано с тем, что эритроцит доставляет О2 к тканям и не расходует его на собственные нужды.
II. 2. Гемоглобин
Дыхательная функция эритроцитов обусловлена белком цитоплазмы эритроцитов гемоглобином. В каждом эритроците содержатся сотни тысяч молекул гемоглобина.
Гемоглобин – это сложный белок, состоящий из белка глобина и небелковой (простетической) части – гема.
Глобин состоит из 4-х полипептидных цепей, организованных в четвертичную структуру. Гем содержит четыре молекулы пиррола, образующих кольцевую структуру. В центре пиррольного кольца находится атом железа – Fe2+ (рис. II-4).
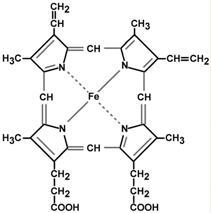
Рис. II-4. Строение гема
В молекуле гемоглобина каждая из четырех полипептидных субъединиц содержит гем. Гем расположен в специальных карманах, сформированных складками полипептидных цепей глобина (рис. II-5).
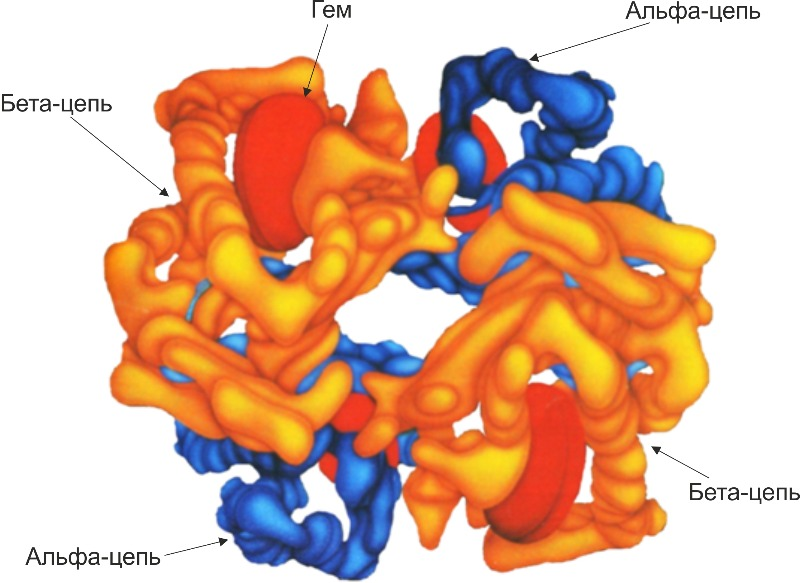
Рис. II-5. Строение гемоглобина
Нормальные типы гемоглобина
В различных типах гемоглобина содержатся две полипептидные цепи a и две цепи какого-либо другого типа (известны несколько типов полипептидных цепей гемоглобина – a, b, g, S и др.).
В соответствии с типом полипептидных цепей,
формирующих глобин, различают:


гемоглобин А и гемоглобин F
Гемоглобин А – гемоглобин взрослых (от англ. adult – взрослый), содержит две цепи a и две b (a2b2).
Гемоглобин F – гемоглобин плода (от лат. fetus – плод), содержит две цепи a и две g (a2g2).
Нb F (фетальный) синтезируется у плода в процессе кроветворения в желточном мешке, печени, селезенке на 1-30 неделях внутриутробного развития. При рождении ребенка в течение первых месяцев жизни происходит замещение Нb F на Hb A. К 6 месяцам в эритроцитах ребенка сохраняется менее 1 % Нb F.
Нb А продуцируется с 30-й недели внутриутробного развития, а далее всю жизнь в костном мозге.
Соединения гемоглобина
1. В капиллярах малого круга гемоглобин обратимо связывается с кислородом, поступающим в плазму крови, а затем в эритроцит из легких. Одна молекула гемоглобина связывает четыре молекулы О2. В образовавшемся соединении – оксигемоглобине (НbО2) – каждая молекула кислорода ковалентно связывается с атомом Fe2+ гема.
Эритроциты транспортируют кислород к тканям.
В капиллярах большого круга (в тканях) происходит дезоксигенация гемоглобина: кислород поступает в ткани. Гемоглобин, от которого отсоединились молекулы кислорода, называется дезоксигемоглобином (Нb):
 Нb
+ О2
НbО2
Нb
+ О2
НbО2
2. В капиллярах большого круга дезоксигемоглобин связывается с двуокисью углерода (СО2 образуется в тканях и диффундирует в кровь). Соединение СО2 с гемоглобином называется карбогемоглобином (НbСО2). В отличие от О2, связывающегося с Fe2+ гема, СО2 образует связь с N-группами аминокислот глобина.
 Нb
+ СО2
НbСО2
Нb
+ СО2
НbСО2
Чем больше молекул О2 связывается с гемоглобином, тем меньше его сродство к СО2 и наоборот. Подобная взаимосвязь между степенью оксигенации гемоглобина и способностью удерживать двуокись углерода позволяет одновременно насыщать гемоглобин кислородом и отдавать СО2 легким.
3. При вдыхании угарного газа образуется карбоксигемоглобин (НbСО).
Нb + СО → НbСО
СО, как и О2, связывается с Fe2+ гема, причем связь СО с гемом в 200 раз прочнее, чем кислорода. В связи с этим вдыхание даже небольших доз СО лишает кислород возможности соединяться с гемом, что приводит к тяжелым последствиям, вплоть до летального исхода.
4. При попадании в кровь сильных окислителей происходит изменение степени окисления железа гема: Fe2+ трансформируется в Fe3+. Изменение степени окисления железа гема делает невозможным осуществление дыхательной функции гемоглобина (и эритроцита), в связи с тем, что только Fe2+ способно обратимо связывать и отдавать кислород. Гемоглобин, в состав которого входит Fe3+, называется метгемоглобином.
