
- •Раздел 7. Электрохимические методы анализа
- •7.1 Лабораторная работа № 1 Определение свинца методом инверсионной вольтамперометрии
- •7.2 Лабораторная работа № 2 Определение цинка, кадмия, свинца и меди при их совместном присутствии методом инверсионной вольтамперометрии
- •7.3 Лабораторная работа № 3 Определение меди методом потенциометрии
- •7.4 Лабораторная работа № 4 Определение нитратов в растительном сырье и продуктах его переработки методом потенциометрии
- •7.5 Лабораторная работа № 5 Определение гидроксида натрия в растворе каустической соды методом потенциометрии
- •7.6 Лабораторная работа № 6 Определение сложных эфиров в этаноле методом потенциометрии
- •7.7 Лабораторная работа № 7 Определение щелочности мучных кондитерских изделий методом потенциометрии
- •7.8 Лабораторная работа № 8 Определение свободных жирных кислот в мясе методом потенциометрии
- •7.9 Лабораторная работа № 9 Определение дихроматной (бихроматной) окисляемости воды методом потенциометрии
- •7.10 Лабораторная работа № 10 Определение витамина с во фруктах, ягодах и продуктах их переработки методом потенциометрии
- •7.11 Лабораторная работа № 11 Определение активного хлора в дезинфицирующем средстве методом кондуктометрии
- •7.12 Лабораторная работа № 12 Определение общей жесткости воды методом кондуктометрии
- •7.13 Лабораторная работа № 13 Определение лимонной кислоты во фруктово-ягодном сырье методом кондуктометрии
- •Справочные данные по содержанию лимонной кислоты
- •7.14 Вопросы для самостоятельной работы
- •Приложение а Правила выполнения измерений при помощи весов
- •Приложение б Правила работы с микроволной установкой пробоподготовки мс-6
- •Приложение в Правила работы с сушильным шкафом snol 58/350
- •Приложение г Правила работы с муфельной печью snol 7,2/1100
- •Приложение д Правила выполнения измерений на анализаторе инверсионном вольтамперометрическом ава–1
- •Приложение е Правила выполнения измерений на иономере и–160 м
- •Приложение ж Правила выполнения измерений на рН-метре рН–150
- •Приложение и Правила выполнения измерений на кондуктометре ……….
- •Приложение к Процедура проверки вместимости мерной посуды
- •Приложениел Правила оформления лабораторного журнала
- •Форма таблицы для занесения промежуточных данных и результатов
7.12 Лабораторная работа № 12 Определение общей жесткости воды методом кондуктометрии
Жёсткость воды – совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым содержанием – мягкой. Различают временную жёсткость (карбонатную), образованную гидрокарбонатами и постоянную жёсткость (некарбонатную), вызванную присутствием других солей. Временная жёсткость обусловлена присутствием в воде гидрокарбонатов кальция и магния (Са(НСО3)2; Mg(НСО3)2). Постоянная жесткость воды обусловлена присутствием в воде сульфатов, хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость.
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации – моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости чаще используется миллимоль на дм3 (ммоль/дм3).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности. В разных странах использовались (и используются до сих пор) различные внесистемные единицы измерения жесткости, например градусы.
В соответствии с установленными в [16] гигиеническими требованиями жесткость питьевой воды не должна превышать 7,0 ммоль/дм3.
1 Метод измерений
Метод основан на регистрации электропроводности в процессе титрования ионов кальция и мания с комплексоном III в среде аммонийного буферного раствора (pH = 10).
Определению не мешают ионы Al3+, если их концентрация не превышает 20 мг/дм3, и ионы Fe3+ при концентрации не более 100 мг/дм3.
2 Средства измерений
Бюретка вместимостью 25 см3;
Кондуктометр …..;
Пипетки градуированные вместимостью 1 и 10 см3;
3 Вспомогательные материалы
Мешалка магнитная;
Стакан вместимостью 100 см3.
4 Материалы, реактивы и растворы
Аммонийный буферный раствор – pH = 10. ….Описать приготовление
Вода дистиллированная;
Комплексон III (2-водная динатриевая соль этилендиамин-N,N,N′,N′-тетрауксусной кислоты, комплексон III, хелатон III, Na-ЭДТА, Na-EDTA, C10H14O8N2Na2∙2H2O), раствор – 0,05 моль/дм3.
5 Подготовка к выполнению измерений
5.1 Подготовка средств измерений
Кондуктометр готовят к работе в соответствии с инструкцией по эксплуатации (Приложение И).
6 Порядок выполнения измерений
В стакан пипеткой вносят от 2 до10 см3 анализируемой воды (объем пробы зависит от предполагаемой жесткости воды), добавляют 0,5 см3 аммонийного буферного раствора и дистиллированную воду до объема 50 см3. Буферный раствор приливают после добавления некоторого количества воды, иначе в воде с высоким содержанием магния выпадает осадок (гидроксид магния).
Полученный раствор титруют раствором комплексона III при постоянном перемешивании. После добавления каждой порции титранта регистрируют значение электропроводности. Титрование заканчивают после резкого изменения значения электропроводности.
7 Обработка и вычисление результатов измерений
7.1 Построение кривой кондуктометрического титрования и определение КТТ
По полученным данным (см. п. 6) строят график в координатах . По графику находят КТТ и объем титранта, израсходованный на титрование.
7.2 Расчет величины общей жесткости
Общую жесткость воды (Ж, моль/дм3) рассчитывают по формуле
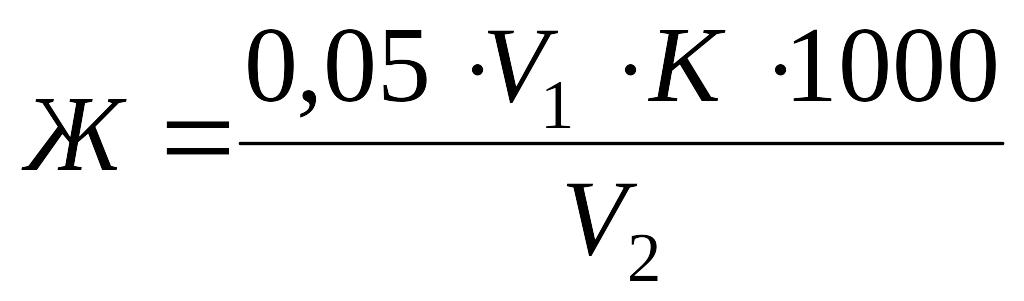 ,
,
где 0,05 – концентрация раствора комплексона III, моль/дм3; V1 – объем раствора комплексона III, израсходованный на титрование, см3; K – поправочный коэффициент для 0,05 моль/дм3 раствора комплексона III; 1000 – коэффициент пересчета результата на 1 дм3; V2 – объем взятой для анализа воды, см3.
Результаты вычислений округляют до двух значащих цифр после запятой. За окончательный результат измерения принимают среднее арифметическое результатов двух параллельных определений. Окончательный результат округляют до одной значащей цифры после запятой
8 Индивидуальное задание
Определить общую жесткость в пробах питьевой воды и сравнить полученный результат с гигиеническими требованиями[16].
