
- •Часть I
- •Ферменты – инструменты генетической инженерии
- •Эндонуклеазы рестрикции
- •Полимеразы
- •Обратная транскриптаза
- •Терминальная трансфераза, поли-а - полимераза
- •Другие плазмидные векторы
- •Векторы на основе бактериофага λ
- •Векторные системы для клонирования очень крупных фрагментов днк
- •Скрининг по активности белка
Терминальная трансфераза, поли-а - полимераза
Терминальная трансфераза (терминальная дезоксинуклеотидил трансфераза) катализирует присоединение мононуклеотидов к 3'-OH концу ДНК-затравки, в процессе присоединения мононуклеотида отщепляется пирофосфат. Одноцепочечная ДНК служит наиболее эффективной затравкой.
Терминальная трансфераза является в определенном смысле полимеразой, поскольку она катализирует синтез полидезоксирибонуклеотидов из дезоксирибонуклеозидтрифосфатов с высвобождением неорганического пирофосфата. Подобно ДНК-полимеразам она требует присутствия праймера со свободной 3’-гидроксильной группой. Однако, ей не нужна матрица, она вообще не способна копировать что-либо вообще и продуктом катализируемой ею реакции является одноцепочечный полимер (рис. 12).
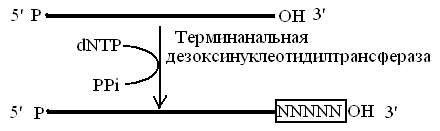
Рис. 12. Реакция, катализируемая терминальной дезоксинуклеотидилтрансферазой.
N- любой из четырех дезоксинуклеотидов: A,T,G или С
Терминальная трансфераза в присутствии в качестве кофактора ионов Mg2+ использует в качестве затравки одноцепочечную ДНК с З'-ОН концом или двухцепочечную ДНК с выступающим одноцепочечным З'-ОН концом. Если в качестве кофактора используются ионы Co2+, этот фермент может катализировать присоединение дезоксинуклеотидов к 3’-ОН концу двухцепочечной ДНК с тупыми концами.
При введении в реакцию, направляемую терминальной трансферазой, лишь одного типа дезоксинуклеотидов образуются молекулы ДНК, имеющие гомополимерные 3'-концы. Таким же образом можно достроить другим молекулам ДНК гомополимерные 3'-концы, комплементарные первым. Смешение полученных препаратов ДНК при определенных условиях может приводить к формированию гибридных молекул ДНК. Именно с помощью концевой дезоксинуклеотидилтрансферазы в 1972 г. был выполнен первый эксперимент по рекомбинации молекул ДНК in vitro.
С помощью дезоксинуклеотидилтрансферазы к молекулс ДНК, не имеющим липких концов, можно присоединять такие концы.
Подобно терминальной дезоксинуклеотидилтрансферазе поли(А)-полимераза присоединяет нуклеотидные остатки к 3’-ОН концу одноцепочечных молекул без матрицы. Однако поли(А)-полимераза проявляет специфичность, осуществляя независимое от матрицы последовательное присоединение остатков аденилата к 3'-OH-концам молекул РНК в соответствии со следующей реакцией:
РНК + nATP -> РНК(А)n + nPPi.
Поли(А) – полимераза выполняет высокоспециализированную и важную функцию в экспериментах с рекомбинантными ДНК: подготовка РНК к копированию с них комплементарной ДНК. Кроме того, ее применяют для введения радиоактивной метки в 3’-конец РНК.
Способы объединения фрагментов ДНК
Создание рекомбинантной ДНК – это процесс объединения in vitro двух или более фрагментов ДНК, выделенных из различных биологических источников. Фрагменты ДНК, содержащие нуклеотидные последовательности структурных или регуляторных участков генов, представляющих интерес для исследователя, получают с использованием эндонуклеаз рестрикции. Эти ферменты, как было рассмотрено в предыдущей главе, могут образовывать фрагменты ДНК как с тупыми, так и с липкими концами. В зависимости от цели, для которой создается новая ДНК, а также от наличия в арсенале исследователя ферментов для модификации ДНК, объединение различных фрагментов ДНК производится тремя основными методами, зависящими от того, какие концы имеют фрагменты сшиваемых ДНК.
Лигирование по одноименным "липким" концам
Этот метод является самым распространенным и популярным. Впервые этим способом гибридная ДНК была получена С. Коэном с сотрудниками в 1973 году. Одноцепочечные концы, получаемые при гидролизе ДНК эндонуклеазами рестрикции, например EcoRI, образуют водородные связи с комплементарными им последовательностями другого конца этого же фрагмента или другого фрагмента ДНК. Таким образом, любые два фрагмента (независимо от их происхождения), образовавшиеся под действием одной и той же эндонуклеазы рестрикции, могут слипаться за счет образования водородных связей между комплементарными основаниями нуклеотидов однонитевых концевых участков (рис. 13).
Однако, образование водородных связей между комплементарными основаниями одноцепочечных участков ДНК не восстанавливает полной целостности двойной спирали, поскольку остаются два разрыва в сахарнофосфатном остове полинуклеотидной цепи. Для восстановления фосфодиэфирных связей в полинуклеотидных цепях ДНК, т.е. для сшивания, или лигирования нитей, используют фермент ДНК-лигазу.

Рис. 13. Схема объединения фрагментов ДНК по липким и тупым концам (рестрикционно-лигазный метод).
Этот фермент в живой клетке выполняет ту же функцию - сшивание фрагментов ДНК, синтезирующихся при репликации.
Лигирование по одноименным "липким" концам с обработкой щелочной фосфатазой
При лигировании двух фрагментов ДНК, один из которых является линеаризованным вектором (см. раздел векторы), а другой – донорной ДНК, содержащей нужный фрагмент ДНК и предварительно обработанной такой же эндонуклеазой как и вектор, целесообразно применить еще один фермент-инструмент: щелочную фосфатазу. Чтобы предупредить комплементарное взаимодействие между липкими концами одного и того же типа рестрицированных фрагментов, например – линеаризованного вектора, проводят обработку фосфатазой, которая отщепляет фосфатные группы на 5’-концах одноцепочечных липких концов. ДНК-лигаза не может сшить концы дефосфорилированной линейной векторной ДНК (рис. 14).

Рис. 14 . Встраивание чужеродной ДНК в плазмидный вектор.
Плазмидную ДНК, обработанную эндонуклеазой рестрикции и щелочной фосфатазой, смешивают с рестрицированной донорной ДНК, содержащей нужный ген, и добавляют ДНК-лигазу. Два из четырех одноцепочечных разрыва при этом устраняются, и конструкция оказывается стабильной благодаря образовавшимся фосфодиэфирным связям
Что касается собственно рекомбинантных молекул ДНК, то хотя в них и имеются два одноцепочечных разрыва, ее фрагменты удерживаются вместе двумя фосфодиэфирными связями, образовавшимися с помощью ДНК-лигазы между дефосфорилированной плазмидной ДНК и рестрицированной донорной ДНК (рис. 14). При репликации этой ДНК после введения ее в клетку-реципиент одноцепочечные разрывы устраняются системой лигирования клетки-хозяина.
Лигирование по "тупым" концам
Тупые концы также можно соединенять с помощью ДНК-лигазы, если и фермент, и тупые концы присутствуют в реакционной смеси в высоких концентрациях (рис. 13) В этом случае реакция лигирования имеет свои особенности и ее эффективность ниже, чем при сшивке по липким концам. Впервые такие эксперименты были выполнены в 1972 году Полем Бергом в Стенфордском университете, США.
Липкие концы можно присоединить к фрагментам ДНК с тупыми концами ферментативным путем. Для этого используют фермент терминальную трансферазу из тимуса теленка, который присоединяет нуклеотиды к 3’-концам цепей ДНК. Если к 3'-концам одного из рекомбинируемых in vitro фрагментов ДНК с помощью концевой дезоксинуклеотидилтрансферазы достроить одноцепочечные олиго (dA)-сегменты определенной длины, а к концам другого фрагмента — олиго (dT)-сегменты примерно такой же длины, то при объединении полученных таким образом фрагментов происходит комплементарное спаривание за счет образования водородных связей между олиго (dА)- и олигo (dT) -последовательностями (рис. 15). Для ковалентного соединения двух фрагментов используется ДНК-лигаза. Эти процедуры составляют основу для второго общего метода получения рекомбинантных молекул ДНК, который получил название коннекторный метод.

Рис. 15. Создание «липких» концов и сшивка фрагментов ДНК коннекторным методом
Поскольку можно формировать достаточно длинные взаимокомплементарные одноцепочечные концы, гибридные молекулы образуются с высокой эффективностью. В частности, поэтому при клонировании ДНК-копий матричных РНК, которые доступны в ограниченных количествах, обычно используют коннекторный метод. При таком способе соединения между фрагментами встраиваются участки ААААА. Такие дополнительные последовательности ТТТТТ могут влиять на функции соединяемых молекул и поэтому всегда, когда только возможно, для получения рекомбинантных молекул ДНК пользуются липкими концами, образовавшимися в результате действия эндонуклеаз рестрикции.
Лигирование фрагментов с разноименными липкими, или липким и тупым концами
В ситуациях, когда необходимо сшить фрагменты ДНК, образованные разными эндонуклеазами рестрикции, и имеющие разные, то есть некомплементарные друг другу липкие концы, или тупой и липкий концы применяют адаптеры (to adapt – переделывать) или линкеры (to link – связывать). Это молекулярные "переходники". Адаптер представляет собой синтетический двухцепочечный олигонуклеотид с одним тупым концом и одним липким (рис. 16). После пришивания адаптера тупым концом к фрагменту ДНК на конце последнего появляется липкий конец для сшивания с комплементарным ему концом другого фрагмента. Впервые эту идею предложил Шеллер с сотрудниками в 1977 году.
Синтезированы большие наборы таких генных "переходников". Естественно, что при использовании линкеров должна учитываться необходимость соблюдения правил экспрессии генетической информации. Часто в середину линкера помещают какой-либо регуляторный генетический элемент, например, нуклеотидные последовательности промотора или последовательности, соответствующие участку связания с рибосомой. В этом случае линкеры обеспечивают не только объединение генов, но и обуславливают их экспрессию. Существуют линкеры "тупой конец - липкий конец", “липкий – липкий” и “липкий – тупой” (рис. 16).

Рис. 16. Изменение концов фрагментов ДНК с помощью различных адаптеров: “тупой – липкий” (1); “липкий – липкий” (2); “липкий – тупой” (3).
При необходимости липкие концы можно превратить в тупые. Это достигается либо отщеплением липких концов с помощью фермента - эндонуклеазы S1, которая разрушает только одноцепочечную ДНК, либо липкие концы "застраивают", то есть с помощью ДНК-полимеразы I на однонитевых липких концах синтезируют вторую нить (рис.17)

Рис. 17. Преобразование липких концов рестрикционных фрагментов ДНК в тупые.
Линкеры, содержащие участки узнавания для нескольких эндонуклеаз рестрикции, называются полилинкерами или множественными сайтами клонирования (MCS – multiply cloning sites). Они будут рассмотрены в следующей главе.
Генетические векторы для клонирования ДНК
Когда рассматривается вопрос создания функциональной рекомбинантной ДНК, необходимо иметь в виду, что он касается не только конструирования с помощью биологических инструментов ДНК с новыми, заданными последовательностями нуклеотидов. Из системы in vitro, в которой полинуклеотиды с помощью ферментов образуют заданные новые последовательности, нужно осуществить переход in vivo, т.е., нужно перейти в живую систему, которая с помощью своих ферментных систем обеспечит основные генетические процессы: репликацию, транскрипцию и трансляцию. Матрицей для них будет созданная рекомбинантная ДНК. Таким образом, технология рекомбинантной ДНК подразумевает также систему “хозяин – рекомбинантная ДНК”. Окружающий нас живой мир многообразен, но управляющие им биологические законы универсальны. Именно это позволяет нам применять их для достижения собственных целей с помощью биотехнологии.
При создании рекомбинантной ДНК исследователь может преследовать разные цели. Первая, которая часто является и конечной целью – это наработка в достаточных количествах небольших фрагментов ДНК, необходимых для детального исследования всей исследуемой ДНК, например – полное секвенирование генома. Такая процедура называется клонированием, т.е. создается клон клеток, который содержит в составе рекомбинантной ДНК строго определенный участок изучаемой ДНК. Если же целью является изучение продуктов экспрессии каких-либо нуклеотидных последовательностей, то простого клонирования ДНК недостаточно. В этом случае конструируемая ДНК должна содержать определенные регуляторные последовательности, которые способны обеспечивать экспрессию последовательностей нуклеотидов в виде соответствующих мРНК, а затем и полипептидов.
Вставки ДНК
При конструировании рекомбинантных ДНК используют три источника ДНК-вставок:
геномная ДНК, фрагментированная либо с помощью физических методов, например, с помощью обработки ультразвуком, либо с помощью эндонуклеаз рестрикции;
синтетические фрагменты ДНК, полученные химическим или ферментативным методоми, либо при комбинировании этих методов;
фрагменты ДНК (кДНК), полученные с помощь обратной транскрипции in vitro.
При гидролизе ДНК эндонуклеазами рестрикции часто образуются фрагменты, которые без дополнительной модификации можно использовать в виде вставки при создании рекомбинантной молекулы ДНК. В других случаях концы фрагментов ДНК, которые будут использованы как вставки, подвергают различным модификациям с помощью ферментов-инструментов.
Вставки геномной ДНК. Под геномной ДНК подразумевается совокупность всех последовательностей ДНК данного организма, обеспечивающая полное воспроизведение его в потомстве. В клетках эукариот (например, животных или растений) ДНК находится в ядре клетки в составе хромосом (ядерная или - хромосомная ДНК), а также в некоторых клеточных органоидах - митохондриях и пластидах (митохондриальная и хлоропластная ДНК). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК прикреплена изнутри к клеточной мембране. У прокариот, как и у низших эукариот (например, дрожжей), встречаются также небольшие автономные, преимущественно кольцевые, молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов.
Метод получения фрагментов ДНК с помощью эндонуклеаз рестрикции отличается высокой воспроизводимостью. Специфические ферменты разрезают данную ДНК с образованием уникального набора фрагментов. При получении необходимого для работы фрагмента, находящегося в пуле продуктов рестрикции, необходимо провести обогащение смеси нужным фрагментом ДНК. С помощью методов электрофореза в полужидкой среде, а также жидкостной хроматографии высокого разрешения с обращенной фазой можно получить значительное обогащение смеси требуемым фрагментом ДНК. Следующим этапом является идентификация специфических фрагментов, которые часто называют ДНК-мишень или ДНК интереса.
Векторы для клонирования ДНК
В основе молекулярного клонирования лежит встраивание нужного фрагмента ДНК (вставки) в другую молекулу ДНК (вектор), которая способна включать в себя новые последовательности ДНК, обеспечивать их перенос в системы, где созданная in vitro ДНК будет воспроизводиться in vivo, давая начало новому клону клеток, отличному фенотипически от исходных клеток хозяина (реципиента). Исходя из этого, вектор, в данном случае генетический, представляет собой молекулу ДНК, которая должна соответствовать определенным требованиям.
1. Способность к автономной репликации, т.е. обладание ori (точка инициации репликации). Другими словами – генетический вектор должен содержать последовательности нуклеотидов, обеспечивающие не только его собственную репликацию, но и воспроизведение встроенной в него вставки чужеродной ДНК.
2. Наличие в структуре вектора хотя бы одного уникального, т.е. встречающегося на молекуле ДНК только один раз, сайта для какой-либо эндонуклеазы рестрикции, по которому происходит встраивание вставки ДНК.
3. Наличие в структуре ДНК вектора селективного маркера – гена или генов, кодирующих белки, которые отсутствуют в клетках реципиента, например – белки, обеспечивающие устойчивость к антибиотикам. Это обеспечивает возможность вести отбор клонов, содержащих вектор со встроенной вставкой ДНК.
4. Небольшой размер ДНК вектора.
5. Обеспечение достаточной копийности в клетке-хозяине.
Рассмотрим подробно группу векторов, которые носят название плазмидные, поскольку созданы на базе природных генетических элементов бактерий и удовлетворят практически всем требованиям, предъявляемым к генетическим векторам. Рассмотренные выше подходы манипулирования ДНК прежде всего применялись для создания удобных и надежных плазмидных векторов.
Плазмидные векторы
Плазмиды – это внехромосомные, встречающиеся в природе, кольцевые двуцепочечные молекулы ДНК, способные к автономной репликации внутри бактериальных клеток.
Природные плазмиды содержат в своем составе гены устойчивости к антибиотикам, ионам тяжелых металлов (R-плазмиды), а также гены, контролирующие катаболизм некоторых органических соединений (плазмиды биодеградации, или D-плазмиды). Продукты экспрессии плазмидных генов благодаря высокой копийности плазмид обеспечивают клетке синтез большого количества ферментов, которые инактивируют антибиотики или ксенобиотики, что и обеспечивает устойчивость (резистентность) к последним..
Благодаря небольшому размеру плазмидную ДНК довольно легко выделить в чистом виде. Плазмидные ДНК легко “поглощаются” бактериальными клетками, если их обработать ионами кальция. Попавшие в клетку-хозяин молекулы ДНК плазмид реплицируются, образуя множество себе подобных копий. Однако бактериальная клетка обычно может содержать в своем составе плазмиды только одного типа. Это явление называется “несовместимость плазмид”.
Число копий плазмиды в клетке может существенно варьировать и зависит как от генетических особенности бактерии-хозяина, так и от самой плазмиды. Плазмиды, находящиеся "под ослабленным контролем" со стороны хромосомной ДНК хозяина, могут быть представлены в клетке от 10 до 200 копиями. Если же плазмида находится "под строгим контролем", она реплицируется с той же скоростью, что и главная хромосома, следовательно, содержится в клетке в одной или нескольких копиях. Однако такие малокопийные плазмидные ДНК также используют для создания векторов. Дело в том, что под действием антибиотика хлорамфеникола прекращается репликация хромосомной ДНК и клетка не делится, но плазмидная ДНК в таких условиях реплицируется и получается увеличение числа копии этой ДНК.
Плазмидный вектор pBR322
При работе с клетками E.coli чаще всего используют плазмидный вектор pBR322. Этот вектор был сконструирован Боливаром и Родригесом в 80-тые годы прошлого века с помощью классических генетических методов (in vivo) и методов, применяемых при работе с рекомбинантными ДНК (in vitro). Наименование вектора, как и наименования всех векторов на основе плазмид, содержит латинскую букву “p” от aнглийского слова “plasmid”. Заглавные буквы “B” и “R” обозначают первые буквы фамилий создавших вектор исследователей: Bolivar и Rodriguez., а число 322 - цифровое обозначение, взятое из их исследовательских протоколов. pBR322 имеет многие свойства идеального плазмидного вектора для клонирования ДНК (рис. 18).

Рис. 18. Плазмидный вектор pBR322.
Показаны уникальные сайты узнавания эндонуклеаз рестрикции; участки ДНК, обеспечивающие устойчивость к ампициллину (ampr ) и тетрациклину (tetr ) а также участок инициации репликации (ori).
Установлена полная нуклеотидная последовательность этого вектора длиной 4361 п.н. Наличие в ее структуре участка инициации репликации (ori) от природной плазмиды кишечной палочки colE1 обеспечивает репликацию исключительно в E.coli и .дает возможность получить плазмидную ДНК с высоким выходом (10-20 копий на клетку). Нуклеотидные последовательности pBR322 содержат уникальные участки узнавания для эндонуклеаз рестрикции, что дает возможность получения линейных молекул плазмиды с разнообразными липкими концами. Кроме того, этот вектор содержит два селективных маркера: гены устойчивости к ампициллину (ampr) и тетрациклину (tetr).
Клетки E.coli, содержащие pBR322, выращивают на питательных средах c ампициллином или тетрациклином, либо с обоими антибиотиками. Если встроить какой-либо фрагмент ДНК по рестрикционному сайту, расположенному в одном из маркерных генов, то этот ген инактивируется (рис. 19).

Рис. 19. Фенотипические свойства клеток, содержащих плазмиду pBR322 со вставками и без них.
Так, при встраивании ДНК, например по сайту для эндонуклеазы рестрикции PstI, расположенному на участке, кодирующем устойчивость к ампициллину, не может синтезироваться белок, обеспечивающий рост клеток, содержащих такую рекомбинантную ДНК, на средах с ампициллином. Такие клетки способны расти на средах, содержащих тетрациклин, но не ампициллин. И наоборот, вставки сегментов ДНК по участкам узнавания ферментов, расположенных в гене устойчивости к тетрациклину, например HindIII или BamHI, оставляют возможность выживания клеток только на средах с ампицллином. При любой локализации вставки в молекуле вектора происходит отбор только тех бактериальных колоний, которые содержат рекомбинантные плазмидные ДНК.
.
Введение рекомбинантной ДНК в клетки бактерий и отбор трансформантов
Процесс введения рекомбинантной ДНК в бактериальную клетку называется трансформацией. Результатом трансформации является приобретение клеткой-хозяином новых последовательностей ДНК и, следовательно, новых фенотипических признаков, например - устойчивости к определенным антибиотикам. Клетка-хозяин, используемая в таких экспериментах, должна иметь определенный фенотип, в частности r - , т.е. в ней не должно быть ферментов рестрикции; она должна быть неспособна к общей рекомбинации (recA-), чтобы экзогенная ДНК не модифицировалась в результате гомологичной рекомбинации. Одна из самых широко используемых для этих целей культур – это лабораторный штамм бактерий E.coli – штамм К12.
Клетки, способные поглощать чужеродную ДНК, называются компетентными. Компетентность E. coli необходимо индуцировать, а некоторые другие бактерии обладают этим свойством изначально. Долю компетентных клеток можно повысить, используя специальную питательную среду или условия культивирования. Для бактерий, устойчивых к химическим индукторам компетентности или не обладающих природной компетентностью, применяются другие системы доставки ДНК.
Самыми часто применяемыми в лабораторной практике приемами трансформации бактериальных клеток являются:
трансформация E.coli с помощью обработки хлоридом кальция;
электропорация – увеличение проницаемости клеток под воздействием импульса тока длительностью ~4,5 мс;
Результаты трансформации можно оценивать количественно: определяя либо частоту, либо эффективность трансформации.
Частота трансформации – доля клеток в клеточной популяции, получивших чужеродную ДНК; выражается числом трансформантов к общему числу клеток.
Эффективность трансформации - число трансформантов в расчете на 1 мкг ДНК, взятой для трансформации.
Информация по клонированию рекомбинантных ДНК с помощью плазмидного вектора pBR322, изложенная в данном разделе, суммирована в виде схемы эксперимента и представлена на рисунке 20.

Рис. 20. Клонирование ДНК в плазмидном векторе pBR322
1, 2, 3, 4 и 5 – этапы процедуры клонирования (см. текст).
1. ДНК pBR322 разрезают эндонуклеазой рестрикции PstI в участке, определяющем устойчивость к ампициллину.
2. Фрагменты донорной ДНК, также полученные с помощью PstI и имеющие липкие концы, как и линеаризованный вектор pBR322, с помощью ДНК-лигазы сшивают с векторной ДНК. Следствием образования такой конструкции является деструктурирование гена, обеспечивающего устойчивость к ампициллину. Таким образом, созданная рекомбинантная ДНК при введении в клетки E.coli не сможет обеспечить им выживание на среде с ампициллином.
3. Клетки E.coli трансформируют рекомбинантной ДНК.
4. Суспензию клеток после проведения процедуры трансформации высевают на чашки с агаром и питательной средой, содержащей антибиотик тетрациклин. На этом этапе происходит селекция, т.е. отбор клеток, которые способны расти на среде с тетрациклином. Выросшие на этом агаре клетки содержат рекомбинантную ДНК и ДНК pBR322, в которую не встроилась вставка донорной ДНК, т.е. восстановилась первоначальная структура вектора.
5. Индивидуальные колонии клеток E.coli, выросшие на чашке с тетрациклином пересевают на чашки две чашки, одна из которых содержит агар с ампициллином, а вторая – с тетрациклином. Клетки, содержащие рекомбинантную плазмидную ДНК, растут только на агаре с тетрациклином, поскольку ген, обеспечивающий устойчивость к ампициллину у них деструктурирован за счет встраивания донорной ДНК. В то время как клетки с исходной, т.е. восстановленной векторной ДНК pBR322 растут на обеих чашках, поскольку гены устойчивости к обоим антибиотикам находятся в нативном, т.е. в исходном состоянии.
Из клеток отобранных клонов E.coli экстрагируют плазмидную ДНК и анализируют ее структуру.
