
- •Миколаївський національний аграрний університет
- •Факультет технології виробництва і переробки продукції тваринництва, сертифікації та біотехнології
- •Кафедра генетики, годівлі тварин та біотехнології
- •Загальна біотехнологія
- •Методичні рекомендації для самостійного вивчення дисципліни
- •І виконання лабораторних робіт студентами денної форми навчання спеціальності 6.051401-"Біотехнологія"
- •1. Загальні правила техніки безпеки в лабораторії на заняттях з біотехнології
- •Правила техніки безпеки в лабораторії при роботі з кислотами і лугами
- •Правила техніки безпеки в лабораторії з легкозаймистими і горючими рідинами (лзр та гр)
- •Правила техніки безпеки в лабораторії з побутовим газом, спиртівкою і сухим пальним
- •Правила техніки безпеки в лабораторії з хімічної посудом
- •Правила техніки безпеки в лабораторії з електрообладнанням та електроприладами
- •Правила техніки безпеки в лабораторії при роботі з реактивами
- •Правила техніки безпеки в лабораторії при роботі з біооб'єктами
- •Заходи першої допомоги при отруєннях неорганічними та органічними речовинами:
- •2. Підготовка посуду і обладнання до роботи з живими об'єктами
- •3. Техніка підготовки і методи стерилізації поживних середовищ
- •3.1. Вимоги, що надаються до поживних середовищ
- •3.2. Склад і спосіб приготування поживних середовищ
- •3.3. Характеристика компонентів поживних середовищ
- •Склад кукурудзяного екстракту
- •Хімічний склад продуктів переробки зерна
- •Склад деревної сировини
- •3.4. Стерилізація поживних середовищ
- •Способи та режими стерилізації
- •Питання для самоперевірки
- •4. Методи генетичної інженерії
- •4.1. Методи отримання генів
- •4.2. Введення гена у вектор і клонування
- •4.3. Методи трансформації клітин рослин і тварин
- •4.4. Скринінг
- •4.5. Експресія (функціонування) чужорідних генів в геномі бактерій, рослин і тварин
- •4.6. Вилучення генних продуктів у «брудній» суміші
- •Питання для самоперевірки
- •5. Методи виділення чистих культур мікроорганізмів
- •5.1. Допоміжні операції
- •5.1.1. Пересівання мікроорганізмів
- •5.1.2. Розлив агарізованих середовищ в чашки Петрі
- •5.2. Виділення чистої культури мікроорганізму
- •5.2.1. Крапельний метод
- •5.2.2. Методи поверхневого посіву на щільні середовища
- •Питання для самоперевірки
- •6. Морфологія мікроорганізмів
- •6.1. Макроморфологічні характеристики
- •6.1.1. Зростання у рідких середовищах
- •6.1.2. Зростання на щільних середовищах
- •6.2. Мікроморфологічні характеристики
- •6.2.1. Приготування препаратів живих культур
- •6.2.2. Приготування постійних (фіксованих) препаратів
- •6.2.3. Фарбування препаратів
- •6.2.4. Приготування розчинів барвників
- •6.2.5. Оцінка фізіологічного стану дріжджів за мікроморфологічними характеристикам.
- •6.2.6. Робота з оптичним мікроскопом
- •6.2.7. Вимірювання дріжджових клітин
- •Питання для самоперевірки
- •7. Біотехнологія і харчова промисловість
- •Найважливіші ферменти та галузі їх використання
- •7.1. Наявність каталази у продуктах рослинного та тваринного походження
- •Результати наявності ферменту
- •7.2. Використання мікроорганізмів у хлібопеченні
- •Питання для теоретичної підготовки
- •7.3. Мікроорганізми і виробництво молока і молочних продуктів
- •Показники якості кисломолочних продуктів
- •Класифікація молока по редуктазної пробі з використанням резазурину
- •Питання для теоретичної підготовки
- •8. Сучасні біотехнологічні методи та виробництва
- •8.1. Розрахунок компонентів цукрового сиропу і кольору та компонентів купажного сиропу
- •8.1.1. Розрахунок компонентів цукрового сиропу і кольору
- •Приклади
- •8.1.2. Розрахунок компонентів купажного сиропу
- •Приклади
- •Індивідуальні завдання до практичних занять
- •8.2. Полісахариди. Крохмаль та клітковина
- •8.2.1. Крохмаль.
- •8.2.2. Клітковина
- •Хід роботи
- •Хід роботи
- •Питання для самоперевірки
- •9. Застосування іммобілізованих ферментів і клітин в біотехнології
- •9.1. Іммобілізація клітин Рseudomonas fluorescens в гелі альгінат кальцію
- •Питання для теоретичної підготовки
- •10. Клітинна інженерія рослин
- •10.1. Метод вегетативного клонування рослин (клонального мікророзмноження)
- •10.2. Культивування калюсних тканин
- •10.3. Приготування поживних середовищ для культивування ізольованих клітин і тканин рослин
- •10.4. Приготування поживного середовища Мурасіге-Скуга (м-с)
- •Склад поживних середовищ, що використовують
- •Питання для самоперевірки
- •10.5. Отримання і культивування калюсної тканини з коренеплодів моркви
- •Питання для самоперевірки
- •11. Екологічна біотехнологія
- •11.1 Очищення стічних вод
- •11.2. Біохімічні методи очищення стічних вод
- •11.3. Розрахунок можливості сумісного очищення виробничих та
- •11.4. Розрахунок витрати стічних вод в аеротенках
- •Питання для самоперевірки
- •12. Сільськогосподарська біотехнологія
- •Питання для самоперевірки
- •Перелік навчальної літератури
- •Додаток Відповіді на завдання
- •Методичні рекомендації
- •54029, М.Миколаїв, вул. Паризької комуни, 9
6.2.6. Робота з оптичним мікроскопом
Оптичний мікроскоп (рис. 15) дає збільшення в десятки, сотні і навіть тисячі разів, що дозволяє безпосередньо спостерігати досліджувані об'єкти. Основні частини мікроскопа: оптична система, освітлювальна система, предметний столик і штатив. Оптична система складається з об'єктиву і окуляру, що з'єднані тубусом. На об'єктиві і окулярі вказується їх збільшення. Добуток цих збільшень дасть загальне збільшення мікроскопа. Освітлювальна система включає в себе джерело освітлення, двостороннє дзеркало (одна сторона плоска для природного освітлення, інша - увігнута для штучного освітлення) і конденсор з діафрагмою.
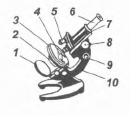
Рис. 15. Оптичний мікроскоп: 1 - дзеркало, 2 - конденсор, 3 - предметний столик, 4 - предметне скло, 5 - об'єктив, 6 - окуляр, 7 - тубус, 8 - макрометріческій гвинт, 9 - мікрометричний гвинт, 10 – штатив
На початку роботи домагаються правильного освітлення поля зору мікроскопа. При використанні зовнішнього освітлювача вихідний від нього пучок світла за допомогою увігнутого дзеркала направляють в наглядову систему мікроскопа. Діафрагма конденсора при цьому відкрита, а сам конденсор піднятий. При правильній установці освітлення поле зору мікроскопа має форму кола, добре і рівномірно освітленого. На предметний столик мікроскопа поміщають досліджуваний препарат і закріплюють його клемами. Попередній огляд препарату проводять при малому збільшенні (з об'єктивом х8).
Слід пам'ятати, що вільна робоча відстань (відстань між об'єктивом і сфокусованим препаратом) залежить від збільшення об'єктиву: для х8 це відстань 8 мм, для х40 - 0,6 мм, для х90 - 0,15 мм. Тому спочатку, спостерігаючи за об'єктивом збоку, за допомогою макрометричного гвинта опускають тубус мікроскопа і наближають об'єктив до препарату на відстань, меншу за робочу. Потім, дивлячись в окуляр, обертанням макрометричного гвинта піднімають тубус до появи в полі зору досліджуваного об'єкта. Далі за допомогою мікрометричного гвинта фокусують об'єкт, домагаючись чіткого зображення. Переміщенням конденсора і діафрагмою регулюють освітленість. Препарат досліджують по всій його поверхні, пересуваючи предметний столик бічними гвинтами. При переході до більшого збільшення (об'єктив х40) злегка відкривають діафрагму і мікрометричним гвинтом проводять фокусування.
Для мікроскопічного дослідження бактерій та внутрішньоклітинних структур користуються імерсійним об'єктивом. На досліджуваний препарат наноситься крапля імерсійної рідини, що має близький до скла показник заломлення. Імерсійний об'єктив (х90) за допомогою макрометричного гвинта занурюють в імерсійну рідину (кедрове масло), не торкаючись препарату. Потім, дивлячись в окуляр, тим же гвинтом дуже повільно піднімають тубус до появи зображення. Фокусують препарат мікрометричним гвинтом, який можна обережно обертати не більше ніж на половину обороту в ту або іншу сторону.
Після закінчення роботи слід підняти тубус мікроскопа, зняти препарат з предметного столика, привести в робоче положення об'єктив х8, видалити м'якою тканиною імерсійне масло з об'єктиву х90, відключити освітлювач і накрити мікроскоп поліетиленовим ковпаком.
Для підвищення контрастності нефарбованих прозорих живих об'єктів використовують мікроскопію у відбитому світлі, темнопольну мікроскопію і фазово-контрастну мікроскопію.
Темнопольна мікроскопія заснована на висвітленні об'єкта бічними променями світла, які не потрапляють в об'єктив. Спеціальний темнопольний конденсор має затемнену середню частину, що не проникна для центральних променів світла в об'єктив, тому поле зору виглядає абсолютно чорним. У площину препарату потрапляють тільки бічні промені, відбиті від дзеркальних поверхонь, розташованих всередині конденсора. Ці бічні промені освітлюють клітини, що містяться в препараті.
У результаті клітини мікроорганізмів у препараті "роздавлена крапля" будуть яскраво освітленими об'єктами на темному тлі. Для темнопольній мікроскопії потрібно більш потужне джерело світла, ніж для мікроскопії в світлому полі, товщина препарату повинна бути мінімальною, а предметні скла стандартної товщини (до 1,2 мм).
Препарат дріжджових клітин "роздавлена крапля" поміщають на предметний столик мікроскопа і фокусують при малому збільшенні (об'єктив х8) зі світлопольним конденсором. Потім замінюють конденсор на темнопольний. На лінзу конденсора наносять краплю імерсійного масла і піднімають конденсор до зіткнення краплі олії з предметним склом. Крапля повинна рівномірно заповнювати простір між лінзою конденсора і предметним склом і не містити бульбашок повітря. Переглядають препарат, користуючись об'єктивом х40.
Фазово-контрастна мікроскопія. У полі зору звичайного біологічного мікроскопа контрастними будуть об'єкти, які різною мірою поглинають світло у порівнянні з навколишнім середовищем. Оскільки при поглинанні світла відбувається зменшення амплітуди світла, що проходить, такі об'єкти називають амплітудними. Об'єкти, які поглинають світло, що проходить, в тій же мірі, що і навколишнє середовище, але відрізняються від неї значенням коефіцієнта заломлення, називають фазовими. При проходженні світла через такий об'єкт відбувається тільки зміна фази світлової хвилі, що проходить, за рахунок різниці в показниках заломлення. У фазово-контрастної мікроскопії методом інтерференційного контрастування перетворюють невидимі людському оку відмінності по фазі в зміни амплітуди світла. Інтерференційна мікроскопія робить можливим спостерігати без фарбування не тільки прозорі клітини живих мікроорганізмів, але і внутрішньоклітинні структури з різними показниками заломлення. У біологічних лабораторіях використовують для якісних та кількісних досліджень мікроорганізмів поляризаційно-інтерференційні мікроскопи.
