
- •Миколаївський національний аграрний університет
- •Факультет технології виробництва і переробки продукції тваринництва, сертифікації та біотехнології
- •Кафедра генетики, годівлі тварин та біотехнології
- •Загальна біотехнологія
- •Методичні рекомендації для самостійного вивчення дисципліни
- •І виконання лабораторних робіт студентами денної форми навчання спеціальності 6.051401-"Біотехнологія"
- •1. Загальні правила техніки безпеки в лабораторії на заняттях з біотехнології
- •Правила техніки безпеки в лабораторії при роботі з кислотами і лугами
- •Правила техніки безпеки в лабораторії з легкозаймистими і горючими рідинами (лзр та гр)
- •Правила техніки безпеки в лабораторії з побутовим газом, спиртівкою і сухим пальним
- •Правила техніки безпеки в лабораторії з хімічної посудом
- •Правила техніки безпеки в лабораторії з електрообладнанням та електроприладами
- •Правила техніки безпеки в лабораторії при роботі з реактивами
- •Правила техніки безпеки в лабораторії при роботі з біооб'єктами
- •Заходи першої допомоги при отруєннях неорганічними та органічними речовинами:
- •2. Підготовка посуду і обладнання до роботи з живими об'єктами
- •3. Техніка підготовки і методи стерилізації поживних середовищ
- •3.1. Вимоги, що надаються до поживних середовищ
- •3.2. Склад і спосіб приготування поживних середовищ
- •3.3. Характеристика компонентів поживних середовищ
- •Склад кукурудзяного екстракту
- •Хімічний склад продуктів переробки зерна
- •Склад деревної сировини
- •3.4. Стерилізація поживних середовищ
- •Способи та режими стерилізації
- •Питання для самоперевірки
- •4. Методи генетичної інженерії
- •4.1. Методи отримання генів
- •4.2. Введення гена у вектор і клонування
- •4.3. Методи трансформації клітин рослин і тварин
- •4.4. Скринінг
- •4.5. Експресія (функціонування) чужорідних генів в геномі бактерій, рослин і тварин
- •4.6. Вилучення генних продуктів у «брудній» суміші
- •Питання для самоперевірки
- •5. Методи виділення чистих культур мікроорганізмів
- •5.1. Допоміжні операції
- •5.1.1. Пересівання мікроорганізмів
- •5.1.2. Розлив агарізованих середовищ в чашки Петрі
- •5.2. Виділення чистої культури мікроорганізму
- •5.2.1. Крапельний метод
- •5.2.2. Методи поверхневого посіву на щільні середовища
- •Питання для самоперевірки
- •6. Морфологія мікроорганізмів
- •6.1. Макроморфологічні характеристики
- •6.1.1. Зростання у рідких середовищах
- •6.1.2. Зростання на щільних середовищах
- •6.2. Мікроморфологічні характеристики
- •6.2.1. Приготування препаратів живих культур
- •6.2.2. Приготування постійних (фіксованих) препаратів
- •6.2.3. Фарбування препаратів
- •6.2.4. Приготування розчинів барвників
- •6.2.5. Оцінка фізіологічного стану дріжджів за мікроморфологічними характеристикам.
- •6.2.6. Робота з оптичним мікроскопом
- •6.2.7. Вимірювання дріжджових клітин
- •Питання для самоперевірки
- •7. Біотехнологія і харчова промисловість
- •Найважливіші ферменти та галузі їх використання
- •7.1. Наявність каталази у продуктах рослинного та тваринного походження
- •Результати наявності ферменту
- •7.2. Використання мікроорганізмів у хлібопеченні
- •Питання для теоретичної підготовки
- •7.3. Мікроорганізми і виробництво молока і молочних продуктів
- •Показники якості кисломолочних продуктів
- •Класифікація молока по редуктазної пробі з використанням резазурину
- •Питання для теоретичної підготовки
- •8. Сучасні біотехнологічні методи та виробництва
- •8.1. Розрахунок компонентів цукрового сиропу і кольору та компонентів купажного сиропу
- •8.1.1. Розрахунок компонентів цукрового сиропу і кольору
- •Приклади
- •8.1.2. Розрахунок компонентів купажного сиропу
- •Приклади
- •Індивідуальні завдання до практичних занять
- •8.2. Полісахариди. Крохмаль та клітковина
- •8.2.1. Крохмаль.
- •8.2.2. Клітковина
- •Хід роботи
- •Хід роботи
- •Питання для самоперевірки
- •9. Застосування іммобілізованих ферментів і клітин в біотехнології
- •9.1. Іммобілізація клітин Рseudomonas fluorescens в гелі альгінат кальцію
- •Питання для теоретичної підготовки
- •10. Клітинна інженерія рослин
- •10.1. Метод вегетативного клонування рослин (клонального мікророзмноження)
- •10.2. Культивування калюсних тканин
- •10.3. Приготування поживних середовищ для культивування ізольованих клітин і тканин рослин
- •10.4. Приготування поживного середовища Мурасіге-Скуга (м-с)
- •Склад поживних середовищ, що використовують
- •Питання для самоперевірки
- •10.5. Отримання і культивування калюсної тканини з коренеплодів моркви
- •Питання для самоперевірки
- •11. Екологічна біотехнологія
- •11.1 Очищення стічних вод
- •11.2. Біохімічні методи очищення стічних вод
- •11.3. Розрахунок можливості сумісного очищення виробничих та
- •11.4. Розрахунок витрати стічних вод в аеротенках
- •Питання для самоперевірки
- •12. Сільськогосподарська біотехнологія
- •Питання для самоперевірки
- •Перелік навчальної літератури
- •Додаток Відповіді на завдання
- •Методичні рекомендації
- •54029, М.Миколаїв, вул. Паризької комуни, 9
5.1.2. Розлив агарізованих середовищ в чашки Петрі
Колбу з агарізованим середовищем (сусло-агар або мʹясопептонний агар) нагрівають на водяній бані до розплавлення середовища, а потім охолоджують до 45...50°С. Середовище розливають по стерильним чашкам в асептичних умовах. Горловину колби беруть у праву руку і над полум'ям пальника лівою рукою виймають ватно-марлеву пробку, притиснувши її мізинцем до долоні. Обпалюють горловину колби, лівою рукою злегка піднімають кришку чашки. Обережно, не торкаючись до чашці, вводять горловину під кришку і наливають розплавлене середовище (рис. 7).
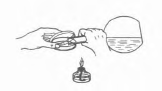
Рис. 7. Виливання поживного середовища у чашку Петрі
У кожну чашку наливають по 15...20 см3 середовища, розподіляючи його рівномірно по дну чашки шаром 5...6 мм, і закривають кришку. Бульбашки повітря, що створилися, відразу ж видаляють, підносячи до них запалений сірник. Заповнені чашки ставлять на горизонтальну поверхню, де при кімнатній температурі за 15...30 хв. відбувається ущільнення середовища.
При проведенні посіву в день розливу середовище підсушують в термостаті 20...30 хв. В термостаті обережно знімають кришку з чашки і встановлюють їх отвором вниз. Якщо посів роблять на інший день, то чашки, не підсушуючи, загортають у папір, в якому їх стерилізували, і поміщають в холодильник або термостат.
5.2. Виділення чистої культури мікроорганізму
5.2.1. Крапельний метод
Для виконання роботи попередньо готують в солодовому суслі суспензію вихідної культури дріжджів з таким розрахунком, щоб у 1 см3 середовища містилося близько 100 дріжджових клітин. З приготовленої суспензії стерильним креслярським пером наносять ряди дрібних крапель на незнежирене покривне скло, що простерилізоване в полум'ї пальника. Скло перевертають на стерильне предметне скло з лункою (препарат "висяча крапля"). Всі краплі негайно переглядають під мікроскопом і відзначають краплі, що містять по одній клітині. Якщо все краплі містять по кілька клітин, то збільшують розбавлення суспензії і процедуру повторюють. Скло з приготованим препаратом поміщають в чашку Петрі на зволожений фільтрувальний папір. Потім чашку ставлять у термостат і витримують (1...4 діб) при температурі, сприятливої для життєдіяльності даного виду дріжджів. За цей час в зазначених крапельках з одиничних клітин утворюються мікроколонії, які стерильною голкою або шматочком стерильного фільтрувального паперу за допомогою стерильного пінцета переносять в пробірку з живильним середовищем для розмноження.
5.2.2. Методи поверхневого посіву на щільні середовища
Метод заснований на тому, що на поверхні щільного середовища відбувається іммобілізація мікроорганізмів, тобто вони втрачають рухливість і при розмноженні утворюють видимі неозброєним поглядом скупчення мікроорганізмів – колонії. При виділенні чистої культури необхідно забезпечити такий розподіл мікроорганізмів на поверхні щільного середовища, щоб колонії утворювалися з окремих клітин і при розростанні не об'єднувалися. Тільки в цьому випадку мікроорганізми, що взяти з окремої колонії, можна використовувати для вирощування чистої культури.
В пробірки з м'ясо – пептонним агаром посів бажано проводити уколом (рис. 8). Якщо розведення досліджуваного матеріалу виконано правильно, на поверхні середовища або в його товщі (залежно від методу посіву) утворяться ізольовані колонії мікроорганізмів, видимі неозброєним оком.
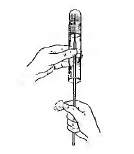
Рис. 8. Посів культури мікроорганізмів в щільне середовище уколом
Розсів мікроорганізмів здійснюють на поверхню агарізованого щільного поживного середовища в чашки Петрі або петлею за принципом "штриха, що виснажується", або з суспензії піпеткою з наступним розсіванням шпателем за Дрігальским, або за методом послідовних розведень. Чашки Петрі з щільним середовищем готують заздалегідь (див. 5.1.2.).
Посів методом "штриха, що виснажується" здійснюють бактеріальної петлею, завдаючи дуже часті штрихи на поверхню агарізованого середовища без проміжного пропалювання петлі або пропалюючи петлю після кожного штриха. В останньому випадку на чашку Петрі з сусло-агаром здійснюють посів петлею у вигляді вертикального штриха в лівій частині чашки (рис. 9). Потім петлю обпалюють, охолоджують, торкаючись петлею внутрішньої
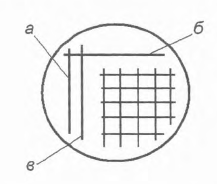
Рис. 9. Схема «штриха, що виснажується»: а) перший штрих; 6) другий штрих; в) третій штрих
стінки чашки або поверхні агарізованого середовища і проводять горизонтально другий штрих, починаючи від першого. Петлю знову обпалюють, охолоджують і проводять петлею вертикальний штрих, перетинаючи другий штрих. Далі цієї ж петлею (без випалу) наносять на поверхню середовища сітку з горизонтальних і вертикальних штрихів, не торкаючись перших трьох штрихів.
При нанесенні штрихів відбувається розтягування клітин мікроорганізмів по поверхні середовища. З кожним новим штрихом число клітин, що розтягується, зменшується і, якщо спочатку при попаданні на сусло-агар більшої кількості клітин ріст мікроорганізмів буде у вигляді суцільного штриха, то на останніх штрихах повинні вирости окремі колонії з ізольованих клітин. Засіяні чашки Петрі поміщають в термостат і витримують 3...4 доби при 28...32°С.
Розсів шпателем за Дрігальським. Краплю суспензії дріжджових клітин стерильною піпеткою або петлею наносять на поверхню сусло-агару в чашці Петрі і стерильним шпателем Дрігальского розтирають краплю по всій поверхні поживного середовища (рис. 10). Потім шпатель переносять у другу чашку і втирають культуру, що залишилася на шпателі, в поверхню поживного середовища. і т.і. Зазвичай подібним чином послідовно засівають 3...4 чашки на випадок, якщо в першій буде дуже густий ріст колоній. Цей метод поверхневого посіву іноді називають "мазком, що виснажується". Чашки з засіяними культурами поміщають в термостат і витримують 3...4 доби при 28 ... 32 ° С.
Метод послідовних розріджень більш надійний, тому що дозволяє наносити на поверхню щільного поживного середовища певне число клітин мікроорганізмів. Відомо, що розміри стандартної чашки Петрі забезпечують ізольований ріст не більше ніж 50...100 колоніям. Отже, при внесенні в чашку суспензії, що містить близько 50 клітин, і її рівномірному розподілі по поверхні поживного середовища будуть вирощені ізольовані колонії, що утворилися з окремих клітин. Метод розведень особливо зручний для змішаної культури, яка часто розвивається у виробничих умовах.
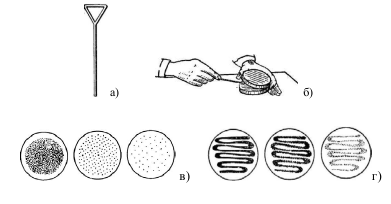
Рис. 10. Посів мікроорганізмів на поверхню щільного середовища в чашках Петрі: а) шпатель Дрігальського, б) положення чашки й руки при посіві шпателем; в) ріст мікроорганізмів після засіву шпателем; г) ріст мікроорганізмів після засіву петлею
У тих випадках, коли відома концентрація клітин у суспензії, можна розрахувати необхідний коефіцієнт розведення, що забезпечує внесення з певним обсягом суспензії необхідного числа клітин (метод граничних розведень). Наприклад, в 1 см3 вихідної дріжджової суспензії міститься 100000 клітин. Якщо градуйованою піпеткою в одну чашку Петрі вносять 0,05 см3 суспензії, то для одержання ізольованих колоній в цьому об’ємі повинно бути 50 клітин. Отже, в 1 см3 суспензії повинно міститися 1000 клітин. Тому вихідну суспензію слід розвести в 100 разів. Для цього у дві стерильні пробірки наливають по 4,5 см3 стерильної водопровідної води. У першу пробірку вносять 0,5 см3 вихідної суспензії, тобто розводять суспензію в 10 разів, і перемішують. Потім з першої пробірки стерильною піпеткою відбирають 0,5 см3 і переносять у другу пробірку, тобто розводять ще в 10 разів. В результаті двох послідовних розведень вихідна суспензія розріджується в сто разів. Після перемішування з другої пробірки розсіюють суспензію на щільне поживне середовище. Засіяні чашки термостатують.
У разі невідомої концентрації клітин у суспензії готують кілька послідовних розведень (рис. 11) у стерильній водопровідній воді з певним коефіцієнтом розведення, зазвичай рівним 10. Для цього 1 см3 вихідної дріжджової суспензії стерильною піпеткою додають в пробірку з 9 см3 стерильної водопровідної води (отримують розведення 1:10), перемішують вміст пробірки і цієї ж піпеткою беруть краплю суспензії, переносять у чашку Петрі і розсівають шпателем по поверхні агарізованого середовища. Наступне розведення готують аналогічним чином, використовуючи замість вихідної суспензії суспензію з розведенням 1:10, 1: I00, 1:1000 і т.д. Для кожного посіву використовують стерильні інструменти (піпетки, шпателі
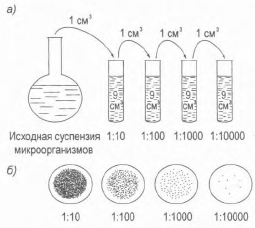
Рис. 11. Метод послідовних розріджень: а) схема методу; б) колонії мікроорганізмів, що виросли
Дрігальского), колба з вихідною суспензією мікроорганізмів і пробірки закриті ватно-марлевимі пробками (на рис. 11,а не показані). Засіяні чашки термостатують. Найчастіше в перших двох чашках утворюються суцільні "газони", тоді як в подальших чашках можна виділити окремі колонії. Якщо для посіву брати піпеткою строго визначений обсяг суспензії, то по числу ізольованих колоній в одній чашці, знаючи розведення, можна розрахувати концентрацію життєдіяльних мікроорганізмів у вихідній суспензії, припускаючи, що кожна колонія утворюється з окремою живої клітини.
Процес виділення чистої культури мікроорганізму методом поверхневого посіву на щільні середовища закінчується пересіванням бактеріальної петлею мікроорганізмів з однієї колонії, що зросла ізольовано, в пробірку з поживним середовищем. Накопичення чистої культури в лабораторії проводять у два етапи - вирощування в пробірках, а потім в колбах на рідких і щільних середовищах. Контролем чистоти виділеної культури служить однорідність клітин під мікроскопом і однотипність колоній на чашці Петрі при подальшому розсіві.
