
- •Лабораторная работа № 4 устройство и принцип работы спектрографа
- •Краткая теория
- •II.Молекулярные спектры
- •Устройство спектрографа
- •Ход работы:
- •2. Запрещается смотреть в излучающее окно ртутно-кварцевой лампы.
- •Градуировка спектрографа.
- •Запись результатов градуировки спектрографа
- •II.Определение длин волн в неизвестном спектре испускания.
- •Определение длин волн известных линий спектра
- •III. Наблюдение спектров поглощения
- •Определение погрешностей
- •Приложение 1
- •Литература:
- •Глава 24. Контрольные вопросы
- •Тестовые задания.
- •14. Спектр излучения по сравнению со спектром поглощения:
- •15. Полная энергия молекулы это:
- •16. Спектром излучения вещества называется:
- •17. При переходе атома из одного состояния в другое поглощается фотон, энергия которого определяется разностью энергий атомных состояний
- •18. Поглощение атомами энергии фотона характеризуется:
- •19. Каждый электрон в молекуле находится на определенной орбитали ( -орбитали) и обладает определенной энергией, поэтому в молекуле существует:
Лабораторная работа № 4 устройство и принцип работы спектрографа
Цель занятия: Изучить функциональную структуру спектроскопа (спектрографа), виды спектров, понятия количественного и качественного спектрального анализа, применение в фармации и биологии.
Краткая теория
Спектральные методы исследования находят в настоящее время широкое применение в лабораторной практике. Свет представляет собой совокупность электромагнитных волн очень высокой частоты. Если на его пути поставить призму, то лучи будут преломляться под разными углами
(дисперсия), и дают спектры. Различают спектры по происхождению (атомные, молекулярные) по способу получения (испускания, поглощения), по виду (сплошной, линейчатый, полосатый).
I.Атомные спектры.
Состояние электрона в атоме характеризуется волновой функцией, которая содержит безразмерные величины - квантовые числа. Квантовые числа могут принимать ряд целочисленных значений. Этими числами задается атомная орбиталь, распределение электронов по атомным орбиталям и определяется электронная конфигурация атома.
Основным состоянием атомной системы является состояние с наименьшей энергией.
Возбужденным состоянием атомной системы называют состояние, в котором полная энергия больше энергии основного состояния. Энергия электронов атома тоже зависит от квантовых чисел и может принимать только строго определенные значения энергии Е, которые называются энергетическими уровнями. Для одноэлектронного атома энергетические уровни атома и электрона совпадают.
Поглощение и испускание энергии атома связано с квантовыми переходами электронов с одного уровня на другой.
Различаются два типа переходов:
I- с излучением или поглощением энергии квантов.
II.-без излучения или поглощения электромагнитной энергии.
Излучаемая атомами энергия составляет спектр излучения, поглощаемая- спектр поглощения.
Квантовые переходы не могут происходить между любыми уровнями.
Существуют правила отбора или запрета, формирующие условия, при которых переходы возможны или невозможны (маловероятны).
В атомах в результате взаимодействия электронов между собой картина энергетических уровней усложняются. Энергия атома в целом определяется заданием квантовых чисел: n – главнее квантовое число, определяет уровни энергии электрона и L - орбитальное квантовое число, характеризует орбитальный момент электрона относительно ядра. Совокупность квантовых чисел n и L и определяет электронную конфигурацию атома. Как правило, каждой конфигурации принадлежит набор энергетических уровней.
При переходе между уровнями излучается или поглощается квант электромагнитной энергии, частота которого определяется формулой Планка: hv=Е2-Е1
II.Молекулярные спектры
Молекулярные спектры значительно сложнее атомных. Рассмотрим энергетические уровни простейшей двухатомной молекулы. Каждому электронному состоянию соответствует своя система колебательных уровней Vi одно из которых основное и несколько возбужденных. Каждому колебательному уровню Vi соответствует своя система вращательных подуровней Ii.
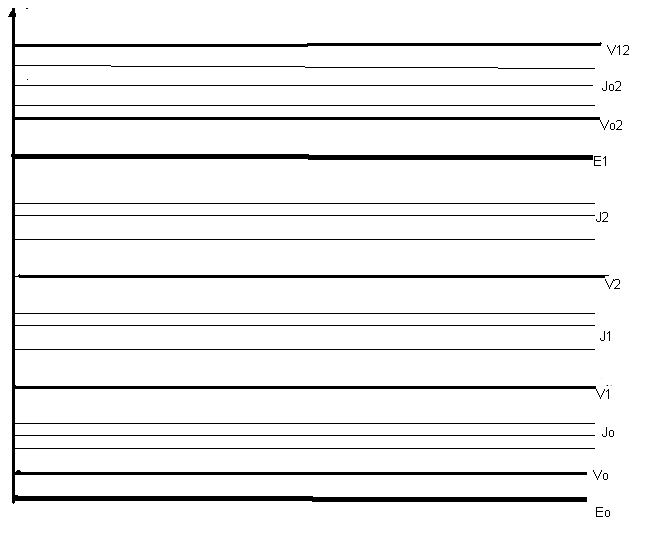
Рис.1 Энергетические уровни молекул
Чисто вращательные молекулярные спектры дают вещества в газообразном состоянии, чисто колебательные, а тем более чисто электронные спектры молекул получить нельзя, т.к. изменяется все три вида движения молекул. Колебательно-вращательные спектры можно получить при любом агрегатном состоянии.
В возбужденном состоянии молекула резко отличается по своим свойствам и строению, по сравнению с основным состоянием.
Состояние, при котором электроны спарены и их суммарный спиновой момент равен нулю, называется СИНГЛЕТНЫМ.
Состояние, при котором спины электронов параллельны и их суммарный спиновой момент отличен от нуля, называется ТРИПЛЕТНЫМ.
Основной невозбужденный уровень обычно синглетный S0, возбужденные электронные состояния могут быть синглетными S1*, S2*, S3З и триплетными Т1,Т2, Т3 и т.д. Уровни S0, S1…S0 называются синглетными, при переходах между ними спин электрона не меняется, переход в триплетное состояние сопровождается обращением спина электрона. Молекула, попавшая на верхние колебательные уровни любого возбужденного состояния, быстро теряет энергию при столкновениях (колебательная релаксация) и переходит на 0-й колебательный уровень данного состояния. Безизлучательный переход между электронными состояниями разной мультиплетности называется ИНТЕРКОМБИНАЦИОННОЙ КОНВЕРСИЕЙ (рис.2).
Безизлучательный переход между электронными состояниями одинаковой мультиплетности называется ВНУТРЕННЕЙ КОНВЕРСИЕЙ.
Поглощение молекулой света процесс квантовый: энергия кванта должна быть равна разности энергии уровней, между которыми совершается переходы hv=Е2-Е1
Кроме того переход должен удовлетворять правилам отбора.
Такие переходы называются РАЗРЕШЕННЫМИ, а остальные - ЗАПРЕЩЕННЫМИ.
 Поглотив квант,
молекула становиться возбужденной
(активизация). Дизактивация молекул
происходит в результате процессов,
указанных выше а также излучательных
переходов с первого синглетного и
первого триплетного уровня на основной
(S1 S0
; Т1 S0).
Первый переход проявляется ФЛУОРЕСЦЕННИЕЙ,
а второй ФОСФОРЕСЦЕНЦИЕЙ, Общее
название для любых излучательных
переходов в молекуле (флюоресценция и
фосфоресценция) - ЛЮМИНЕСЦЕНЦИЯ.
Поглотив квант,
молекула становиться возбужденной
(активизация). Дизактивация молекул
происходит в результате процессов,
указанных выше а также излучательных
переходов с первого синглетного и
первого триплетного уровня на основной
(S1 S0
; Т1 S0).
Первый переход проявляется ФЛУОРЕСЦЕННИЕЙ,
а второй ФОСФОРЕСЦЕНЦИЕЙ, Общее
название для любых излучательных
переходов в молекуле (флюоресценция и
фосфоресценция) - ЛЮМИНЕСЦЕНЦИЯ.
На рисунке 2 прямые стрелки – поглощательные и излучательные переходы, волнистые линии –безизлучательные переходы.
Около каждого уровня в клетках показано направление спина возбужденного электрона по отношению к спину оставшегося электрона.
.
Рис..2 Электронные переходы в биомолекулах
III.СПЛОШНОЙ СПЕКТР.
Все раскаленные твердые и жидкие тела дают сплошной спектр, в котором в видимой области можно выделить семь основных цветов (от фиолетового до красного). В спектре нет разрывов и на экране спектрографа видна сплошная разноцветная полоса.
IV.ЛИНЕЙЧАТЫЙ СПЕКТР.
Раскаленные пары и газы в атомном (в молекулярном) состоянии при низких давлениях дают линейчатый спектр, состоящий из отдельных цветных линий. Эти линии определенным образом располагаются как в видимой, так и невидимой частях спектра.
V.ОБРАЩЕННЫЕ СПЕКТРЫ.
Если через раскаленные газы пропустить белый свет, то на сплошном спектре появляется ряд темных линий. Светящий газ или пар поглощает как раз те лучи, которые они сами испускают. Этот вид спектров назвали ОБРАЩЕННЫМИ спектрами газов.
VI.СПЕКТР ПОГЛОЩЕНИЯ.
На свойстве веществ излучать или поглощать (в зависимости от условий) строго определенный набор длин волн, основан качественный спектральный анализ - метод определения химического состава вещества по его спектру. С помощью спектрального анализа можно обнаружить данный элемент в составе сложного вещества, если его масса не превышает 10-10 грамм (это очень чувствительный метод). Количественный анализ состава вещества по его спектру затруднен, так как яркость спектральных линий зависит не только от массы вещества, но и от способа возбуждения свечения. При не очень высоких температурах многие спектральные линии вообще не появляются, однако при соблюдении стандартных условий возбуждения свечения можно проводить и количественный анализ. Приборы, позволяющие проводить спектральный анализ, называются спектроскопами. С помощью спектроскопа наблюдают спектр визуально. Фотографическое изображение спектра можно получить , используя более сложный прибор спектрограф.
